小檗碱的结构改造及其药理活性的研究进展
2014-08-06曹永兵姜远英孙青龑福建中医药大学福建福州350108第二军医大学上海00433
金 鑫,宋 霞,曹永兵,姜远英,孙青龑 (1.福建中医药大学,福建 福州 350108;.第二军医大学,上海 00433)
小檗碱(berberine,BBR)又称黄连素,属于季铵型异喹啉类生物碱,是中药黄连中的主要生物碱,其含量高达5%~8%,占黄连总生物碱的40%左右,不仅含量最高,且是其主要有效成分[1]。其分子式C20H18NO4,分子量336.37,其结构式见图1,常态下为淡黄色粉末,加热失水后为土黄色。在传统中医中被长期用于治疗由细菌感染引起的胃肠道疾病。近年来研究发现,小檗碱及其衍生物药理功能十分丰富,除抗菌、抗疟等活性外,小檗碱及其衍生物还具有抗病毒、治疗肿瘤、心血管疾病、降糖、调脂等多方面药理活性作用[2-5]。国内外许多学者对小檗碱进行了大量、深入的研究,不仅实现工业化的生物合成,而且通过对该类化合物的结构改造和修饰合成了一系列衍生物,并进行了相关的药理活性测试,获得了大量构效关系的信息。笔者对近年来在小檗碱及其衍生物的结构改造、修饰及其药理学活性研究中的最新进展和发现进行总结,希望能为该领域的研究者,特别是基于通过小檗碱结构改造而开发新药的研究工作者提供有益的思路和信息。
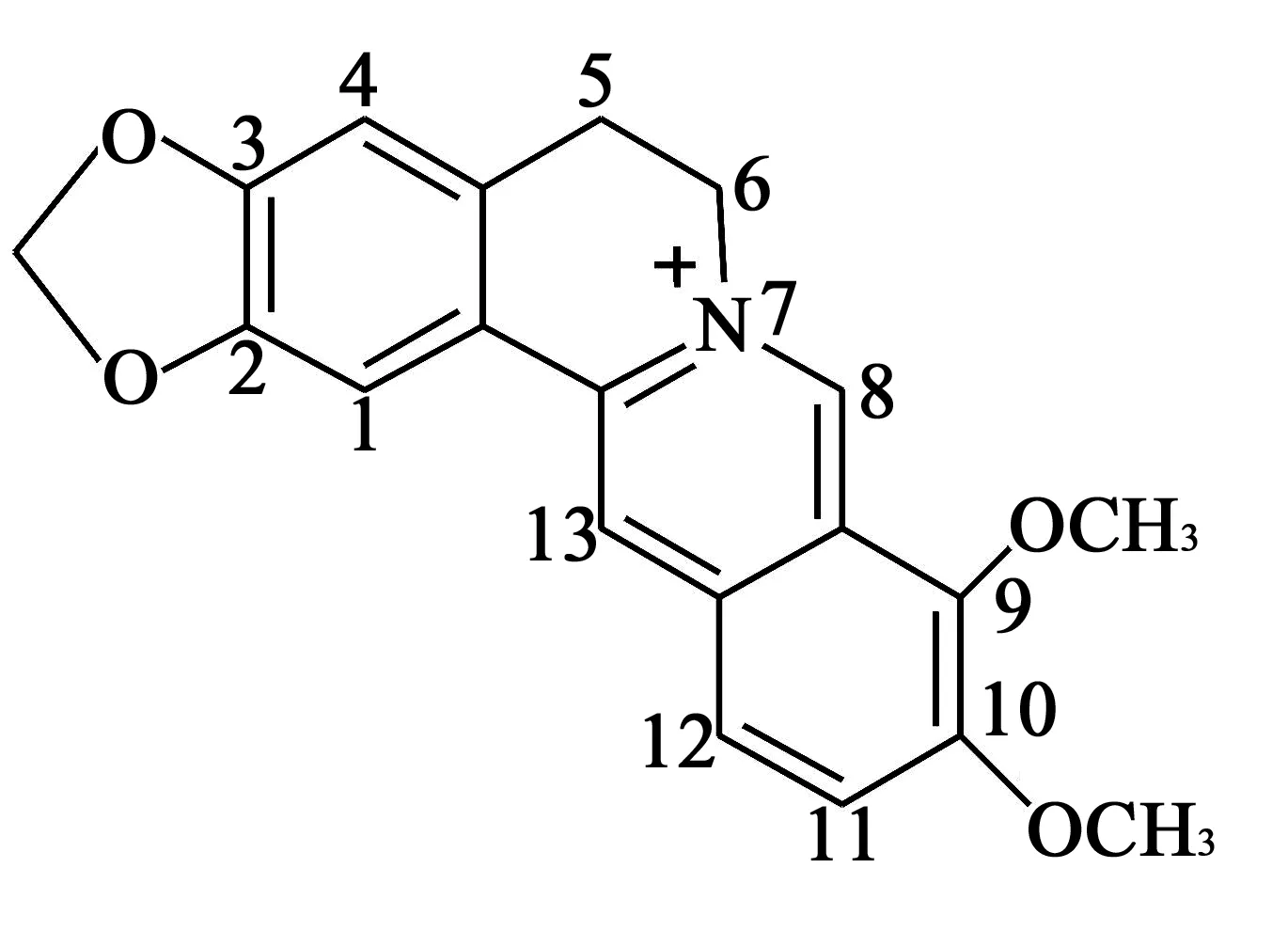
图1 小檗碱结构式
1 小檗碱单个位点的改造与修饰
小檗碱的单位点改造、修饰大都集中在7、8、9、12、13等位置,其中9、13位修饰较多。小檗碱单位点修饰的研究较多,其中7、8位的取代研究多围绕其抗菌活性展开,9位的取代衍生物被发现有较好的抗癌活性,有的还显示有抗病毒活性。13位的取代衍生物不但发现有较好的抗菌活性,还发现有的具有较好的抗疟疾活性。总的来说,小檗碱的单位点取代衍生的变化较多,而且此类衍物所表现出来的药理活性也比较丰富,值得进一步深入研究和探讨。
1.1 7位的改造与修饰 小檗碱的N(7)位是带有正电的季铵N。 在7位N原子上进行取代反应,首先要将小檗碱还原成二氢或四氢小檗碱,再用卤代化合物进行季铵化反应,随后便可生成7位N取代的衍生物[6]。由于在此位点进行结构改造和修饰会破坏小檗碱分子原有的结构特性,从而导致药理活性的丧失,所以在此位点的结构改造并不多见。
1.2 8位的改造与修饰 小檗碱C(8)位的取代活性主要以抗菌活性为主,研究的成果也较为丰富。已有研究显示,小檗碱8位的烷基取代具有较好的抗菌活性,并且其活性与取代烷基的亲脂性有密切联系。这可能与细胞膜为磷脂双分子层,增加取代衍生物的亲脂性有利于其进入细菌内部,从而发挥抗菌作用。杨勇等[7]通过观察小檗碱盐及其8位乙基、丁基、己基、辛基、葵基、十二基取代物对金黄色葡萄球菌、大肠杆菌、念珠菌、幽门螺杆菌等17种菌种的作用,发现8-辛基小檗碱盐酸盐的抗菌活性最好,比小檗碱盐高64~128倍,这也证实了取代烷基的亲脂性与抗菌活性的紧密关系。
小檗碱8位的一些取代衍生物也表现出了良好的降糖活性。Cheng等[8]通过动物实验发现8,8′-二甲基二氢小檗碱在治疗糖尿病方面比小檗碱具有更高的生物利用度,并且能有效的减少胰岛素抵抗和组织间三酰甘油的累积,能抑制血糖的快速上升,提高血糖耐受度。对治疗糖尿病有一定的作用。8-辛基小檗碱的卤化物,能降低高脂饲料喂养的Wistar大鼠的总胆固醇和三酰甘油水平,还能降低利用四氧嘧啶建立糖尿病模型小鼠的血糖[9]。Bustanji等[10]通过分子对接模拟发现小檗碱N原子的异喹啉阳离子能和人蛋白酪氨酸磷酸酶1B(h-PTP1B)的阴离子酸性位点ASP48结合,实验也证实小檗碱能竞争性抑制h-PTP1B在体外的重组,该机制还有可能是其降血糖的原因之一。
Wang等[11]研究发现一些小檗碱8位取代的衍生物具有良好的抗结核杆菌的作用,其中8位苯酚取代衍生物的抗结核杆菌能力最强,抗结核杆菌的MIC值为1.0 mg/ml,并且此化合物在临床上的效果也优于对肝脏副作用和神经毒性较大的利福平、异烟肼等传统抗肺结核药,对开发抗结核杆菌的新药研究提供了的方向。
1.3 9位的改造与修饰 小檗碱C(9)位上的改造、修饰变化比较多,药理活性也较丰富。9位取代的衍生物中有的表现出较好的抗肿瘤活性,这是今后抗肿瘤新药研究的热点之一。
Hoshi A[12]提出9位脂化衍生物具有广谱抗肿瘤活性和更高的治疗指数,并认为由于其在体内水解生成内铵盐的缘故使得小檗红碱酯类具有抗肿瘤活性,即分子中既存在带正电荷的季铵氮离子,又有带负电荷的酚离子,二者可以在分子内形成内铵盐,而内铵盐是抗肿瘤的活性结构,由于大多肿瘤细胞表面有明显的负电性,使得内铵盐中带正电的季铵离子可集中于细胞的表面,便于带负电荷的酚离子进入带正电荷的肿瘤细胞内部,从而发挥其抗肿瘤作用。大部分小檗碱9位上的取代反应都是通过小檗红碱(见图2)来实现的。
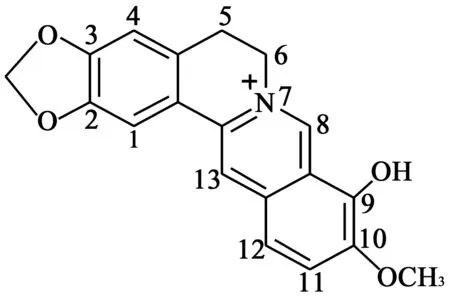
图2 小檗红碱结构式
大量研究发现这类化合物对G-四链体DNA具有较强的亲和力,对DNA聚合酶有较强的抑制,可以起到稳定DNA的作用。
9-氮取代衍生物为氨基或氮杂环取代,此类化合物能较好的和染色体G四链体选择性键合,并且对癌细胞株c-myc转录具有抑制作用,对肿瘤细胞有较高的毒性[13]。Chih等[14]研究发现9-O-苄基取代小檗碱与9-O-萜烯基取代小檗碱这类亲酯性取代对于肝癌细胞和结肠癌细胞具有显著的抗癌活性,其中化合物8对HepG2细胞的IC50=0.08±0.02 μmol/L,48 h。9-O-取代小檗碱衍生物具有成为新型抗癌药的巨大潜力。国外对9位修饰物的活性研究多集中在其与DNA的作用上,这方面的研究值得关注。
Pang等[15]设计合成了与CTDNA(小牛胸腺DNA)亲和力很强的9-O-乙胺小檗碱;Chen等[16]利用两分子小檗碱成功合成获得了小檗红碱二聚体,它与DNA的亲和力比小檗碱提高了100倍,这类化合物能显著增加与DNA的亲和力,大大增加了DNA的稳定性。
G-四链体是由4个鸟嘌呤作为基础发生交互作用结合成为一个正方形,它们是一种暂时性结构,大量存在于即将分裂的细胞之中,它们出现在染色体核和染色体终端(可以保护染色体免受损害)。由于癌细胞分裂非常迅速,在染色体终端经常出现缺陷,四重螺旋体DNA分子可能唯一存在于癌细胞,这对癌症的治疗提供了新的研究思路。Zhang等[17]报道9-脂肪氨基取代小檗碱衍生物,活性试验发现具有3个亚甲基和末端氨基的化合物能明显增强与G-四链体DNA的亲和力,并能有效抑制telomeril DNA(端粒DNA)扩增及DNA聚合酶的活性。如烷基环己氨小檗碱有很强的肮肿瘤作用,该化合物有望应用在抗癌药物中。Ma等[18]实验发现9-N取代的小檗碱衍生物能选择性地诱导和稳定原癌基因分子内平行G-四链体,能下调HL60淋巴瘤细胞系的原癌基因的转录。Ma等[19]又在小檗红碱C(9)位羟基上成功地接上一系列杂环化合物,活性试验研究发现这类衍生物对DNA末端G-四链体的选择性较高。Anirban等[20]设计合成了一系列9-O-N-芳烷基胺羰甲基小檗碱衍生物,研究发现这类化合物与DNA的结合能力比小檗碱要高出6倍。Ma等[21]研究发现小檗碱9-O取代的衍生物可以诱导端粒DNA序列形成反平行结构G-四链体, 显著地提高了端粒G-四链体的稳定性,有效地抑制了端粒的扩增; 而与双链DNA的相互作用则很小,是高选择性的端粒G-四链体配体。
LI等[22]设计合成一种9-O-胆汁酸小檗碱的衍生物,活性测试发现与小檗碱相比不仅生物利用度提高了,并且其对肝癌细胞具有较强的抑制作用,其中化合物最大抑制效果(50 μmol/L,72 h)为(95.0±4.0)%,相同条件下小檗碱为(74.7±3.9)%。这些化合物都显示出了较好的活性,不仅为以后抗癌药物的设计提供了新思路,还对进一步研究其作用机制提供了基础。
Kim[23]比较了小檗碱9位酰氧基和烷氧基取代对抗真菌活性影响,发现烷氧基衍生物相对于酰氧基衍生物具有更强的抗菌活性,其原因可能也与亲脂性有关。Hong等[24]研究了9位酰氧取代的小檗碱的抗菌活性,发现随着9位酰氧链的增长,其抗革兰阳性菌的活性随之增强,说明9位取代基亲脂性的增强也有助于抗菌活性的增强。其中9-月桂酰小檗碱的抗菌活性较强,尤其在抑制革兰阳性菌的活性方面远强于母体小檗碱。
小檗碱及其衍生物通过对乙酰胆碱酯酶的可逆性抑制,达到使乙酰胆碱(ACh)在突触处的积累,可以延长并且增加乙酰胆碱的作用。临床主要用于治疗重症肌无力和青光眼及抗老年性痴呆。Huang等[25,26]成功地在C(9)羟基上引入烷基醚类化合物,并发现9-O-丁基苯甲醚对乙酰胆碱酯酶的抑制能力最强。Wen等[27]设计了一系列C(9)氨基取代物通过活性测试发现此类化合物具有很好的抗氧化活性并且对乙酰胆碱酯酶有较好的抑制效果。其中9-甲基苯乙胺小檗碱的抗氧化和抑制乙酰胆碱酯酶的活性最强。Shi等[28]通过小檗红碱设计合成了一系列C(9)位被取代的三唑小檗碱衍生物,并研究了其对乙酰胆碱酯酶和丁酰胆碱酯酶的抑制作用,结果显示大多数此类小檗碱衍生物都能抑制乙酰胆碱酯酶,但对于丁酰胆碱酯酶的作用普遍低于乙酰胆碱酯酶,其中9-O-(4-异丙基胺-1-丁基)-三唑小檗碱衍生物对乙酰胆碱酯酶抑制作用最强。这些研究都为进一步研究乙酰胆碱酯酶抑制剂提供了方向。
Chen等[29]设计合成了9-O-糖基小檗碱,发现添加糖基这种亲水性基团后能显著提高小檗碱的生物利用度,并且这种化学结构的改变不会影响小檗碱的生物活性,提示人们或许可以利用这种特性来提高小檗碱及其衍生物的生物利用度,为前药的设计提供了新的方法。
Li等[30]利用小檗红碱酯类衍生物在体内能被一种酯酶水解成小檗红碱的特点设计合成了一系列C(9)位酯类小檗碱衍生物,并研究发现此类化合物能很好地清除血液中的低密度脂蛋白和总胆固醇,对脂肪肝和糖尿病有较好的治疗效果。
Hardik研究组[31]发现小檗红碱衍生物具有一定的抗HIV病毒作用,只是活性不如小檗碱强。
1.4 13位的改造与修饰 小檗碱C(13)位的取代具有多种生物活性,例如抗肿瘤、抗菌、抗疟疾活性等。
已有许多研究表明,小檗碱13位烷基取代的抗菌活性与8位烷基取代相似,发现13-烷基小檗碱衍生物其抗菌活性均随烷基链的延长而增强,这也提示此类烷基取代衍生物的抗菌活性与其取代基的亲脂性有着密不可分的联系。
Franceschin等[32]制备13-乙基吡啶盐酸盐小檗碱取代物,该化合物能选择性地与细胞生长周期G-四链体DNA结合,抑制端区酶活性,具有较好的抗肿瘤活性,并发现此种化合物可以增强G-四链体DNA的稳定性及对DNA聚合酶有抑制作用。Gornal等[33]研究了13-吲哚基取代小檗碱与G-四链体DNA的相互作用,发现其能选择性的与G-四链体结合而不与双链DNA结合,这对我们抑制肿瘤的扩增提供了新的思路。
Ball等[34]利用丙烯基三丁基锡在小檗碱C(13)位引入MDR抑制剂INF55得到一种C(13)位衍生物,该化合物对多种细菌都具有抑制作用。Samosom等[35]通过13-羟基小檗碱,再与卤代化合物反应生成C(13)位醚类衍生物,其中13-苄氧基衍生物(通过氧与小檗碱连接)有较好的抗真菌活性。此类衍生物通过阻碍NorA泵对抗菌药物的外排,使得胞内药物浓度上升,从而达到持续抗真菌的效果。活性最强的化合物对金黄色葡糖球菌的MIC值为1.7 μmol/L,是小檗碱抗真菌活性的382倍。Park等[36]制备13-芳香烃基衍生物,该类衍生物对人类各种致病真菌具有抗菌活性。进行构效关系研究,发现13-(4-异丙苄基)小檗碱衍生物对念珠菌属具有较好的体外抗菌活性(MIC=1.8 g/ml)。Yan等[37]研究发现13-辛基小檗碱具有良好的抗结核杆菌作用。Iwasa[38]对原小檗碱类化合物进行抗疟活性研究后发现,与抗真菌活性不同,在C(13)位引入亲脂性的烷基,抗疟活性反而降低,但取代烷基链的长短与活性变化并无必然的联系,这提示可能与此类分子进入结核杆菌的方式和途径有关。
2 小檗碱的多位点改造与修饰
小檗碱多位点修饰的研究由于合成难度加大,所以不如单个位点的修饰研究丰富,但已有的研究成果还是值得关注。
Park研究组[39]设计合成了一系列9位与13位同时被取代的小檗碱衍生物,并研究了其抑菌活性,结果表明,引入烷基能增强其抗菌活性,而酞基则会使其活性降低。其中9-0-丁基-13-(4-异丙基苄基)小檗碱的活性最强。Iwasa[40]发现小檗碱12位溴取代以后其抗菌活性较小檗碱要强,在此基础上在8位引入烷基,随着8位取代基烷基链的加长,抗菌活性逐渐增强。研究发现8-正己基-12-溴小檗碱表现出较强的抗菌活性,它能较好地抑制金葡菌、枯草杆菌、肠炎沙门菌、大肠杆菌和白色念珠菌,其活性要高于母体小檗碱。
Kim[41]发现小檗碱8位被烃基取代,碳原子数在1~10之间,13位杂环取代;2、3、9、10位是相同或不同的烷氧基取代,碳数在1~5之间,体外具有好的抗表皮丝状真菌活性。将小檗碱的8位和13位二氢化后并同时取代,并且将2、3、9、10位的取代基变为简单的短链烷烃、烷氧基、酰氧基等,经过动物实验表明,此类化合物具有改善糖耐量和胰岛素抵抗,缓解脂肪肝等效果[42]。
Bahar[43]合成一种5,6-二脱氢-8,8-二乙基-13-氧二氢小檗碱,此化合物表现出较好的抗疟活性(IC50=0.091 μmol/L),值得继续关注。
Beausoleil[44]合成了一系列多位点取代的小檗碱衍生物,实验表明当小檗碱的2、3、9、10位均为羟基取代时,对Rac1、Rac1b有较强的抑制作用,笔者通过研究已经知道Rac1、Rac1b过量会导致癌症的发生。因此,此类化合物对于预防癌症的发生具有一定的效果。
目前对小檗碱多位点取代的研究成果还不是很多,研究的范围也有很大的局限性,仍有很大的研究空间与潜力,值得我们继续深入探讨。
总之,有关小檗碱类化合物的报道很多,小檗碱及其衍生物的构效关系也是目前研究的热点之一,许多药理作用都有相应的构效关系研究的报道。其中针对抗菌、抗疟、抗肿瘤和降血脂所作的构效关系的研究是较为系统的。但还有许多药理作用的构效关系的文献报道较少或者不够深入,有较大的研究空间以供人们去探索。以小檗碱为先导化合物进行结构改造,研究其构效关系,充分考虑其多靶点调控疾病的机制,或可成为日后开发相关新药的一条重要途径。
【参考文献】
[1] 濮礼班,许翔鸿,张宇和,等.黄连生长状况及生物碱含量的个体差异[J].中草药,1999,30(5):375-377.
[2] 张韶湘,邹 澄,赵 庆,等.小檗碱衙生物的合成及药理活性研究[J].中国民族民间医药杂志,2007,86(03):167-186.
[3] 林 云,张 灿,华维一.原小檗碱类化合物的构效关系研究进展[J].药学进展,2002,26(2):76-80.
[4] 刘欣荣.天然药物小檗碱的临床用途[J].光明中医,2007,22(8):73-75.
[5] 李 波,朱维良,陈凯先.小檗碱及其衍生物的研究进展[J].药学学报,2008,43(8):773-787.
[6] Li YH,Yang P,Kong WJ,etal.Berberine analogues as a novel class of the low-density lipoprotein receptor up-regulators:synthesis,structure,activity relationships,and cholesterol,lowering efficacy[J].J Med Chem,2009, 52(2): 492-501.
[7] Yang Y,Ye XL,Li XG,etal.Synthesis and antimicrobial activity of 8-alkylberberine derivatives with a long aliphatic chain[J].Planta Med,2007,73(6): 602-604.
[8] Cheng Z,Chen AF,Wu F,etal.8,8-dimethyldihydroberberine with improved bioavailability and oral efficacy on obese and diabetic mouse models[J].Bioorg Med Chem,2010,18(16): 5915-5924.
[9] 西南大学.8-辛基小檗碱盐酸盐、合成方法及应用[P].中国,CN1974569A,2007-06-06.
[10] Bustanji Y,Taha MO,Yousef AM,etal.Berberine potently inhibits protein tyrosine phosphatase 1B: investigation by docking simulation and experimental validation[J].J Enzyme Inhib Med Chem,2006,21(2): 163-171.
[11] Wang YX,Fu HG,Li YH,etal.Synthesis and biological evaluation of 8-substituted berberine derivatives as novel anti-mycobacterial agents[J].Acta Pharmaceut Sinica B,2012,2(6): 581-587.
[12] Hoshi A,Ikekawa T,Ikeda Y,etal.Antitumor activity of berberrubine derivatives[J].Gann, 1976,67(2): 321-325.
[13] Ma Y,Ou TM,Hou JQ,etal.9-N-substituted berberine derivatives:stabilization of G-quadruplex DNA and down-regulation of oncogene c-myc[J].Bioorg Med Chem,2008,16(16):7582-7591.
[14] Lo CY, Hsu LC,Chen MS,etal.Synthesis and anticancer activity of a novel series of 9-O-substituted berberine derivatives:a lipophilic substitute role[J].Bioorg Med Chem Lett,2013,23(1):305-309.
[15] Pang JY,Qin Y,Chen WH,etal.Synthesis and DNA-binding affinities of monomodified berberines[J].Bioorg Med Chem,2005,13(20):5835-5840.
[16] Chen WH,Pang JY,Qin Y,etal.Synthesis of linked berberine dimers and their remarkably enhanced DNA-binding affinities[J].Bioorg Med Chem Lett,2005,15(10):2689-2692.
[17] Zhang WJ,Ou TM,Lu YJ,etal.9-substituted berberine derivatives as G-quadruplex stabilizing ligands in telomeric DNA[J].Bioorg Med Chem,2007,15(16):5493-5501.
[18] Ma Y,Ou TM,Hou JQ,etal.9-N-substituted berberine derivatives: stabilization of G-quadruplex DNA and down-regulation of oncogene c-myc[J].Bioorg Med Chem,2008,16(16):7582-7591.
[19] Ma Y,Ou TM,Tan JH,etal.Synthesis and evaluation of 9-O-substituted berberine derivatives containing aza-aromatic terminal group as highly selective telomeric G-quadruplex stabilizing ligands[J].Bioorg Med Chem Lett,2009,19(13):3414-3417.
[20] Basu A,Jaisankar P,Suresh KG,etal.Synthesis of novel 9-O-N-aryl/aryl-alkyl amino carbonyl methyl substituted berberine analogs and evaluation of DNA binding aspects[J].Bioorg Med Chem,2012,20(8):2498-2505.
[21] Ma Y,Huang ZSh.Synthesis and activity evaluation of 9-O-substituted berberine derivatives containing polyamine Chain as highly selective telomeric G-quadruplex stabilizing ligands[J].Chem J Chin Univ, 2012,33(10):2217-2222.
[22] Li QY,Zu YG,Liu TY,etal.Generation of reactive oxygen species by a novel berberine-bile acid analog mediates apoptosis in hepatocarcinoma SMMC-7721 cells[J].Biochem Biophys Res Commun,2013,433(4):432-437.
[23] Kim SH,Lee SJ,Lee JH,etal.Antimicrobial activity of 9-O-acyl-and 9-O-alkylberberrubine derivatives[J].Planta Med,2002,68(3):277-281.
[24] Hong SW,Kim SH,Jeun JA,etal.Antimicrobial activity of 9-O-acyl-and 9-O-benzoyl-substituted berberrubines[J].Planta Med,2000,66(4):361-363.
[25] Huang L,Shi A,He F,etal.Synthesis,biological evaluation,and molecular modeling of berberine derivatives as potent acetylcholinesterase inhibitors[J].Bioorg Med Chem,2010,18(3):1244-1251.
[26] Huang L,Luo Z,He F,etal.Synthesis and biological evaluation of a new series of berberine derivatives as dual inhibitors of acetylcholinesterase and butyrylcholinesterase[J].Bioorg Med Chem,2010,18(12):4475-4484.
[27] Shan WJ,Huang L,Zhou Q,etal.Synthesis,biological evaluation of 9-N-substituted berberine derivatives as multi-functional agents of antioxidant,inhibitors of acetylcholinesterase,butyrylcholinesterase and amyloid-β aggregation[J].Eur J Med Chem,2011,46(12):5885-5893.
[28] Shi AD,Huang L,Lu CJ,etal.Synthesis,biological evaluation and molecular modeling of novel triazole-containing berberine derivatives as acetylcholinesterase and beta-amyloid aggregation inhibitors[J].Bioorg Med Chem,2011,19(7):2298-2305.
[29] Chen Zh,Ye XL,Yi J,etal.Synthesis of 9-O-glycosyl-berberine derivatives and bioavailability evaluation[J].Med Chem Res,2012,21(8):1641-1646.
[30] Li YH,Li Y,Yang P,etal.Design,synthesis,and cholesterol-lowering efficacy for prodrugs of berberrubine[J].Bioorg Med Chem,2010,18(17):6422-6428.
[31] Bodiwala HS,Sabde S,Mitra D,etal.Synthesis of 9-substituted derivatives of berberine as anti-HIV agents[J].Eur J Med Chem,2011,46(4):1045-1049.
[32] Franceschin M,Rossetti L,D′Ambrosio A,etal.Natural and synthetic G-quadruplex interactive berberine derivatives[J].Bioorg Med Chem Lett,2006,16(6):1707-1711.
[33] Gornall KC,Samosom S,Talib J,etal.Selectivity of an indolyl berberine derivative for tetrameric G-quadruplex DNA[J].Rapid Commun Mass Spectrom,2007,21(11):1759-1766.
[34] Ball AR,Casadei G,Samosorn S,etal.Conjugating berberine to a multidrug efflux pump inhibitor creates an effective antimicrobial[J].ACS Chem Biol,2006,1(9):594-600.
[35] Samosorn S,Tanwirat B,Muhamad N,etal.Antibacterial activity of berberine-NorA pump inhibitor hybrids with a methylene ether linking group[J].Bioorg Med Chem,2009,17(11):3866-3872.
[36] Park KD,Lee JH,Kim SH,etal.Synthesis of 13-(substituted benzyl) berberine and berberrubine derivatives as antifungal agents[J].Bioorg Med Chem Lett,2006,16(15):3913-3916.
[37] Liu YX,Xiao CL,Wang YX,etal.Synthesis,structure-activity relationship andinvitroanti-mycobacterial evaluation of 13-n-octylberberine derivatives[J].Eur J Med Chem,2012,52:151-158.
[38] Iwasa K,Nishiyama Y,Ichmiaru M,etal.Structure activity relationship of quaternary protoberberine alkaloids havnig antimlaarial activity[J].Eur J Med Chem,1999,34:1077-1083.
[39] Park KD,Cho SJ,Moon JS,etal.Synthesis and antifungal activity of a novel series of 13-(4-isopropylbenzyl)berberine derivatives[J].Bioorg Med Chem Lett,2010,20(22):6551-6554.
[40] Iwasa K,Lee DU,Kang SI,etal.Antimicrobial activity of 8-alkyl-and 8-phenyl-substituted berberines and their 12-bromo derivatives[J].Nat Prod,1998,61(9):1150-1153.
[41] Kim JH.Pharmaceutically available protoberberine salts deriva-tives and protoberberine salte derivative,and protoberberin deriv-atives and salts thereof[P].US,008356.1999-12-28.
[42] 中国科学院上海药物研究所.13,13a-二氢小檗碱衍生物及其药物组合物和用途[P].中国,CN101153039A.2008-04-02.
[43] Bahar M,Deng Y,Zhu X,etal.Potent antiprotozoal activity of a novel semi-synthetic berberine derivative[J].Bioorg Med Chem Lett,2011,21(9):2606-2610.
[44] Beausoleil E,Chauvignac C,Taverne T,etal.Structure-activity relationship of isoform selective inhibitors of Rac1/1b GTPase nucleotide binding[J].Bioorg Med Chem Lett,2009,19(19):5594-5598.
