日本囊对虾精荚再生能力的研究
2014-08-06姚东明林琼武
林 莉,姚东明,林琼武,李 飞
(厦门大学海洋与地球学院,福建 厦门 361102)
从20世纪70年代至今,我国的对虾养殖业在经历了诸多磨难之后,已经发展为渔业经济的支柱产业.日本囊对虾(Marsupenaeusjaponicus)不仅具有个大、体色鲜艳悦目和肉质口感好等特点,同时还具有离水性好,适合活虾运输和市场价格高的优势,而且,与凡纳滨对虾(Litopenaeusvannamei)、斑节对虾(Penaeusmonodon)和中国明对虾(Fennerpenaeuschinensis)在生态习性上有着很强的互补性.因此,日本囊对虾在我国对虾养殖业扮演着越来越重要的角色.
目前,在对虾繁殖生产方面,业者至今习惯沿用从自然海区捕获的已交配的成熟雌虾,而在对虾生殖生物学研究方面,学者的兴趣也主要集中在雌虾的生殖系统及卵的发育[1-6],而对雄虾相关的研究仅在雄虾生殖系统的结构、促雄腺的结构、作用及精子的形态、发生[7-10],输精管内精荚的超微结构和形成[11-13],有关雄虾精荚再生的研究只见一些零星的报道[14-16],迄今日本囊对虾在精荚人工移植、经产雌虾再交配技术上尚未突破,因而有关精荚再生的研究更是难得一见,这也是日本囊对虾养殖业的规模化、产业化远不及凡纳滨对虾和斑节对虾主要原因[2,16].因此,开展日本囊对虾精荚再生能力和再生精荚质量的研究势在必行.本文主要报道了日本囊对虾精荚的若干重要参数、再生次数、再生时间间隔、再生精荚质量差异以及具有不同精荚再生能力的个体在亲虾群体中比例分布的实验结果,以期为对虾繁殖生物学和遗传育种学提供理论资料,为日本囊对虾雄亲虾资源的利用和保护提供科学依据.
1 材料与方法
1.1 实验材料
本实验在漳州漳浦宏运水产育苗场进行.成熟雄虾捕自台湾海峡自然海区,采用低温木屑无水包装法将亲虾运至实验场;雌虾是经育苗场生产使用过的亲虾,处于即将脱壳或已蜕壳,购自漳浦大尾鱼水产育苗场,采用虾苗袋充氧且低温(14~16 ℃)运输至实验场.
雌、雄亲虾分开驯养.入池前经缓慢升温复苏,再经高锰酸钾溶液(质量浓度为30 g/m3)消毒处理,移入带有海沙底的水泥池内(水温17~19 ℃,盐度30~32,pH值7.8~8.3)进行喂养,养殖池长宽规格为423 cm×138 cm,水深(40±5) cm,全程充气.雄亲虾在实验之前需在适宜的条件下暂养3~5 d.池内不间断通气,每天进行1次换水(日换水量为总水量的1/3~1/2)并使用虹吸管吸出残饵和粪便,每日投饵次数为2次,分别为早上10:00和晚上19:00,早上投喂很少,晚上投喂量较多,日投饵量为亲虾体质量的10%~20%,视摄食情况酌情增减,饵料为新鲜杂色蛤仔(Ruditapesvariegata)和近江牡蛎(OstrearivularisGould).控制好光线、培育密度等.观测到雌虾即将产卵,将其移入促熟池[2].
1.2 实验方法

表1 日本囊对虾的体长、体质量及精荚若干参数(n=72)Tab.1 Body length、body weight and main parameters of spermatophore in Marsupenaeus japonicus(n=72)
1.2.1 亲虾个体标记
将硬纸板剪成的圆形小片作为编号牌,用小刀刻上编号.制作时注意修整纸板边缘,避免留下易对亲虾造成伤害的刺突.然后用尼龙绳将编号牌系在亲虾眼柄基部,作为个体标记,方便实验中追踪每尾雄虾各自不同的精荚再生情况,同时在研究再生精荚质量时,用此法对比个体内不同批次的精荚质量,从而消除不同雄虾个体之间的差异,使结论更能反映不同批次精荚的真实情况.
1.2.2 精荚的采集
精荚的采集是以袁路等[15]和李飞[16]的人工挤压法和洪心等[17]的夹取法为基础,将2种方法结合,即人工挤压-夹取法,轻压雄虾第五步足基节的基部,然后用消毒镊子取出精荚.采集完成后,把雄虾放回暂养池,观察其复苏状况,避免其出现侧卧现象.
1.2.3 体外人工授精
采用湿法授精,即从性成熟的雌虾中取出卵巢,并剪开精荚,同时将两者在装有过滤海水的培养皿中轻轻抖动,使精子、卵子于海水中充分混合,30 min后,用注射器吸弃海水,再注入新鲜过滤海水,重复换水3次后,吸取适量卵子于显微镜下统计受精率.
1.2.4 精子活体染色
将精荚剪碎,让精荚内精子充分释放,加入1 000 mL海水进行稀释,制成精子悬液.用伊红苯胺黑染色法进行染色,取5 μL精子悬浮液于载玻片中央,再滴加5 μL 0.5%(质量分数)伊红染液和5 μL 10%(质量分数)苯胺黑染液,使三者混合均匀,染色3 min,盖上盖玻片,在400×的显微镜下检验.在显微镜下,活精细胞不被着色,死精细胞被染成红色,而畸形精细胞则呈非圆球状.
1.2.5 精荚再生的观测
以海捕雄虾原有精荚为初始精荚,在每次获取精荚后,每天观察手术后雄虾精荚再生情况及不同雄虾在人工获取精荚条件下,精荚能够再生的批次数,记录下不同批次精荚再成熟的时间.同时,采用挤压-夹取法获取再生精荚,测定其精子合格率、精子数、受精能力.建立亲虾个体档案.实验亲虾共72尾,其中9尾亲虾无法完成精荚再生,63尾亲虾精荚可再生1次,表示为第1批再生精荚,记为F;58尾亲虾精荚可再生2次,表示为第2批再生精荚记为S;32尾亲虾精荚可再生3次,表示为第3批再生精荚记为T.
1.2.6 精荚若干参数的说明
精荚质量:用挤压-夹取法获取新鲜精荚,以最小称量单位为0.01 g的电子天平称量每个精荚的质量.
精子总数:将每个精荚放入玻璃研钵中,并加入2 mL的生理盐水,移液枪吸取200 μL到5 mL的离心管中,再加入2 800 μL生理盐水,然后按照上述过程再稀释1次.之后,用滴管吸取一定量的精子悬浮液,滴到计数板上,用常规细胞计数法计算精子数量.
精子数(25格×16格)=80小格内细胞个数/8×400×10 000×稀释倍数×2.
精子合格率=1-(死亡精子+畸形精子)/精子总数.
受精能力:采用湿法授精,以卵子的受精率作为衡量精荚的精子授精能力的指标.
1.2.7 数据处理
实验数据用SPSS和Excel分析处理,数据结果用“平均值±标准误差”的形式表示.
2 结 果
2.1 日本囊对虾精荚的主要参数及其相关性分析
海捕雄虾经暂养,精荚首次成熟后所测的主要参数见表1,其中体质量和精荚质量的变异系数都比较大.体质量、体长与精荚质量的关系见图1和2.
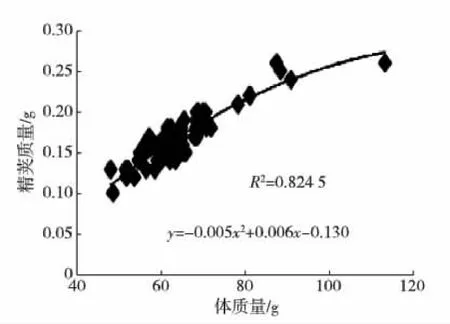
图1 精荚质量与虾体质量关系Fig.1 The correlation between spermatophore weight and body weight
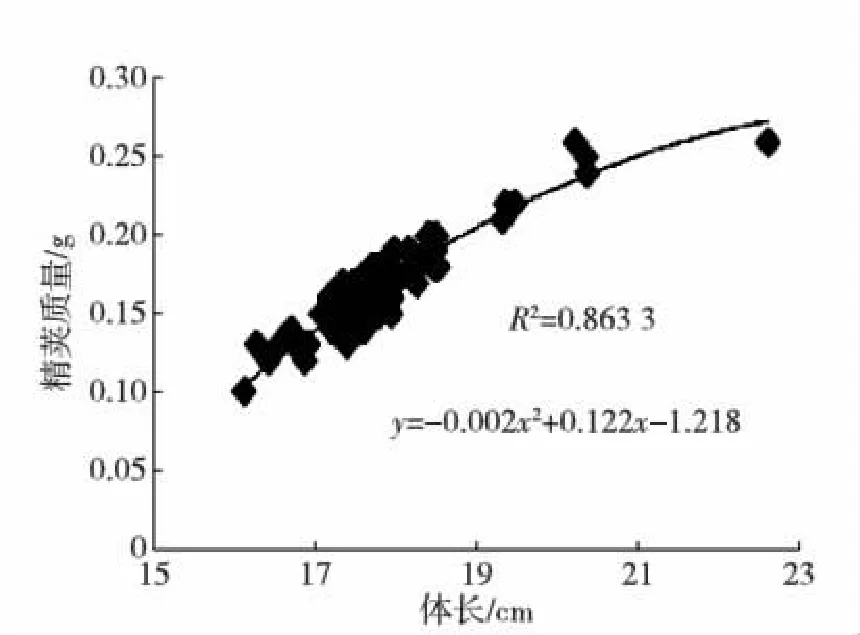
图2 精荚质量与体长关系Fig.2 The correlation between spermatophore weight and body length
根据双变量相关性分析结果,体长、体质量、精荚质量三者之间存在着显著的正相关关系(p<0.01).精子合格率、受精能力、精子总数与其他变量之间的相关性都不高(p>0.05).
2.2 日本囊对虾精荚再生的次数和时间间隔
2.2.1 日本囊对虾亲虾群体中不同精荚再生能力的个体占群体总数的比例分析
具有不同精荚再生能力的个体在亲虾群体中的比例分布见图3.由图可知,雄亲虾群体再生能力的不同个体比例在44.44%~87.50%内,且雄亲虾在一个蜕壳周期内精荚可再生1~3次,平均为2次.
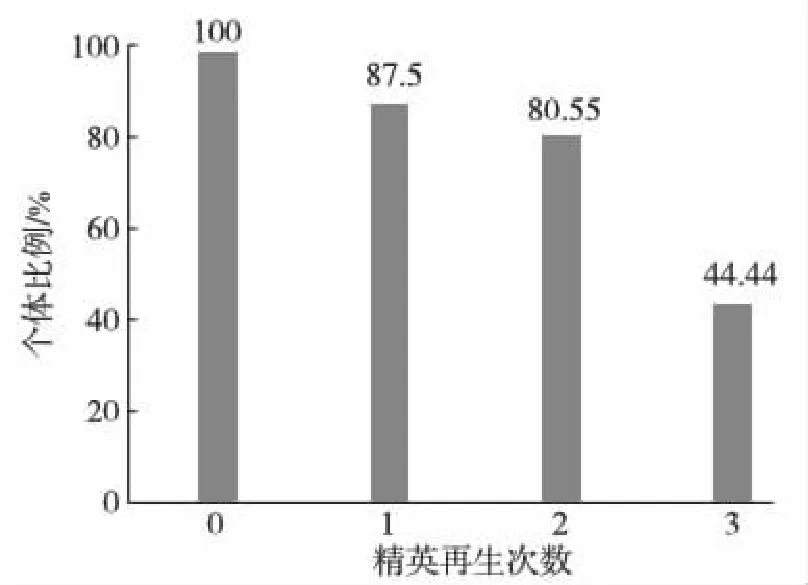
图3 日本囊对虾亲虾群体中具不同精荚再生能力的个体占总数的比例Fig.3 The proportion of individuals with various regeneration ability in the population of male broodstock M. japonicus during spermatophore regeneration
2.2.2 日本囊对虾精荚再生的时间间隔及其差异分析
日本囊对虾雄亲虾第2批及第3批再生精荚每次再生的时间见表2.

表2 不同批次精荚每次再生的时间Tab.2 Duration of different batches of spermatophore regeneration
对表2数据进行线性相关分析,可知无论是第2批精荚还是第3批精荚,它们前后2次再生时间均无显著的线性相关关系.同时,第1次再生时间与第2次再生时间间隔不存在显著差异(p>0.05);第2次再生时间与第3次再生时间间隔也不存在显著差异(p>0.05).
可以初步判断,精荚再生的时间间隔为5~7 d,随精荚再生次数的递增间隔的时间有延长的态势,但差异不明显(p>0.05).
2.3 日本囊对虾不同批次再生精荚质量的比较
以精荚质量、精子总数、精子合格率及受精能力作为评判不同批次再生精荚质量参数,结果见表3,其中实验亲虾共72尾,9尾无法完成精荚再生.
由结果可知,在第1批次再生精荚中初始精荚在精荚质量、精子总数、受精率上都极显著地大于第1次再生精荚(p<0.01).而初始精荚的精子合格率显著高于第1次再生精荚(p<0.05).
在第2批次再生精荚中第1次再生精荚精子总数少于第2次再生精荚,精子合格率、受精率高于第2次再生精荚.且第1次再生精荚与第2次再生精荚,在精子总数、精子合格率、受精率上都存在有极显著差异(p<0.01).第1次再生精荚质量显著高于第2次再生精荚质量(p<0.05).
在第3批次再生精荚中第2次再生精荚精子总数大于第3次再生精荚,但二者无显著差异(p>0.05),第2次再生精荚的精子合格率、受精率都极显著高于第3次再生精荚(p<0.01).第2次再生精荚质量显著大于第3次再生精荚质量(p<0.05).

表3 不同批次再生精荚质量的差异Tab.3 The differences of spermatophore quality between different regeneration batches
注:Fn0、Fn1表示第1批再生中初始精荚、第1次再生精荚;Sn1、Sn2表示第2批再生中第1次、第2次再生精荚;Tn2、
Tn3表示第3批再生中第2次、第3次再生精荚.
因此,精荚的质量、精子合格率和受精能力随再生次数增多呈下降趋势,差异显著(p<0.05).而精子总数在不同批次随再生次数增多总体呈上升趋势,差异显著(p<0.05);但在同一批次的再生精荚中精子总数呈现上下起伏波动,即在第1批次与第3批次中精子总数随再生次数增加均下降,在第2批次中精子总数随再生次数增加明显上升(p<0.01).
3 讨 论
3.1 不同获取精荚的方法对雄虾精荚再生的影响
精荚获取方式对雄虾精荚再生的影响如何,已引起许多学者的关注.洪心[17]分别对斑节对虾和长毛明对虾(P.penicillatus)的雄亲虾采用挤压法获取精荚,发现斑节对虾壳厚,不易获得精荚,还会因操作不当导致雄亲虾受伤死亡;而长毛明对虾壳薄,虽可获得精荚,但往往因挤压时力度掌握不当,引起雄亲虾损伤,甚至死亡.另外,对2种雄亲虾采用虹吸法获取精荚发现均无法吸出完整的精荚.张伟权等[18]应用高频电针法对凡纳滨对虾获取精荚,发现用此方法获取精荚的成功率及获取精荚后雄虾的存活率均为100%,且取得的精荚内精子无需“获能”即可使卵子授精.李飞[16]通过对比夹取法和电刺激法对日本囊对虾精荚再生的影响,发现夹取法获取多批次雄虾精荚后,精荚质量快速下降;而电刺激法获取的精荚质量相对较为稳定.在本实验中采用挤压-夹取法人工获取再生精荚,发现在前2次人工获取精荚后,雄虾存活情况较为稳定,死亡率不超过15%,但第3次人工获取后,死亡率上升,至第4次人工获取后,雄虾全部死亡;且伴随再生批次增加,对虾再生精荚质量呈下降趋势,与前面研究相符合.Pratoomchart[19]和Rosas等[20]也报道其他种类在实验室条件下,再生精荚精子数量和质量下降的研究结果.
可以认为电刺激法对雄虾伤害较小,精荚再生率高,获取的精荚质量相对较为稳定;而夹取法对雄虾伤害较大,机体的应激反应较强,精荚的再生率和个体存活率逐渐降低,所获取的多批次精荚的质量快速下降.因此,本实验采用挤压-夹取法获取精荚较电刺激法在效果上有所欠缺,但此法操作简便易行,且整个实验过程,尽可能地减少亲体的损伤和死亡,获得了完整、健康的实验精荚,达到了预期的实验结果.且在选用养殖日本囊对虾雄虾精荚进行人工受精时,应当挑选再生批次较少的雄虾(即挑选精荚可再生1~2次的雄虾)获取精荚.
3.2 对虾亲虾性腺再成熟能力的个体差异
雌亲虾性腺再成熟能力的个体差异问题已有很多报道[21-23].林琼武等[3]探讨了日本囊对虾再交配、亲虾多次产卵及其卵子质量的关系,实验结果表明日本囊对虾亲虾多次产卵的卵径、孵化率和无节幼体不受产卵次数的影响,而卵径和无节幼体体长与再交配亲虾个体大小关系不明显.雄虾的精子合格率、受精能力反映的是精子质量的指标,与前者相互对应,本实验结果表明其均与亲体大小无关.袁路等[15]在对凡纳滨对虾的研究中也发现,个体大小接近的凡纳滨对虾精荚质量与精子质量没有显著相关关系,雄虾的精子数量与个体大小无关,同样与本文结果相一致.
在本实验中个体大小相近的对虾的精荚质量和精子数量没有相关关系,这是因为精荚由精子团、精荚基质和精荚壁3部分组成,并不由精子团单一决定[24],因此,质量大的精荚精子数量不一定就多.对于甲壳动物十足类精荚,每个精荚内所含有的精子数差异很大,一般范围在几个至几百个不等,多的会达到上千个[13].这表明精子是在精荚形成的过程中被随机包被的.本研究还表明了精子数量与体长、体质量和精子合格率均无显著相关性.
因此,个体大小与精荚质量并不具有显著的相关性,以个体大小作为选择优质日本囊对虾精荚的考量标准,可靠性不足.对于日本囊对虾精荚质量评价的间接指标,有待进一步探索.
3.3 对虾再生精荚的质量问题
影响对虾再生精荚的因素有很多.王清印等[14]、杨丛海等[25])研究了雌雄性比对中国明对虾精荚再生的影响,认为充足数量雌对虾的存在对于雄虾精荚的再生和发挥雄对虾的交配能力可能有促进和诱导作用.袁路等[15]研究了温度、盐度对凡纳滨对虾精荚再生和精子质量的影响,认为温度与精荚质量有一定的相关关系,温度低,精荚较重.温度在26 ℃时,对虾精子质量最好,温度越高,蜕皮周期越短,精荚再生时间也越短,但精子质量下降也很迅速.盐度为15条件下精子发育良好.随着实验养殖时间的延长和精荚再生次数的增加,对虾的精子质量总体呈下降趋势,尤其在高温和低盐条件下易导致精子畸形.然而,再生批次的增加伴随着再生精荚质量下降,二者的联系,在不同的虾种间,可能存在差异.斑节对虾第1次与第2次(间隔15 d)获取的精荚,在精荚的质量、精子的数量,以及畸形精子百分率上没有差异,这就表明连续获取精荚对精荚质量不会有影响[26].Gomes等[27]也曾连续6个星期观察到,从斑节对虾雄虾身上获取精荚,精子的质量和数量不会下降.对凡纳滨对虾和细角滨对虾(Litopenaeusstylirostris)连续获取精荚,会导致精子数量和质量的提高[28].
获取精荚的时间间隔也是影响因素之一.斑节对虾2次获取精荚的时间间隔在15 d时,并不影响精荚的总精子数和畸形精荚的数量,所以证明15 d的间隔是安全有效的[26].但是Sampath等[29]也对斑节对虾的2次获取精荚的时间间隔做了研究,结果表明只有时间间隔小于6 d时,会导致精荚质量下降.
日本囊对虾再生精荚退化,将对实际应用产生重大影响.通过改变温度和盐度等环境因子、调节雌雄性比、调整获取精荚时间间隔、进行切除眼柄、或是使用其他获取精荚操作,能否改善再生精荚质量,延缓甚至消除精荚再生退化,将是下一步研究的重点.
[1] 赖秋明,钟际伟.三亚产斑节对虾亲虾产卵量的测定[J].现代渔业信息,1999,14(4):5-10.
[2] 林琼武,黄加祺,李少菁.日本囊对虾亲虾集约促熟及若干问题的探讨[C]∥黎中宝,主编.甲壳动物低碳养殖与健康安全——第七届世界华人虾蟹养殖研讨会论文集论文.厦门:厦门大学,2011.
[3] 林琼武,张黎黎,李少菁.日本囊对虾的多次产卵及其与早期子代质量的关系[C]∥中国甲壳动物学会第十一届年会暨学术研讨会论文摘要集.青岛:中国海洋湖沼学会,2011.
[4] 楼丹.浙江象山港中国对虾怀卵量及相对生殖力研究[J].海洋渔业,1990,12(6):260-262.
[5] 胡晴波,余德恭,滕世栋,等.人工控制越冬长毛对虾卵巢成熟的初步探究[J].海洋与湖沼,1989,20(2):178-183.
[6] 严正凛.日本对虾卵巢促熟技术研究[J].热带海洋,1995,14(2):47-52.
[7] 堵南山,赖伟,安婴,等.中华绒鳌蟹受精的细胞学研究[J].中国科学:B辑,1992(3):260-266.
[8] 堵南山,赖伟,薛鲁征.中华绒鳌蟹精子的研究I.精子的形态及超微结构[J].海洋与湖沼,1987,18(2):119-126.
[9] 堵南山,薛鲁征,赖伟.中华绒鳌蟹精子的研究II.精子发生[J].海洋与湖沼,1988,19(1):71-76.
[10] 林勤武,刘瑞玉,相建海.中国对虾精子的形态结构、生理生化功能的研究Ⅰ.精子的超显微结构[J].海洋与湖沼,1991,22(5):397-401.
[11] 邱高峰,堵南山,赖伟.日本沼虾雄性生殖系统的研究:Ⅲ.输精管内精荚的结构与形成[J].动物学报,1997,43(1):68-73.
[12] 王兰,堵南山,赖伟.长江华溪蟹输精管的超微结构与精荚形成的研究[J].海洋与湖沼,1996,27(4):373-379.
[13] 王群,赵云龙,黄勃,等.甲壳动物十足类精荚的研究概况[J].海洋科学,2000,24(3):22-24.
[14] 王清印,李健,孙修涛,等.中国对虾雄对虾交配能力和精荚再生的研究[J].海洋与湖沼,1998,29(1):22-28.
[15] 袁路,蔡力生.温度、盐度对凡纳滨对虾精荚再生和精子质量的影响[J].水产学报,2006,30(1):63-68.
[16] 李飞.日本囊对虾精荚人工移植及其繁殖性能的研究[D].厦门:厦门大学,2013.
[17] 洪心.人工移植精荚技术在斑节对虾育苗中的应用[J].福建水产,2012,34(4):73-77.
[18] 张伟权,于琳江,童保福.南美洲白对虾全人工授精技术研究[J].海洋与湖沼,1993,24(4):428-432.
[19] Pratoomchart B.Spermatophore regeneration in pond-rearedPenaeusmonodonFabricius[J].Journal of Aquaculture in the Tropics,1999,14(4):255-259.
[20] Rosas C,Sanchez A,Chimal M E,et al.The effect of electrical stimulation on spermatophore regeneration in white shrimpPenaeussetiferus[J].Aquatic Living Resources,1993,8:139-144.
[21] 高学兴,齐玉祥,吴志广,等.中国对虾(PenaeuschiensisOsbeck)性腺多次培育、多次产卵的应用研究[J].河北渔业,1988(1):13-15.
[22] 蔡生力,戴习林,藏维玲,等.南美白对虾的性腺发育、交配、产卵和受精[J].中国水产科学,2002,9(4):335-339.
[23] Racotta I S,Palacios E,Ibarra A M.Shrimp laval quality in relation to broodstock condition[J].Aquaculture,2003,227:107-130.
[24] Palacios E,Racotta I S.Spawning frequency analysis of wild and pond-reared Pacific white shrimp,Penaeusvannameibroodstock under large-scale hatchery condition[J].J World Aquac Soc,1999,30(2):180-191.
[25] 杨丛海,戴芳钰,周银妹,等.影响对虾交尾的几个主要因素[J].海洋水产研究丛刊,1990,32:1-4.
[26] Bart A N,Choosuk S,Thakur D P.Spermatophore cryopreservation and artificial insemination of black tiger shrimp,Penaeusmonodon(Fabricius) [J].Aquacult Research,2006,37:523-528.
[27] Gomes L A O,Honculada P J.Reproductive quality of malePenaeusmonodon[J].Aquaculture,1993,112:157-164.
[28] Alfaro J.Reproductive quality evaluation of malePenaeusstylirostrisfrom a grow-out pond [J].Journal of the World Aquaculture Society,1993,24:6-22.
[29] Sampath K,Ramachandran T.Spermatophore collection inPenaeusmonodonby electrical stimulation [J].Aquaculture in the Tropics,1999,14:193-199.
