慢性乙型肝炎抗病毒治疗进展
2014-08-06刘自贵
刘自贵
(四川大学华西临床医学院,四川 成都 610041)
慢性乙型肝炎(chronic hepatitis B,CHB)是严重健康问题之一。全球CHB约3.5亿,是导致肝硬变和肝细胞癌(hepatocellular carcinoma,HCC)的主要原因之一[1],部分伴肝脂肪变性[2]对CHB预后有一定影响。我国是CHB高发区,HBsAg携带者1.2亿,慢性病例约1 200万,每年约30万人死于肝病。CHB的治疗目标是最大限度地抑制乙型肝炎病毒(hepatitis B virus,HBV),减轻肝脏炎症坏死及纤维化,延缓疾病进展,减少肝脏失代偿、肝硬变、HCC及其并发症的发生,改善患者生活质量和延长存活时间。治疗原则包括抗病毒、免疫调节、抗炎、抗纤维化等。目前认为抗病毒是CHB治疗的关键。抗病毒药物主要作用是提高机体免疫清除能力和抑制病毒复制。美国、欧洲国家、亚太地区国家以及我国先后制定和修订的CHB治疗指南[3]或共识,为有效抑制病毒起了重要作用。
1 CHB抗病毒治疗与疗效评价
1.1 抗病毒治疗适应证 CHB抗病毒疗效与患者免疫状态密切相关。血清ALT常是免疫功能激活与否的标志,也是抗病毒指征之一。CHB防治指南[3]提出抗病毒治疗适应证为:①HBeAg阳性患者HBV DNA≥105拷贝/mL,HBeAg阴性患者HBV DNA≥104拷贝/mL;②ALT>2倍正常值(ULN);如用干扰素(Interferon,IFN)治疗,ALT≤10 ULN,血清总胆红素<2 ULN;③如ALT<2 ULN,但肝组织学Knodell HAI≥4,或炎症活动度(G)≥G2。具有①并有②或③可进行抗病毒治疗。
持续HBV DNA阳性、ALT<2 ULN,有以下情况之一也可抗病毒:ALT>1 ULN、年龄>40岁;ALT持续正常、年龄>40岁密切随访,如肝组织Knodell HAI≥4,或≥G2,或纤维化程度(S)≥S2;疾病进展者肝活检,必要时抗病毒。
需排除药物、酒精和其他因素所致ALT升高,也应排除降酶药物使ALT暂时正常;乙肝肝硬变血清AST水平可高于ALT,如AST>2 ULN也可考虑抗病毒治疗。
1.2 抗病毒疗效评价
1.2.1 单项指标应答 ①病毒学应答,指血清HBV DNA检测不到(PCR法,以下相同)或低于检测下限,或较基线下降≥2 log10;②血清学应答,指HBeAg转阴或HBeAg血清学转换(即HBeAg转阴且抗HBe阳转)或HBsAg转阴或HBsAg血清学转换(即HBsAg转阴且抗HBs阳转);③生化学应答,指ALT和AST恢复正常;④组织学应答,指肝组织炎症坏死或纤维化程度改善达到某一规定值。
核苷(酸)类似物(ANs)能显著降低血清HBsAg水平[4],白细胞介素(IL)-21是独立于HBV DNA和ALT的较强预测指标[5],HBV前C区变异可预测基因型B和C血清学转换时间[6]。因此检测HBsAg、IL-21水平或HBV前C区变异也可作为应答指标。
1.2.2 时间应答 ①初始或早期应答,指治疗12周时病毒学、血清学、生化学或组织学应答。②治疗结束时应答,指治疗结束时病毒学、血清学、生化学或组织学应答。③持续应答,指治疗结束后随访1年以上疗效维持不变,无复发。
1.2.3 联合应答 ①完全应答,指HBeAg阳性CHB治疗后ALT恢复正常,HBV DNA检测不出和HBeAg血清学转换;HBeAg阴性患者治疗后ALT恢复正常,HBV DNA检测不出。②部分应答,介于完全应答与无应答之间,如HBeAg阳性患者治疗后ALT恢复正常,HBV DNA<105拷贝/mL,但无HBeAg血清学转换。③无应答,指未达到以上应答者。
2 CHB抗病毒药物及用法
2.1 核苷(酸)类似物 作用于逆转录酶抑制病毒复制,具有起效快、作用强、服用方便、不良反应少等特点。由于清除病毒难,治疗期间HBsAg消失率较低,病毒复发率较高[7],需要长期用药因而可发生耐药突变。NAs分3类[8]:包括L-核苷类、无环核苷磷酸盐化合物及鸟苷类相似物,均不影响细胞色素P450酶,药物相互作用少。
2.1.1 L-核苷类 包括拉米夫定(lamivudine,LAM)、恩曲他滨(Emtricitabine,FTC)和替比夫定(Telbivudine,LdT)。LAM、FTC为胞啶类似物,LdT是胸苷类似物。药物在胞内磷酸化为5′-三磷酸活性产物,掺入HBV DNA后与天然底物竞争而抑制DNA聚合酶导致DNA链终止。生物利用度不受食物影响。LAM抑制病毒活性较强,HBeAg阳性患者用后HBV DNA和ALT的中位数水平明显下降,部分伴随HBeAg阴转或HBeAg血清学转换。LdT治疗HBeAg阳性与阴性患者,HBV DNA下降至检测不出、ALT复常率、肝组织学应答率、耐药发生率均优于LAM,但 HBeAg血清转换率与LAM相似。主要不良反应为肝脂肪变性、乳酸酸中毒、肌病、肌酸激酶(CK)升高及周围神经病变等,尤其是CK可明显升高。
2.1.2 无环核苷磷酸盐化合物 有阿德福韦酯(adefovir,ADV)和替诺福韦(tenofovir,TDF)2种药物。ADV抗病毒效能最弱,TDF是效能最强药物之一。属腺苷单磷酸盐类物,在细胞内磷酸化为活性代谢产物而竞争性抑制HBV。ADV大剂量可出现近端肾小管功能缺陷及Fanconi综合征,血肌酐升高。肾功损害或已用肾毒性药物者慎用。生物利用度不受食物的影响。TDF肾毒性较小,可有骨密度下降。高脂饮食后口服生物利用度升高。HBV DNA转阴率、生化应答率均高于ADV,但HBeAg转换及组织学应答率无明显差异。对LAM耐药者也有效,长期使用耐药率较低。
2.1.3 鸟苷类相似物 唯一药物为恩替卡韦(entecavir,ETV),是抗病毒效能最强药物之一。经磷酸化成为具有活性的三磷酸盐,通过与HBV聚合酶天然底物三磷酸脱氧鸟嘌呤核苷竞争,抑制聚合酶的3种功能:即多聚酶启动、自mRNA前基因组反转录负链以及HBV DNA正链合成。对CHB的HBV DNA下降、ALT复常、肝组织学改善均优于LAM。不良反应较轻,如头痛、腹泻、关节痛、失眠等。
2.1.4 治疗方法
2.1.4.1 有治疗指征的CHB 可用 LAM 100 mg/d,或ADV 10 mg/d,或ETV 0.5 mg/d,或LdT 600 mg/d。基础疗程1年,HBeAg阳性CHB,HBV DNA转阴、ALT复常且HBeAg血清转换后继续治疗1年;HBeAg阴性患者用药至HBV DNA转阴、ALT复常后继续治疗1.5年或更长[3],理想治疗终点是持久HBsAg 转阴,未达到 HBeAg 血清转换者基本终点是ALT复常、HBV DNA持续处于不可测水平。
2.1.4.2 有治疗指征的肝硬变 代偿性或失代偿性肝硬变,应用免疫抑制剂或接受化疗者,乙肝肝移植者等可用LAM或ETV治疗,如发生耐药可改用ADV等。代偿性肝硬变应长期治疗,但HBeAg阳性如确证HBeAg血清转换且完成半年以上巩固治疗,HBeAg阴性确证HBsAg清除后可以考虑停药;失代偿期肝硬变长期治疗,不可轻易停药。
2.2 干扰素 IFN是机体对异种核酸产生的一种能干扰病毒复制的低分子糖蛋白[9]。根据氨基酸序列和特异性受体识别的不同,可分为Ⅰ型、Ⅱ型和Ⅲ型。Ⅰ型有IFNα、β等13种;IFNα有20多个亚型如α1、α2等,同一亚型又细分如α2a、α2b等;IFNβ仅1个亚型。Ⅱ型仅IFNγ一种类型。Ⅲ型有IFNλ1、IFNλ2和IFNλ3,也可分别称为IL-29、IL-28A、IL-28B。IFN与同种细胞的IFN受体结合可激发细胞内复杂的信号传递途径,使多种IFN刺激基因转录,调节生物效应,包括控制感染细胞内病毒复制、抑制病毒增殖与播散,并具有免疫调节作用。临床常用重组IFN有:单一IFNα,如IFNα2a、IFNα2b等;复合IFN(CIFN),以基因工程合成的IFN;聚乙二醇IFN(PegIFN),半衰期长,每周注射1次即可满足治疗需要,有PegIFNα-2a(分子量40 000)、PegIFNα-2b(分子量12 000)等;白蛋白IFN,有白蛋白IFNα2b、缓释白蛋白IFN(IFNω)及口服白蛋白IFN等。
2.2.1 疗效预测 下列因素常可获较好疗效:①ALT>2ULN;②HBV DNA较低,HBV DNA<2×108拷贝/mL;③女性患者;④病程较短;⑤非母婴传播;⑥肝脏炎症较重而纤维化程度轻;⑦依从性好;⑧HBV基因A型(有A~H 8个基因型,我国主要是B、C型);⑨无HCV、HDV或HIV合并感染;⑩治疗12或24周时HBV DNA测不出。其中①、②、⑧、⑩是预测疗效的重要因素。
2.2.2 治疗方法 HBeAg阳性患者用单一IFNα 500万U,隔日皮下注射1次,疗程半年,有应答者可延长至1年或以上;或PegIFNα-2a 180 μg,或PegIFNα-2b 80 μg,每周皮下注射1次,疗程1年。HBeAg阴性患者可用单一IFNα5万U,隔日1次皮下注射;或PegIFNα-2a 180 μg,或PegIFNα-2b 80 μg,每周皮下注射1次,疗程至少1年。IFN剂量应以患者耐受性等因素决定,治疗半年无应答者可改用NAs治疗。
2.2.3 不良反应与处理:①流感样综合征,可在睡前注射IFN或注射同时用解热镇痛药以减轻症状。②一过性骨髓抑制,中性粒细胞计数≤1.0×109/L或血小板<50×109/L应降低IFN剂量,1~2周后复查如恢复则逐渐增加至原量;中性粒细胞≤0.75×109/L或血小板<30×109/L应停药;中性粒细胞明显降低者可用粒细胞集落刺激因子(G-CSF)等治疗。③可出现抑郁、妄想、焦虑等症状;治疗中密切观察;抗抑郁药可缓解此类症状,必要时停用IFN。④IFN可诱导产生自身抗体,如抗甲状腺抗体、抗核抗体和抗胰岛素抗体;部分可出现甲状腺功能减退或亢进、糖尿病、血小板减少、银屑病、白斑、类风湿性关节炎等,严重者应停IFN;⑤出现肾损害、心律失常、视网膜病变、听力下降和间质性肺炎等,应停用IFN并给予相应处理。
2.2.4 禁忌证 绝对禁忌证包括:妊娠;精神病史;未控制的癫痫;未戒断的酗酒/吸毒者;未控制的自身免疫性疾病;失代偿期肝硬变;有症状的心脏病;治疗前中性粒细胞<1.0×109/L和血小板<50×109/L。相对禁忌证为:甲状腺疾病;视网膜病;银屑病;既往抑郁症史;未控制的糖尿病;未控制的高血压病;血清总胆红素>51.1 μmol/L,特别是以间接胆红素为主者。
2.3 治疗监测和随访
2.3.1 治前基线水平检测 ①生化学指标,如ALT、AST、胆红素、白蛋白、肾功能等。②HBV标志(HBVm),包括HBsAg、抗HBs、HBeAg、抗HBe、抗HBc,以及HBV DNA基线状态。③根据病情需要检测CK和血清肌酐等。④酌情肝活检。⑤用IFN者查血常规、甲状腺功能、血糖及尿常规;甲状腺功能异常者待控制后再行治疗并每月检查甲状腺功能;患糖尿病者先控制血糖后再行治疗;心电图检查和测血压;排除自身免疫性疾病;尿人绒毛膜促性腺激素(HCG)检测以排除妊娠等。
2.3.2 治疗过程中监测 ①生化学指标于治疗开始后每月一次,连续3次,以后随病情改善可每12周一次。②HBVm和HBV DNA于治疗开始后每12周检测一次。③根据需要检测CK和肌酐等。④用IFN者开始治疗后第1个月每1~2周查一次血常规,以后每月查一次,直至治疗结束;每12周检测一次甲状腺功能、血糖和尿常规等;定期评估精神状态,有明显抑郁症应立即停药并给予相应治疗。
2.3.3 治疗结束停药后 不论有否治疗应答,停药后的前3个月每月一次、以后每3~6月一次检测肝功能、HBVm和HBV DNA等。随访至少1年,如病情变化应缩短随访间隔时间;病情复发应选用适当药物进行再治疗。晚期肝病即使完全病毒抑制,仍存在慢性HBV感染致癌的可能性,迫切需要对这类患者进行监测以早期发现[10]。
3 CHB抗病毒治疗面临挑战与对策
3.1 面临的挑战
3.1.1 有效率较低 无论用IFN还是NAs治疗,均只能抑制HBV因而总体有效率不高。LAM治疗CHB患者4年时HBeAg血清转换率47%。LdT治疗HBeAg阳性患者52周时,HBV DNA降至检测不出者60.0%,ALT复常率77.2%,HBeAg血清学转换率与LAM相似。ADV治疗HBeAg阳性患者3年时HBV DNA转阴率(<1 000拷贝/mL)56%,HBeAg血清学转换率43%。HBeAg阳性患者用ETV治疗48周时HBV DNA下降至检测不出者67%、ALT复常者68%、肝组织学改善者72%;HBeAg血清学转换率与LAM治疗者相似。IFN治疗48周后HBeAg血清转换率、HBV DNA下降至检测不出等效果均与NAs相似。
3.1.2 疗程较长 因疗效不够满意,需要延长治疗时间。相当部分抗病毒治疗2~3年未达到停药标准,血清HBeAg未转阴或抗HBe未阳转,或HBV DNA未转阴(尤其是高精度检测未达到扩增阴性),或ALT未完全正常。为了预防病毒学反弹,或防止生化学反弹,不得不将疗程延长。使HBV DNA较长时间处于低水平状态,有利于肝脏炎症控制、肝功能恢复,防止或减轻肝纤维化、肝硬变的发生。
3.1.3 耐药率较高 初始用LAM治疗,4年时耐药率66%;LdT治疗52周时耐药率5.0%;ADV使用1年、2年、3年时耐药率分别为0%、1.6%和3.1%;ETV服3年时累积耐药率1.9%,ETV治疗LAM失效者3年累积耐药率达36%。病毒耐药原因较多,包括:感染者肝细胞核内HBV DNA与宿主DNA整合;复制模板共价闭合环状DNA(cccDNA)难以清除,是抗病毒治疗的最大难点;复制速度极高(每日产1 000亿个病毒颗粒)而HBV 聚合酶保真度低,容易突变;患者免疫力弱可产生免疫逃避株;抗病毒药物可致耐药变异株形成,耐药位点见表1。C基因型HBV更容易多重耐药,这可能为C型HBV感染的难治性和易导致重型肝炎、肝硬变提供了新依据[11]。耐药的后果严重,可出现病毒学反弹,ALT 升高,肝脏组织学恶化,限制抗病毒药物的选用,肝硬变发展成失代偿性肝病等。
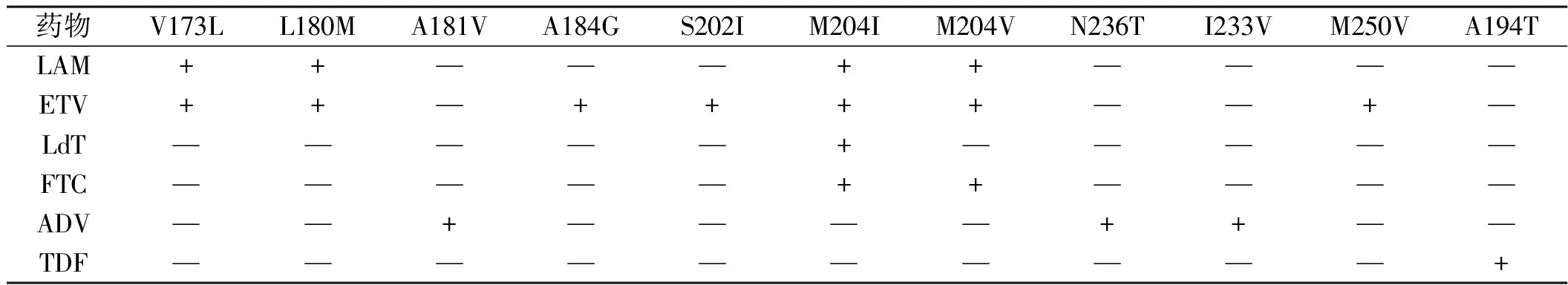
表1 拟核苷类药物的主要耐药位点
已知耐药变异均位于逆转录酶区内。V173L即rtV173L,国际通用从rt第1位氨基酸残基作为起始。书写格式为“rt-野生型氨基酸代码-相对于逆转录酶区起点的氨基酸变异位点-变异后的氨基酸代码”,如rtMl204V即逆转录酶区的第204位由蛋氨酸(M)变异为缬氨酸(V)。
3.2 增强抗病毒疗效的对策
3.2.1 掌握适应证 掌握NAs或IFN治疗适应证。对免疫耐受期或非活动期HBV感染者,尤其是年龄较轻者,如不需要接受免疫抑制剂或化疗药物治疗,则不建议用NAs治疗。对有治疗指征的CHB,合理选择抗病毒治疗方案。中国CHB防治指南[3]要求尽量选用抗病毒作用强、耐药变异发生率低、无交叉耐药的药物治疗,避免单药序贯(即一种药物用一段时间后换用另一种药物)治疗,以免多药物耐药的发生。ETV或TDF初治只要严格依从抗病毒治疗方案发生耐药的风险很低[12],因此可酌情选用。
3.2.2 提高依从性 用药前详细说明,使患者认识抗病毒治疗的重要性;长期抗病毒的必要性;口服NAs或注射IFN获得效果的可能性;NAs治疗出现耐药和IFN使用不良反应的情况;选择药物的原则;所选用药物的特点、达到目标、存在问题及注意事项;患者积极配合、按要求用药对提高疗效的重要作用等。使患者切实做到按时、足量用药。随访发现依从性不好者应加强用药指导。自行停用NAs后出现病毒学或生化学异常者再用NAs或IFN治疗也可获得较好效果。如LAM治疗未获得HBeAg转阴及停药后复发用PegIFNα-2a仍有效[13]等。
3.2.3 优化方案 高耐药风险患者,如HBV DNA载量高(>107或>108拷贝/mL)、有肝纤维化/肝硬变基础,初治时可选用抗病毒作用强、耐药屏障高的单一药物治疗,如ETV或TDF等;也可选用NAs不同耐药位点的两种药物联合,如LAM或ETV或LdT联合ADV;或NAs与IFN联合,如LAM或ETV或LdT或ADV联合IFN等。接受过NAs治疗或早期病毒学应答不佳者,两种药物联合以增加或协同增效抗病毒作用。NAs治疗获稳定病毒学应答者,在继续NAs基础上联合PegIFNα后HBsAg水平持续下降[14-15],而HBeAg仍阳性者加用PegIFNα联合治疗后HBeAg血清转换增高[16];对ETV治疗达到持续HBV DNA抑制的HBeAg阳性患者联合或改用PegIFNα-2a均可增加HBeAg血清学转换率[17-18]。对单一IFNα治疗后复发者可再用其他亚型IFNα,或改用PegIFNα或NAs等。
3.2.4 耐药变异的处理 NAs耐药突变者应改变治疗方法。LAM治疗发生耐药突变,可加用其他能治疗耐药变异的NAs,如ADV等。LAM耐药后改用ADV应重叠使用1~3个月,经检测血清HBV DNA明显下降或阴转后再撤除LAM。LAM耐药者如改用ETV治疗,则每天剂量应为1.0 mg。ADV耐药者可用LAM或LdT治疗。ETV疗效不好者可改用TDF 300 mg治疗。对治疗前ALT正常、肝组织学炎症或纤维化病变轻微( 参考文献: [1]Wong VW,Chan SL,Mo F,et al. Clinical scoring system to predict hepatocellular carcinoma in chronic hepatitis B carriers[J]. J Clin Oncol, 2010, 28(10): 1660-1665. [2]Joven J,Espinel E,Rull A,et al. Serum fatty acid synthase concentration is increased in patients with hepatitis viral infection and May assist in the prediction of liver steatosis[J]. J Clin Viral,2011,51(3):199-201. [3]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南:2010年版[J].中华临床感染病杂志,2011,4:1-13. [4]Emanuel K,Manesis,George V,et al.Hepatitis B surface antigen:Relation to Hepatitis B replication paramenters in HBeAg-negative chronic hepatitis B[J].Journal of Hepatology,2011,55:61-68. [5]Ma Shiwu, Huang Xuan, Li Yongyin, et al. High serum IL-21 levels after 12 weeks of antiviral therapy predict HBeAg seroconversion in chronic hepatitis B[J]. Journal of Hepatology, 2012, 56(4): 775-781. [6]Nie Hui, Evans AA, London WT, et al. Quantitative dynamics of hepatitis B basal core promoter and precore mutants before and after HBeAg seroconversion[J]. Journal of Hepatology, 2012, 56(4): 795-802. [7]Hongthanakorn C,Chotiyaputta W,Oberhelman K,et al.Virological breakthrough and resistance in patients with chronic hepatitis B receiving nucleos(t)ide analogues in clinic practice[J].Hepatology, 2011,53:1854-1863. [8]Bhattacharya D,Thio CL.Revievw of hepatitis B therapeutics[J]. Clin Infec Dis, 2010, 51(10): 1201-1208. [9]马亦林,李兰娟.传染病学[M].5版.上海:上海科学技术出版社,2011:293-301. [10]Lok AS. Does antiviral therapy for hepatitis B and C prevent hepatocellular carcinoma?[J]. J Gastroenterol Hepatol, 2011, 26(2): 221-227. [11]Shi YH.Gonelation between hepatitis B virus genotypes and clinical outcome[J].Jpn J Infec Dis,2012,65:476-482. [12] Kwon H,Lok AS.Hepatitis B therapy[J].Nat Rew Gastroenterol Hepatol, 2011, 8(5): 275-284. [13]Zhang Xuqing, Zhang Huiyan, You Jianping, et al. Efficacy of pegylated interferon alpha2a in patients without HBeAg loss after the withdrawal of long-term lamivudine therapy[J]. Virology Journal, 2013, 10(1): 21. [14]Ouzan D,Penaranda G,Joly H,et al. Add-on peg interferon leads to loss of HBsAg in patients with HBeAg-negative chronic hepatitis and HBV DNA fully suppressed by long-term nucleotide analogs[J]. J Clin Virol,2013,58(4):713-717. [15]Kittner JM,Sprinzal MF,Grimbihler A,et al.Adding pegylated interferon to a current nuecleos(t)ide therapy leads to HBsAg seroconversion in a subgroup of patients with chronic hepatitis B[J].J Clin Virol,2012,54(1):93-95. [16]Li Q,Dong G,Yu J, et al.Adding peginterferon alfa-2a on nuecleos(t)ide analogues therapy improves HBeAg seroconversion and HBsAg decline in HBeAg-positive chronic hepatitis B patients who have achieved virological responses[J].J Hepatol,2013, 58(suppl 1):S 307. [17]Ning Q,Han MF,Sun YT,et al.New treatment strategy:switching from long-term entecavir to peginterferon alfa-2a induces HBeAg seroconversion/HBeAg clearace in patients with HBeAg-positive chronic hepatitis B[J].Hepatology,2012,56(suppl 1):216A. [18] Chen XF,Chen XP,Ma XJ,et al. Optimized strategy:Sequential pegylated interferon α-2a therapy in entecavir-treated patients CHB without satisfactory end-pont led to HBeAg seroconversion[J]. J Hepatology, 2013, 58(suppl 1): S300. [19]岳伟,袁宏,毛小荣,等.不同策略治疗rtN236T位点变异的HBeAg阳性慢性乙型肝炎的疗效观察[J].中华肝脏病杂志,2013,21(3):184-188.
