含1,3,4-噻二唑希夫碱衍生物及其金属配合物的合成和荧光性能研究
2014-08-06吴腊梅李志有
吴腊梅,何 为,李志有,张 涛,蔡 烨
(中南民族大学 化学与材料科学学院, 武汉 430074)
希夫碱及其金属配合物具有杀菌、抑菌、抗癌、抗病毒及载氧等特性而被广泛应用于医学、药物学等研究领域[1-4],其高聚物因具有特殊的光电性质,被用于光电材料领域[5,6].1,3,4-噻二唑是一类含有N、S原子的五元类杂环,具有明显的芳香性和共轭效应[7].能在2,5位上发生取代形成相应的衍生物,这类化合物广泛应用于医药、农业、工业等领域[8].目前用于合成1,3,4-噻二唑的方法危险、反应条件苛刻、底物范围有限等[9,10],且反应时间长、高温、产物需纯化.故急需寻找反应条件温和,路线简短的合成方法,且希夫碱C=N中的N,酚羟基的O及1,3,4-噻二唑杂环的N、S 均具有很强的配位能力,易与金属离子形成配合物而用于光电材料[11].
本文合成了2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑和3种含1,3,4-噻二唑的希夫碱(见图1)并对其结构进行了表征,提供了一种含1,3,4-噻二唑希夫碱的良好合成方法;其化合物荧光发射光谱强,与金属离子配位后荧光强度略减弱,有望成为较好的有机光电材料.
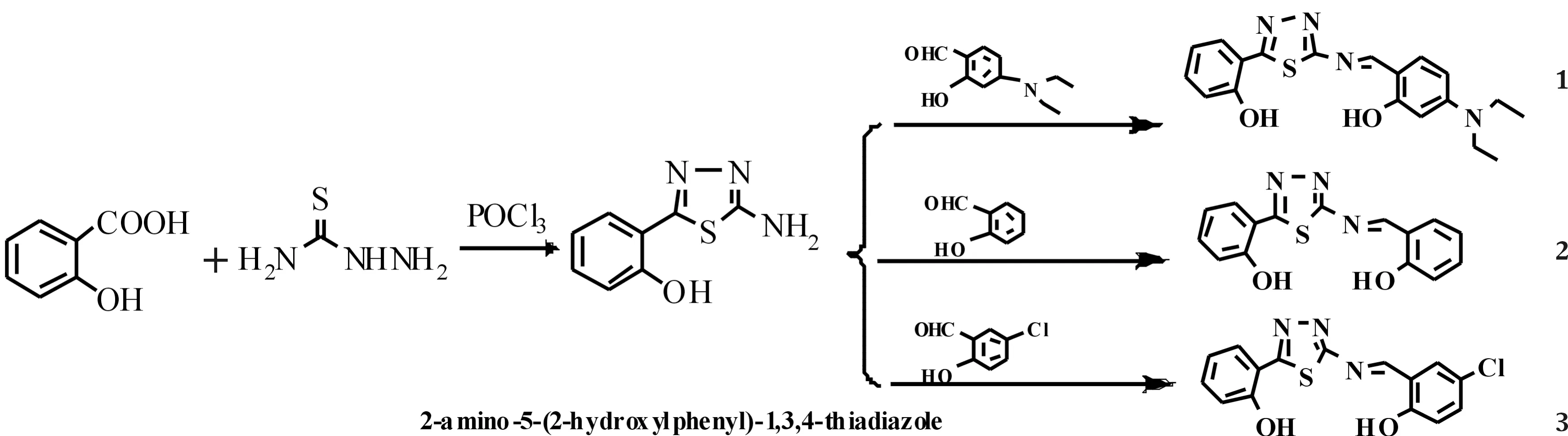
图1 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑及其衍生物希夫碱1, 2, 3的合成Fig.1 Synthesis of 2-amino-5-(2-hydroxylphenyl)-1,3,4-thiadiazole and its Schiff base 1, 2, 3
1 实验部分
1.1 试剂和仪器
水杨酸、氨基硫脲、无水甲醇、POCl3、NaHCO3、对N,N-二乙氨基水杨醛、水杨醛、5-氯水杨醛、无水乙醇、CH3COOH,均为分析纯.
傅立叶红外光谱仪(NEXUS 470 FT-IR,KBr压片),核磁共振仪(Varian Mercury 400,以TMS为内标,DMSO-d6为溶剂),F-4500 Fluorescence 荧光光谱仪(日本日立),数字显示显微熔点测试仪(XT-4型,巩义市予华仪器有限责任公司).
1.2 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑的合成
于100 mL圆底烧瓶中加入2.76 g(0.02 mol)水杨酸,2.00 g(0.022 mol)氨基硫脲,在冰水浴下向圆底烧瓶中加入20 mL POCl3,加热回流2 h,冷却至室温,缓慢将圆底烧瓶中的反应液倒入到50 mL冰水中,待冷却,将溶液倒入150 mL圆底烧瓶中,加热回流5 h,冷却,饱和NaHCO3调节PH=8,抽滤、水洗、干燥,得淡黄色固体3.32 g(0.017 mol),产率为86%.m.p.231~232℃,IR(KBr,cm-1):3401(O-H),3286(N-H),3107(Ar-C-H),1522(C=C),1620(C=N).1HNMR(400 MHz,DMSO)δ11.24(s,1H,-OH),8.16(s,2H,-NH2),7.87(d,J=7.9 Hz,1H,Ar-H),7.33(t,J=7.7 Hz,1H,Ar-H),7.05(d,J=8.5 Hz,1H,Ar-H),6.95(t,J=7.5 Hz,1H,Ar-H).Anal.Calc for C8H7N3OS:C 49.73,H 3.65,N 21.75;found:C 49.86,H 3.53,N 21.82.
1.3 5-(二乙氨基)-2-{[5-(2-羟基苯基)-1,3,4-噻二唑-2-亚氨基]甲基}苯酚(1)的合成
于100 mL圆底烧瓶中加入0.97 g(0.005 mol)2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑,1.06 g(0.0055 mol)对N,N-二乙氨基水杨醛,30 mL甲醇作溶剂,滴加2~3滴CH3COOH,加热回流2 h,冷却、抽滤,乙醇洗涤2~3次,干燥得深黄色固体1.72 g,产率为93.5%.m.p.278~281℃,IR(KBr,cm-1):3446(O-H),1641(C=N),1513(C=C).1H NMR (400 MHz,DMSO)δ12.21(s,1H,-OH),11.15(s,1H,-OH),8.94(s,1H,CH=N),8.17(dd,J=7.9,1.2 Hz,1H,Ar-H),7.55(d,J=9.1Hz,1H,Ar-H),7.43~7.33(m,1H,Ar-H),7.07(d,J=8.2 Hz,1H,Ar-H),7.00(t,J=7.5Hz,1H,Ar-H),6.43(dd,J=9.0,2.1Hz,1H,Ar-H),6.16(d,J=2.1Hz,1H,Ar-H),3.45(q,J=6.8 Hz,4H,-CH2-×2),1.14(t,J=7.0 Hz,6H,-CH3×2).Anal.Calc for C19H20N4O2S: C 61.94, H 5.47, N 15.21; found C 61.88, H 5.52, N 15.30.
1.4 2-{[5-(2-羟基苯基)-1,3,4-噻二唑-2-亚氨基]甲基}苯酚 (2) 的合成
淡黄色固体,产率为90.2%,m.p.253~255℃,IR(KBr,cm-1):3445(O-H),1598(C=N),1459(C=C).1H NMR(400 MHz,DMSO)δ11.49(s,1H,-OH),11.27(s,1H,-OH),9.31(s,1H,CH=N),8.24(dd,J=7.9,1.6 Hz,1H,Ar-H),7.91(dd,J=7.6,1.7 Hz,1H,Ar-H),7.55~7.49(m,1H,Ar-H),7.45~7.38(m,1H,Ar-H),7.10(d,J=7.2 Hz,1H,Ar-H),7.03(dd,J=12.2,5.2 Hz,3H,Ar-H).Anal.Calc for C15H11N3O2S:C60.60,H3.70,N 14.14;found C 60.51,H3.82,N 14.21.
1.5 4-氯-2-{[5-(2-羟基苯基)-1,3,4-噻二唑-2-亚氨基]甲基}苯酚 (3) 的合成
黄色固体,产率为86.8%,m.p.255~257℃,IR(KBr,cm-1):3447(O-H),1608(C=N),1463(C=C).1H NMR(400 MHz,DMSO)δ11.51(s,1H,-OH),11.29(s,1H,-OH),9.26(s,1H,CH=N),8.24(dd,J=8.0,1.6Hz,1H,Ar-H),7.94(d,J=2.8Hz,1H,Ar-H),7.54(dd,J=8.8,2.9Hz,1H,Ar-H),7.46~7.38(m,1H,Ar-H),7.05(dt,J=15.9,9.0 Hz,3H,Ar-H).Anal. Calc for C15H10ClN3O2S:C 54.30,H 3.04,N 12.67;found C 54.44,H 3.13,N 12.52.
1.6 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑希夫碱 1, 2, 3的锌、铁配合物的合成
参考文献[12],分别将 0.2 mmol1,2,3溶于5 mL DMF中,0.24 mmol 二水合醋酸锌溶于10 mL乙醇,混合,加热回流1 h,冷却,抽滤,干燥得黄色固体配合物1-Zn(Ⅱ)、2-Zn(Ⅱ)、3-Zn(Ⅱ)各0.079, 0.067, 0.071g,m.p.>300℃. 1-Zn(Ⅱ),IR(KBr, cm-1): 3445 (s, O-H), 2924(m, C-H), 1617 (C=N), 1580 (C=N), 1404(C=C). 2-Zn(Ⅱ), IR(KBr, cm-1): 3443 (O-H), 1582 (C=N), 1492 (C=N), 1448(C=C). 3-Zn(Ⅱ), IR(KBr, cm-1): 3438 (O-H), 1571 (C=N), 1473(C=C).
同样方法,分别将0.2 mmol1,2,3溶于5 mL DMF中,0.24 mmol 六水合三氯化铁溶于10 mL乙醇,混合加热回流1 h,冷却、抽滤、干燥得黑色固体配合物1-Fe(Ⅲ)、2-Fe(Ⅲ)、3- Fe(Ⅲ)各0.082, 0.069, 0.075 g,m.p.>300℃.1-Fe(Ⅲ),IR(KBr,cm-1): 3435 (O-H), 1613 (C=N), 1520 (C=N), 1491(C=C).2-Fe(Ⅲ), IR(KBr,cm-1): 3397(O-H), 1608(C=N), 1487(C=N), 1412(C=C).3-Fe(Ⅲ), IR(KBr,cm-1): 3397 (O-H), 1616(C=N), 1470(C=C).
1.7 光谱测定
荧光光谱测定:配制浓度为1×10-6mol/L 的待测化合物及其金属配合物的乙醇溶液,在一定波长范围内扫描它们的激发光谱和发射光谱,所有的溶液都是现配现用.
荧光效率测定:配制浓度为1×10-6mol/L 的待测化合物及香豆素的乙醇溶液,在一定波长范围内扫描它们的激发光谱和发射光谱,计算相同发射波长下化合物与香豆素峰面积的积分比,所有的溶液都是现配现用.
2 结果与讨论
2.1 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑的合成
以水杨酸和氨基硫脲为原料,在POCl3中反应2 h后生成了邻羟基苯甲酰氨基硫脲,将反应液倒入冰水中水解多余的,水解生成的酸正好作为成环的催化剂,合成了化合物2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑.此方法中POCl3作为溶剂、酰基化试剂和成环剂,有效地缩减了反应步骤,副产物少,分离纯化简单,产率高,为1,3,4-噻二唑的合成提供了一个有效的方法.
2.2 化合物1,2,3的红外、核磁对比分析
以2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑和对N,N-二乙氨基水杨醛、水杨醛、5-氯水杨醛为原料,合成了化合物1,2,3,操作简单,产品后处理简单,纯度高,其红外、核磁对比分析见表1.由表1中IR可知,化合物1,2,3的酚羟基O-H的伸缩振动吸收峰分别为3446,3445,3447 cm-1;C=N的伸缩振动吸收峰分别为1641,1598,1608 cm-1;苯环和噻唑环骨架伸缩振动的吸收峰分别为1513,1459, 1463 cm-1. 由表1中1H-NMR可知,δ11.15, 12.21; 11.49,11.27; 11.51,11.29分别为化合物1,2,3上的两-OH上H的共振峰;δ8.94; 9.31; 9.26分别为化合物1,2,3上-CH=N-上H的共振吸收峰.
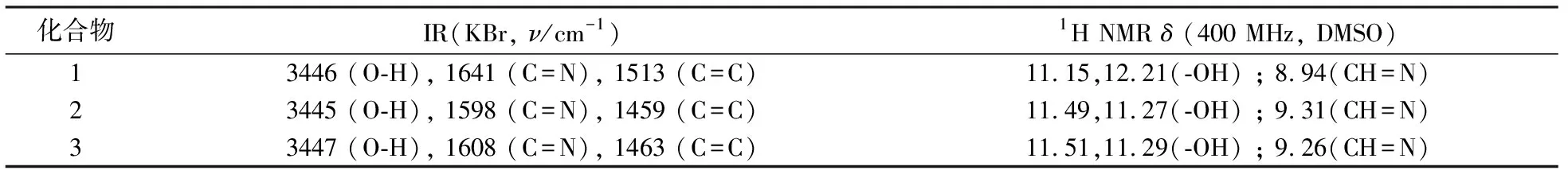
表1 3种化合物1, 2, 3的红外、核磁数据
2.3 3种配体1, 2, 3与Zn(Ⅱ)离子配位后的红外光谱对比分析
3种配体1,2,3与Zn(Ⅱ)离子配位后的红外光谱对比分析见表2.由表2可知,3种配体1,2,3的C=N伸缩振动吸收峰分别为1641,1621,1608 cm-1,配合物的C=N伸缩振动吸收峰分别为1617,1610,1605 cm-1,配合物向低波数位移,说明N与Zn(Ⅱ)离子进行了配位;配体1,2,3的C-S伸缩振动吸收峰分别为1099,1104,1104 cm-1,吸收峰消失说明S参与了Zn(Ⅱ)离子的配位,-OH脱质子参与配位.此外,在500 ~1900 cm-1峰区,配合物的伸缩振动吸收峰明显弱于配体,说明配体与金属离子发生了配位,配体与金属离子的配位模式是配体1,2,3中-OH上的O,双键上的N,噻二唑环上的S和N与不同金属Zn(Ⅱ)离子进行了配位形成链状配合物.对照Zn(Ⅱ)和Fe(Ⅲ)配合物的红外数据可知配体与Fe(Ⅲ)配位点较多,相应配体的红外吸收消失和吸收强度减低的较多.
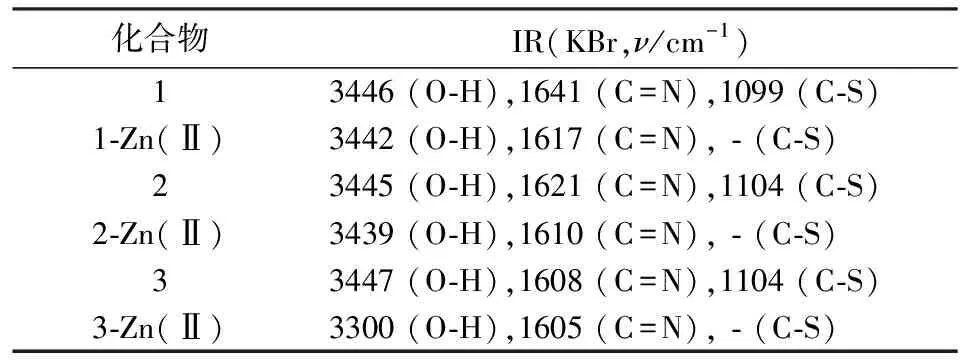
表2 3种配体1, 2, 3及其Zn(Ⅱ)配合物的红外数据
2.4 3种配体1, 2, 3与Fe(Ⅲ)离子配位后的红外光谱对比分析
3种配体1,2,3与Fe(Ⅲ)离子配位后的红外光谱对比分析见表3,由表3可知.

表3 3种配体1, 2, 3及其Fe(Ⅲ)配合物的红外数据
3种配体1,2,3的C=N伸缩振动吸收峰为1641,1621,1608cm-1,配合物的C=N伸缩振动吸收峰分别为1613,1608,1523 cm-1,配合物向低波数位移,说明N与Fe(Ⅲ)离子进行了配位;配体的C-S伸缩振动吸收峰分别为1099,1104,1104 cm-1,吸收峰变弱几乎消失,说明S参与了Fe(Ⅲ)离子的配位.由于配合物可能含溶剂及水,不能从红外中看出-OH配位,但由类似化合物结构推测,-OH应脱质子参与配位.此外,在500~1900 cm-1峰区,配合物的伸缩振动吸收峰明显弱于配体.配体与金属离子的配位模式是配体1,2,3中-OH上的O,C=N上的N,噻二唑环上的S、N与不同的金属Fe(Ⅲ)离子进行了配位,一个配体分子作为一个金属离子的横向配体和另一个金属离子的纵向配体.
2.5 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱 1, 2, 3荧光发射光谱分析
2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1,2,3荧光发射光谱图见图2.由图2可见,在物质浓度为1×10-6mol/L下,1,2,3具有较强的荧光强度,荧光强度值分别为I1=266,I2=161,I3=113,对应的荧光效率分别为YF,1=0.899,YF,2=0.808,YF,3=0.618,且荧光强度为1>2>3,说明化合物的荧光强度与其取代基有关,取代基为给电子基团,化合物荧光增强;取代基为吸电子基团,化合物荧光强度减弱.
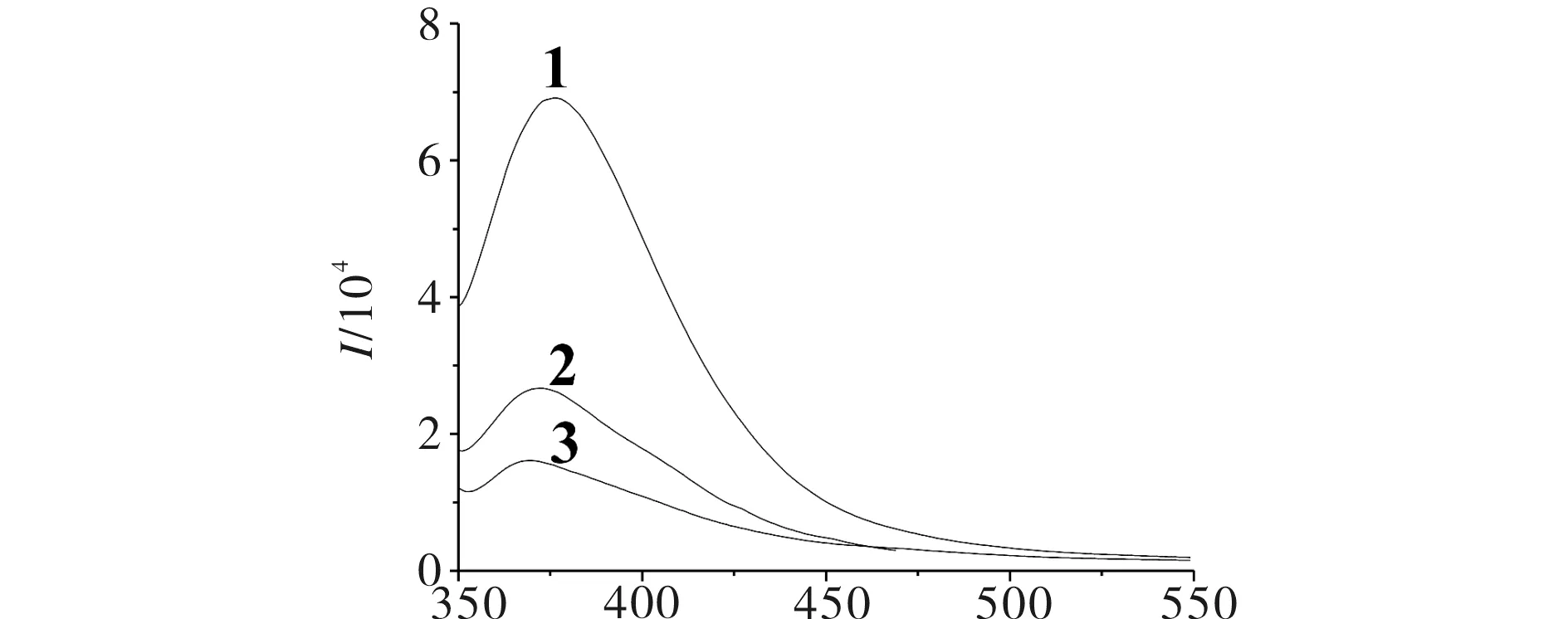
λ/nm1, 2, 3) 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1,2,3图2 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1,2,3荧光发射光谱Fig.2 Fluorescence emission spectra of 2-amino-5-(2-hydroxylphenyl)-1,3,4-thiadiazole derivative Schiff base 1,2,3
2.6 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1, 2, 3及其Zn(Ⅱ), Fe(Ⅲ)离子配位后荧光发射光谱分析
2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1,2,3及其与Zn(Ⅱ)、Fe(Ⅲ)离子形成配合物的荧光光谱图见图3.由图3可见,在物质浓度为1×10-6mol/L下,配体及金属配合物均具有较强的荧光强度,且荧光强度为配体>锌配合物>铁配合物,说明配体1,2,3与金属离子配位后荧光强度减弱,发生了荧光淬灭,与Zn(Ⅱ)配位后具体减弱值分别为41,56, 68,与Fe(Ⅲ) 配位后具体减弱值分别为65,79,94,且Fe(Ⅲ)淬灭强度大于Zn(Ⅱ), 这与Zn(Ⅱ)和Fe(Ⅲ)配位后的红外吸收变换一致.
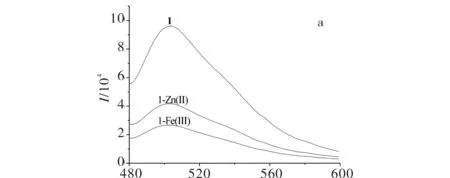
λ/nm
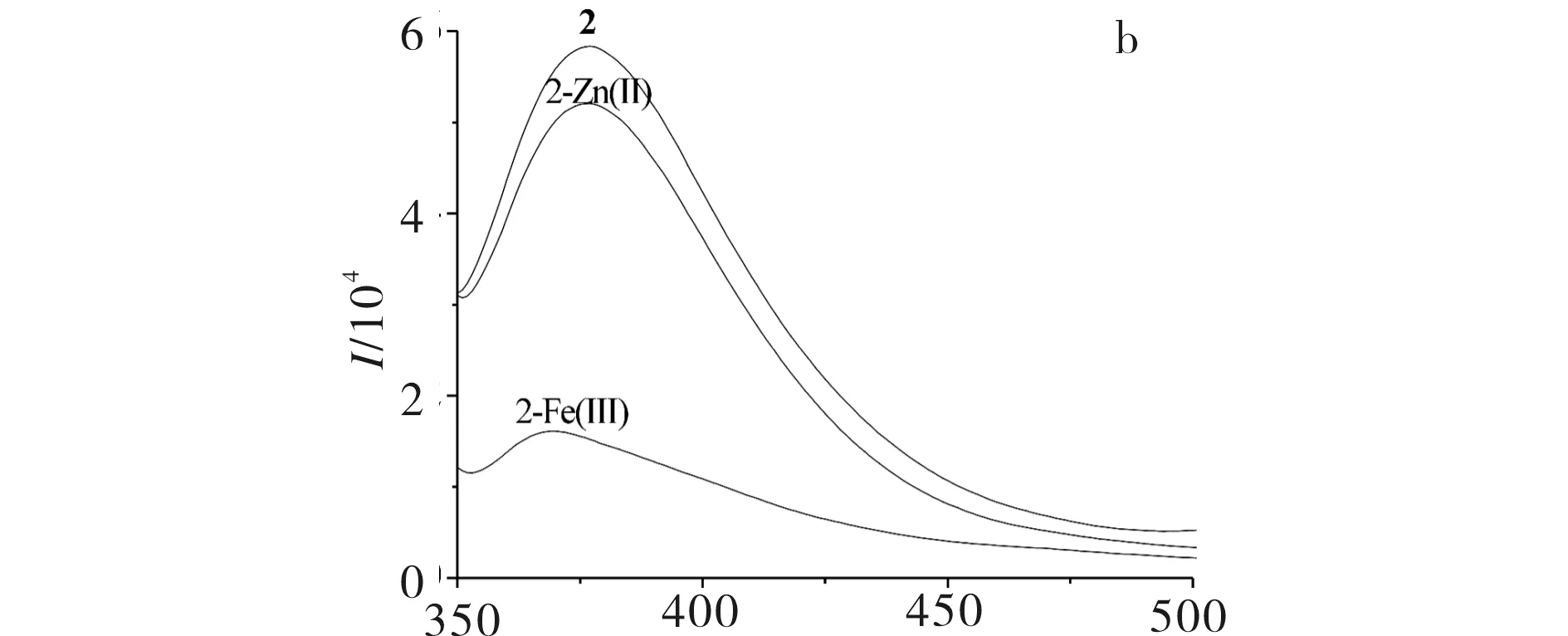
λ/nm
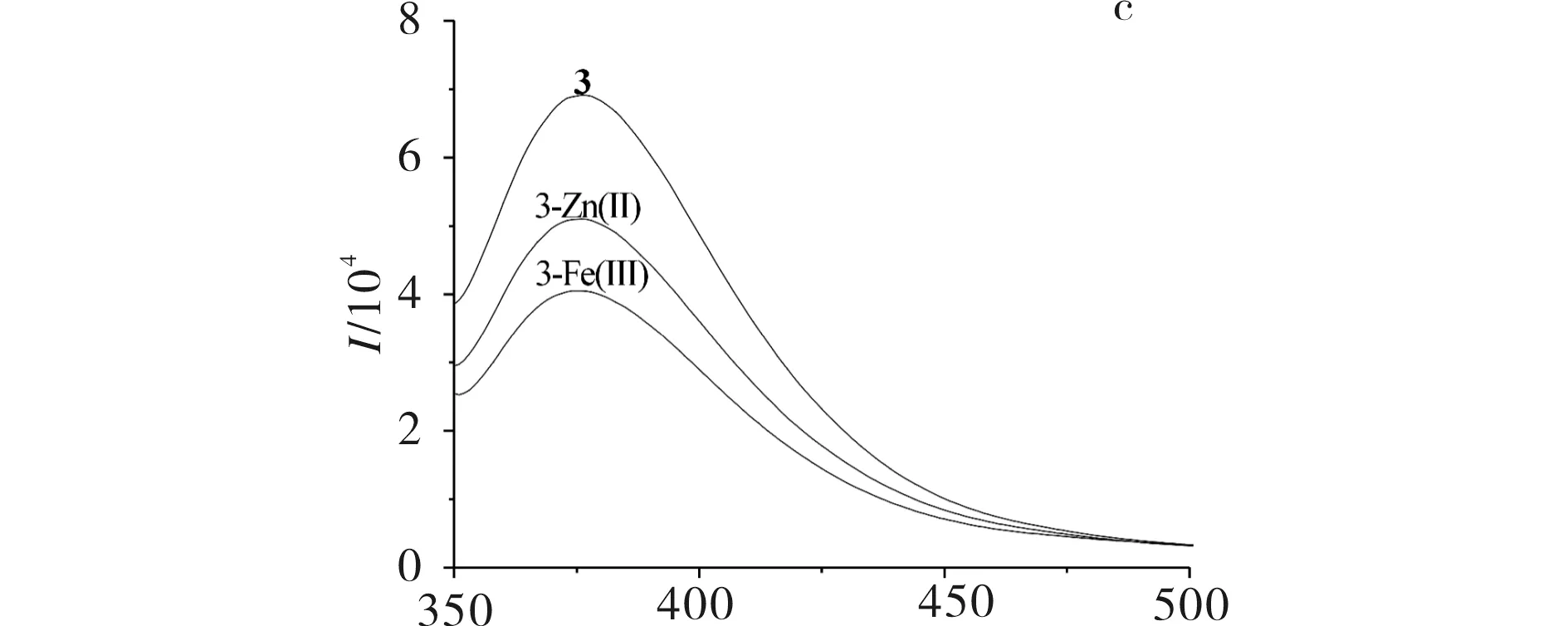
λ/nma) 5-(二乙氨基)-2-{[5-(2-羟基苯基)-1,3,4-噻二唑-2-亚氨基]甲基}苯酚(1)及其Zn(Ⅱ)离子配合物和Fe(Ⅲ)离子配合物;b) 2-{[5-(2-羟基苯基)-1,3,4-噻二唑-2-亚氨基]甲基}苯酚(2)及其Zn(Ⅱ)离子配合物和Fe(Ⅲ)离子配合物;c) 4-氯-2-{[5-(2-羟基苯基)-1,3,4-噻二唑-2-亚氨基]甲基}苯酚(3)及其 Zn(Ⅱ)离子配合物和Fe(Ⅲ)离子配合物 图3 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1, 2, 3及其Zn(Ⅱ), Fe(Ⅲ)离子配位后的荧光发射光谱Fig.3 Fluorescence emission spectra of 2-amino-5-(2-hydroxylphenyl)-1,3,4-thiadiazole derivative Schiff base 1, 2, 3 and their Zn(Ⅱ) ,Fe(Ⅲ) complex
2.7 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1, 2, 3与Fe(Ⅲ)离子配位后荧光发射光谱分析
2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1,2,3与Fe(Ⅲ)离子配位后的荧光发射光谱图见图4.由图4可见,Fe(1), Fe(2), Fe(3)分别代表希夫碱1,2,3与Fe(Ⅲ)的配合物,在物质浓度为1×10-6mol/L下,Fe(1)、Fe(2)、Fe(3)具有较强的荧光强度,且Fe(1)>Fe(2)>Fe(3),说明配合物的荧光强度与配体相似,与其取代基有关,取代基为给电子基团,配合物荧光强度较强;取代基为吸电子基团,配合物荧光强度弱.
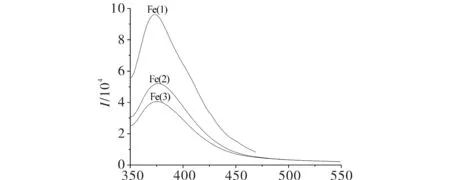
λ/nm图4 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1, 2, 3与Fe(Ⅲ)离子配位后的荧光发射光谱Fig.4 Fluorescence emission spectra of 2-amino-5-(2-hydroxylphenyl)-1,3,4-thiadiazole derivative Schiff base 1, 2, 3 of Fe(Ⅱ) complex
2.8 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1, 2, 3与Zn(Ⅱ)离子配位后荧光发射光谱分析
2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1,2,3与Zn(Ⅱ)离子配位后的荧光发射光谱图,见图5.由图5可见,Zn(1),Zn(2),Zn(3)分别代表希夫碱1,2,3与Zn(Ⅱ)的配合物,在物质浓度为1×10-6mol/L下,Zn(1)、Zn(2)、Zn(3)具有较强的荧光强度,且Zn(1)>Zn(2)>Zn(3),说明配合物的荧光强度与配体相似,与其取代基有关,取代基为给电子基团,配合物荧光强度较强;取代基为吸电子基团,配合物荧光强度弱.
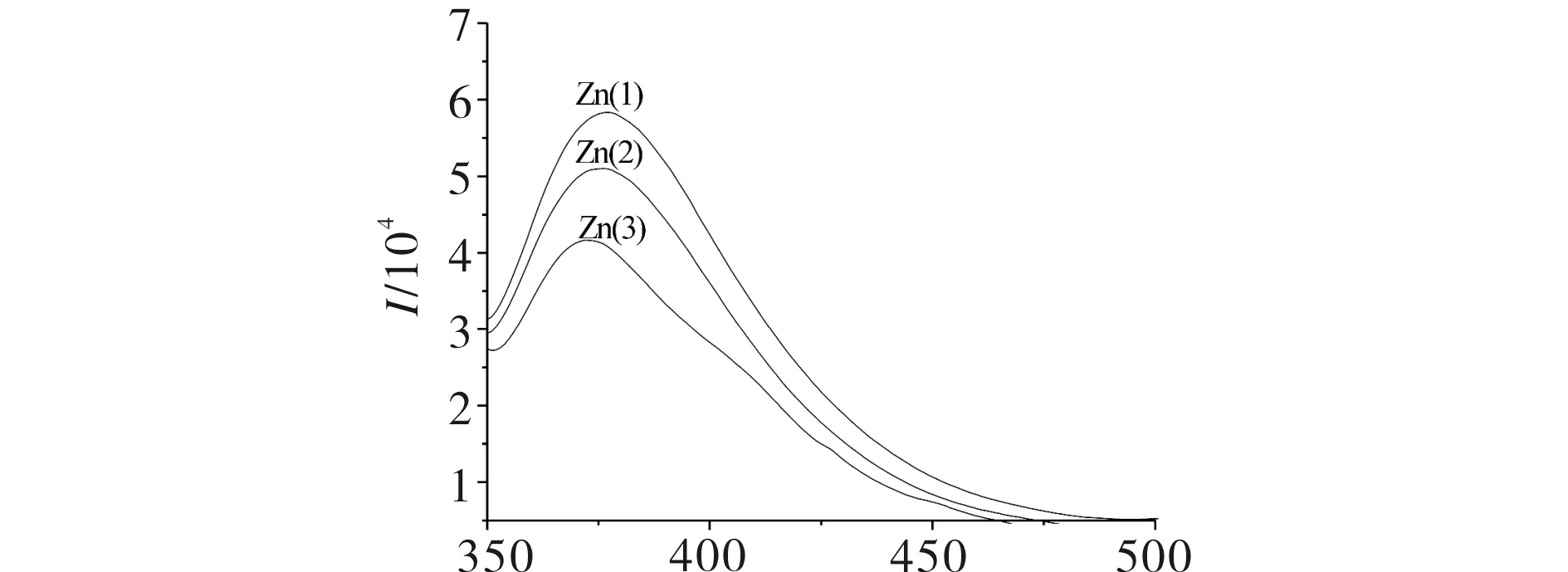
λ/nm图5 2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑衍生物希夫碱1, 2, 3与Zn(Ⅱ)离子配位的荧光发射光谱Fig.5 Fluorescence emission spectra of 2-amino-5-(2-hydroxylphenyl)-1,3,4-thiadiazole derivative Schiff base 1, 2, 3 of Zn(Ⅱ) complex
3 结语
本文以水杨酸和氨基硫脲为原料,用三氯氧磷为溶剂、催化剂和环合剂,合成了2-氨基-5-(2-羟基苯基)-1,3,4-噻二唑,再与相应的芳香醛反应,合成了3种含1,3,4-噻二唑希夫碱,经FT-IR和1H-NMR表征,采用荧光光谱法研究了其光学性能. 结果表明:此方法反应时间短、操作简单、产率高,为含1,3,4-噻二唑希夫碱的合成提供了良好的方法;化合物具有较强的荧光发射光谱,苯环上给电子基团使化合物荧光强度增强,拉电子基团使化合物荧光强度减弱;与金属离子配位后荧光强度减弱,与不同金属离子配位强弱不同,荧光发射强度也不同.故对可根据需要向苯环上引入不同的取代基调整这类化合物的荧光强度,与不同金属配位得到荧光强度不同的配合物,有设计合成有机光电材料提供线索.
参 考 文 献
[1] Liao Z Q,Dong C,Carlson K E,et al.Triaryl-substituted Schiff bases are high-affnity subtype-selective ligands for the estrogen receptor[J].J Med Chem,2014,57(8): 3532-3545.
[2] Geng J,Li M,Wu L,et al.Liberation of copper from amyloid plaques: making a risk factoruseful for Alzheimer′s disease treatment[J].J Med Chem,2012,55(21): 9146-9155.
[3] Barve V,Ahmed F,Adsule S,et al.Synthesis,molecular characterization,and biological activity of novel synthetic derivatives of chromen-4-one in human cancer cells[J].J Med Chem,2006,49(13): 3800-3808.
[4] 吴腊梅,张 涛,李志有,等.(E)-5-(4-氟苯乙烯-2-异丙苯-1,3-二醇的合成[J].中南民族大学学报:自然科学版,2013,32(4):16-18.
[5] Lin K T,Kuo H M,Sheu H S,et al.Unsymmetric 1,3,4-oxa(thia)diazoles of quinoxalinenaphthalene conjugates[J].Tetrahedron,2013,69(43): 9045-9055.
[6] Lee C W,Kim O Y,Lee J Y,et al.Organic materials for organic electronic devices [J].J Ind Eng Chem,2014,20(4):1198-1208.
[7] Higashihara T,Wu H C,Mizobe T,et al.Synthesis of thiophene-based pi-conjugated polymers containing oxadiazole or thiadiazole moieties and their application to organic photovoltaics[J].Macromolecules,2012,45(22): 9046-9055.
[8] Hu Y,Li C Y,Wang X M,et al.1,3,4-thiadiazole: synthesis,reactions,and applications in medicinal,agricultural,and materials chemistry[J].Chem Rev,2014,114(10): 5572-5610.
[9] Yang S J,Lee S H,Kwak H J,et al.Regioselective synthesis of 2-amino-substituted 1,3,4-oxadiazole and 1,3,4-thiadiazole derivatives via reagent-based cyclization of thiosemicarbazide intermediate[J].J Org Chem,2013,78(2): 438-444.
[10] Hwang J Y,Choi H S,Lee D H,et al.Solid-phase synthesis of 1,3,4-oxadiazole and 1,3,4-thiadiazole derivatives via selective,reagent-based cyclization of acyldithiocarbazate resins[J].J Comb Chem,2005,7: 816-819.
[11] Jin J J,Zhang W Z,Wang B,et al.Construction of high Tg bipolar host materials with balanced electron-hole mobility based on 1,2,4-thiadiazole for phosphorescent organic light-emitting diodes[J].Chem Mater,2014,26(7): 2388-2395.
[12] 吴腊梅,李志有,张 涛.含咪唑基酰腙希夫碱的合成[J].中南民族大学学报:自然科学版,2013,32(2):22-25.
