基于标记控制分水岭和Snake交互的乳腺腺体分割
2014-08-04吴双王小鹏王称意万生阳
吴双,王小鹏,王称意,万生阳
兰州交通大学电子与信息工程学院,兰州 730070
基于标记控制分水岭和Snake交互的乳腺腺体分割
吴双,王小鹏,王称意,万生阳
兰州交通大学电子与信息工程学院,兰州 730070
乳腺癌是当今女性的高发病之一[1],而肿瘤靶区的准确分割是一个较为棘手的问题。如果分割肿瘤区域小于实际区域,相应的残留区域得不到照射,致使病灶区被遗漏,但如果分割肿瘤区域大于实际区域,则会造成患者正常组织的损伤,因此在乳腺癌[2]的放射治疗中,乳腺腺体分割的准确与否直接关系到肿瘤靶区的定位及肿瘤的治疗效果。针对乳腺癌的图像分割已提出了许多方法,如经典的阈值法[3-4]、区域生长和分裂合并[5-6]、分水岭变换[7-9]以及基于活动轮廓模型的方法[10-12]等。其中分水岭变换在分割图像时能够产生单像素的封闭轮廓,但存在过分割现象;Snake模型[13-14]能够实现目标轮廓的提取,但对初始位置敏感,易陷入局部极值。为此,提出一种分水岭和Snake模型相结合的方法实现乳腺腺体从粗到细的分割,采用标记控制分水岭实现乳腺腺体的粗分割,通过交互式的Snake模型跟踪,实现乳腺腺体细分割。
1 方法流程
分割方法分为两个主要部分(如图1):即基于形态学的粗分割和基于Snake模型的细分割。首先对原始图像进行对比度增强,然后采用形态学重构滤波去除噪声和小细节干扰,通过面积标记乳腺腺体,利用强制最小技术修正梯度图像并进行分水岭变换实现乳腺腺体的粗分割;通过选取种子点形成的曲线作为Snake模型的初始轮廓,利用Snake动态跟踪逼近目标轮廓,实现乳腺腺体的细分割。
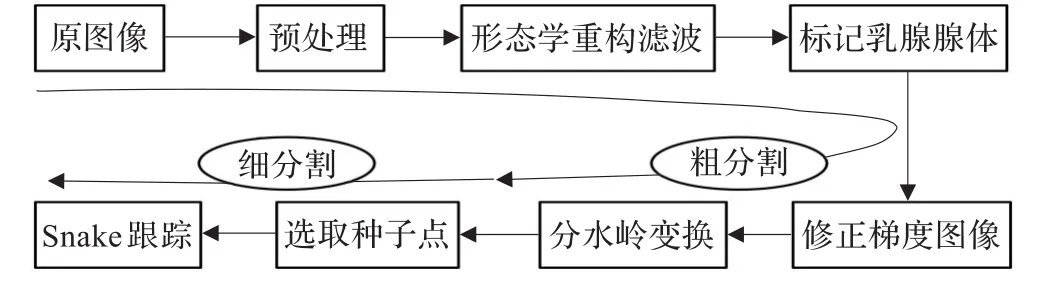
图1 方法流程图
2 基于形态学的粗分割
2.1 预处理
通常乳腺CT图像的对比度相对较低,为此采用灰度拉伸和对数变换对图像进行对比度增强,以突出各组织间的灰度层次。
2.2 形态学重构滤波器
乳腺CT图像中,面积较小的目标通常对应的是一些噪声或非规则细节,需要加以滤除。而开运算重构滤除图像中小于结构元素的亮区域,闭运算重构滤除图像中小于结构元素暗区域,故采用开运算重构和闭运算重构相结合的形态学滤波方法,利用由小到大的结构元素对图像逐次迭代,滤除较小区域和非规则细节,便于下一步标记提取。
形态学重构滤波器[15]结构如图2所示。
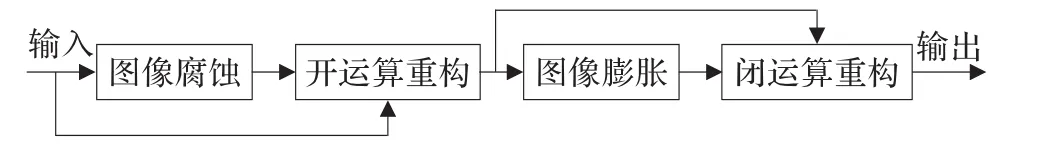
图2 形态学重构滤波器
定义1(图像腐蚀)若f表示原始图像,利用结构元素b对f的形态学腐蚀可表示为:

定义2(开运算重构)对腐蚀后的图像fe在重构中作为标记图像,原始图像f为掩膜,则开运算重构可表示为:

同理,膨胀是腐蚀的对偶运算,对fo_rec进行形态学膨胀,结果记为fd。
闭运算重构是开运算重构的对偶运算,通过对图像fd求补,作为标记图像,将开运算重构后的图像fo_rec求补,作为掩膜图像,用fd对fo_rec进行闭运算重构处理,结果记为fc_rec。
2.3 标记乳腺腺体
通过对图像进行形态学重构滤波,能够将小于结构元素的明亮和黑暗区域逐步合并到周围的区域中并生成灰度特征均匀、更易分割的图像,对fc_rec提取出的局部区域的最大值进行标记,以突出乳腺CT图像中的腺体及其他主体组织,采用连通面积大小作为判决准则,实现乳腺腺体的标记,结果记为ffg。通过全局阈值对图像ffg进行二值化,结果记为背景图像fbg。
2.4 梯度修正及分水岭变换
强制最小技术利用标记图像修正梯度图像的最小值,使局部最小值仅出现在标记位置,其他像素值需“上推”。梯度修正图像用表示为:
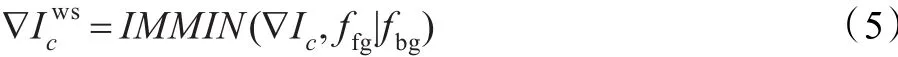
其中,∇Ic为预处理后图像的梯度图像,ffg|fbg为标记的前景和背景图像,IMMIN(·)表示强制极小值标定算子,目的是避免因原始梯度图像存在过多的局部极小值而引起过分割。对进行分水岭变换可表示为:

其中,WTS(·)代表分水岭变换。
3 基于Snake模型的细分割
粗分割虽然可以勾画出乳腺腺体的大体轮廓,但仍存在一些不属于乳腺腺体的像素被归入粗分割区域,造成误分割。为了将这些像素归入相应的腺体区域,在粗分割的基础上,利用Snake模型进行交互细分割,实现乳腺腺体的准确分割。
3.1 种子点的选取
在乳腺腺体粗分割的脊线上选择种子点尤为重要,由于Snake模型对初始轮廓的位置敏感,要求初始轮廓尽可能地靠近真实轮廓,尤其是在图像模糊、目标比较复杂或者与其他目标较近时,初始轮廓更是难以确定,因此种子点一般选择在曲率较大的位置,最大限度的逼近目标实际轮廓。
3.2 Snake模型
Snake模型定义了一个能量函数,通过对能量函数的动态优化来逼近目标的真实轮廓,从而实现目标轮廓的提取。
Snake模型采用参量表示轮廓线,即
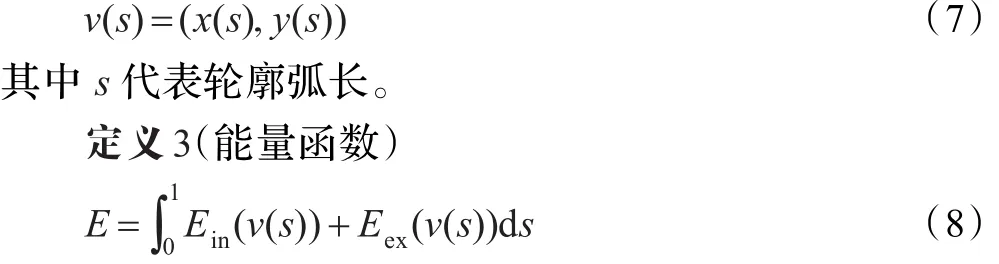
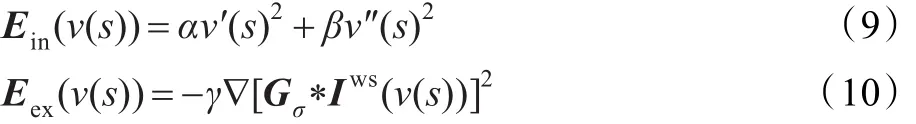
其中,Ein和Eex分别为内部能量和外部能量,ν'(s)和ν''(s)分别代表ν(s)对s的一阶和二阶导数,用于抑制曲线的伸长和弯曲,∇[Gσ*Iws(ν(s))]是对图像Iws进行高斯滤波的梯度图像,其中Gσ是方差为σ的二维高斯函数,α和β分别是控制一阶和二阶导数的加权系数。α、β和γ共同控制内部和外部能量的权重。
要使能量函数(8)最小化,必满足Euler公式:


内力Fin的作用是保持曲线的连续性和光滑性,外力Fex的作用驱动初始轮廓向真实边缘靠近。
为了对方程(11)求解,可以将ν(s)看成关于弧长s和时间t的函数,即

当ν(s,t)趋于平衡时,得到方程(11)的解。
3.3 基于Snake模型的细分割
在粗分割的基础上选取种子点作为Snake模型的初始轮廓,通过设定模型参数,利用轮廓自身特征的内部能量和腺体特征的外部能量共同确定能量函数,在能量最小的原则下,最终使初始轮廓依附于实际腺体边缘附近,实现乳腺腺体的细分割。
细分割具体实现步骤如下:
在实际情况中,由于频谱泄漏的影响,Δφ通常不能严格等于零,所以只要Δφ小于一定阈值ε就可以认为主瓣干扰不存在,否则判定主瓣干扰存在。本文通过对典型谐波信号的频谱分析发现,ε的合理取值为10-5。
(1)在分水岭脊线的最大曲率位置选取种子点。
(2)设定加权系数α、β和γ,确定内部能量和外部能量。
(3)对式(13)进行迭代运算,当ν(s,t)趋于平衡时,即满足式(12)时终止,形成最终轮廓。
4 实验结果与分析
为了验证方法的分割效果,选取了两幅大小为512×512的临床医学CT图像(CT-1和CT-2)在MATLAB7.8平台上进行了实验。图3(a)为CT-1原始DICOM图像,经过预处理后图像(图3(b))对比度增强,但仍存在较小的亮和暗区域。通过对图3(b)直接计算梯度图像(图3(c))并进行分水岭变换得到的图像如图3(d),过分割现象严重;利用形态学重构滤波器对图3(b)进行滤波后(如图3(e)),不仅去除了明亮和黑暗的小区域,而且保持了各个主体组织的位置。在形态学重构滤波后的图像上提取局部最大值并进行标记,突出了乳腺腺体及其他主要组织区域。图3(f)为面积标记乳腺腺体,利用强制最小技术修正后的梯度图像如图3(g)所示,图3(h)为标记控制分水岭分割结果,可以看出,过分割现象基本消除。

图3 CT-1的形态学粗分割
在Snake模型细分割过程中,选用参数为α=0.2,β=0.2,γ=2,迭代次数100。图4(a)是在图3(h)上选取种子点勾画的初始轮廓,图4(b)~(c)分别是Snake模型形成的外部能量场和外部力场,图4(d)为Snake模型动态跟踪图,其中外围绿线是模型移动形成的轨迹,内侧红线为最终轮廓线。图4(e)为Snake模型的细分割结果。为了对比本文方法的分割效果,图4(f)给出了人工勾画的实际区域,可以看出,本文方法的腺体分割接近于实际区域。图4(g)是直接采用传统Snake模型在相同参数情况下动态逼近乳腺腺体的边缘轮廓,图4(h)为最终分割结果,相比图4(e),本文方法更接近于实际轮廓。
图5(a)是对CT-2进行预处理后的图像,对比标记控制分水岭分割的图像(图5(b))与传统Snake模型分割结果(图5(c))可知,本文方法的细分割结果(图5(d))效果更好。

其中,P为准确率,N为人工勾画乳腺腺体像素数,NR分别表示分割后区域与人工勾画区域的重叠像素数。容错率定义为:其中,Q为容错率,M分别分割的区域总像素数。P越大,Q越小,表示分割结果越接近人工勾画区域,分割准确性越高。

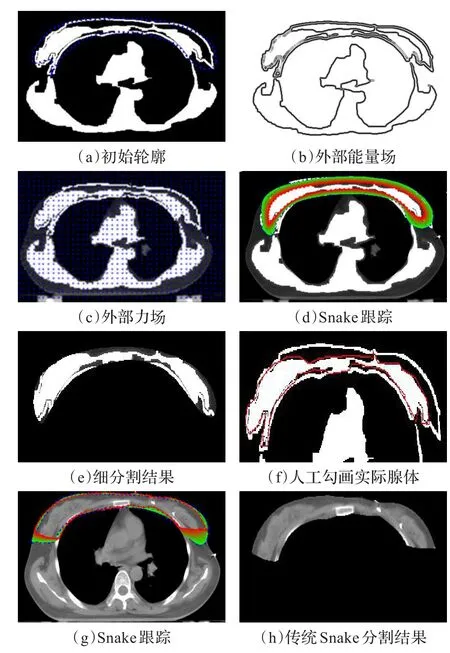
图4 CT-1Snake模型跟踪

图5 对CT-2采用三种方法的分割结果
对比三种方法(如表1),可以看出,本文方法的分割准确率最高,容错率最低;但由于采用半自动交互式分割方法,故本文方法运行时间较长。
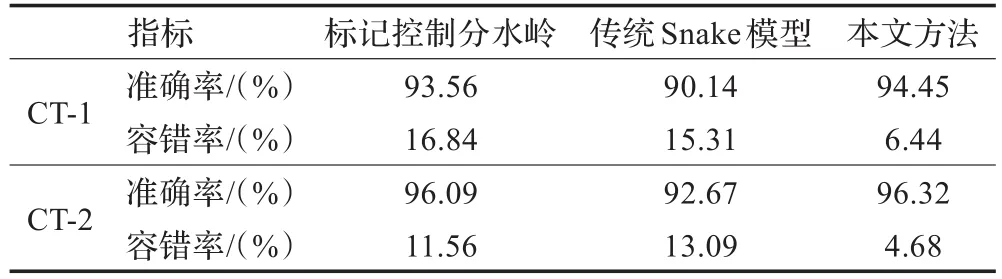
表1 三种方法对比
5 结束语
通过采用标记控制分水岭和Snake模型相结合的方法,实现了乳腺CT图像中腺体的准确分割。通过在分水岭脊线的最大值处选择种子点形成的曲线作为Snake模型的初始轮廓,一方面扩大了Snake模型的捕捉范围,另一方面避免了非感兴趣区域并入感兴趣区域,从而实现乳腺腺体的准确分割。
[1]殷蔚伯,余子豪.肿瘤放射治疗学[M].4版.北京:中国协和医科大学出版社,2012:1164-1188.
[2]Cheng H D,Shan J,J W,et al.Automated breast cancer detection and classification using ultrasound images:A survey[J].Pattern Recognition,2010,43(1):299-317.
[3]Kitter J,Illingworth J.Threshold selection based on a simple image statistic[J].Computer Vision,Graphics and Image Processing,1985,30:125-147.
[4]Sezgin M,Sankur B.Survey over image thresholding techniques and quantitative performance evaluation[J].Journal of Electronic Imaging,2004,13(1):146-165.
[5]黄展鹏,易法令.基于数学形态学和区域合并的医学CT图像分割[J].计算机应用研究,2010,27(11):4360-4362.
[6]卢中宁,强赞霞.基于梯度修正和区域合并的分水岭分割算法[J].计算机工程与设计,2009,30(8):2075-2077.
[7]Bertrand G.On topological watersheds[J].Math Imaging and Vision,2005,22(5):217-230.
[8]Grau V,Mewes A.Improved watershed transform for medical imge segmentation using prior information[J].IEEE Trans on Medical Image,2004,23(4):447-458.
[9]蒋志勇,陈晓玲.一种基于重构算子的分水岭变换算法[J].中国图象图形学报,2009,14(12):2527-2533.
[10]Lankton S,Tannenbaum A.Localizing region-based active contours[J].IEEE Trans on Imag Proces,2008:17:2029-2039.
[11]Cheng Jinyong,Sun Xiaoyun.Medical image segmen-tation with improved gradient vector flow[J].Research Journal of Applied Sciences,Engineering and Technology,2012,4(20):3951-3957.
[12]虞红伟,厉力华.一种基于水平集的多尺度乳腺肿块分割方法[J].仪器仪表学报,2010,31(6):1418-1423.
[13]Kass M,Withkin A,Terzopoulos D.Snakes:active contour models[C]//ProcIntConferenceonComputer Vision,1987,22(9):259-268.
[14]Xu C,Prince J L.Snakes,shapes and gradient vector flow[J].IEEE Trans on Image Process,1998,7:359-369.
[15]赵于前,柳建新,刘剑.基于形态学重构运算的医学图像分割[J].计算机工程与应用,2007,43(10):238-240.
WU Shuang,WANG Xiaopeng,WANG Chengyi,WAN Shengyang
School of Electronic&Information Engineering,Lanzhou Jiaotong University,Lanzhou 730070,China
In the process of breast cancer radiotherapy,the accuracy of mammary gland segmentation is directly related to the effectiveness of patient’s treatment.A coarse-to-fine strategy is proposed for breast gland segmentation.Firstly,morphological reconstruction filter is used to remove image’s small burrs and irregular edges so as to avert new boundaries and boundary migration.The mammary gland is then marked by the area size to differentiate the foreground from the background. After labeling,minima imposition is applied to modify the gradient image.Finally,standard watershed transform is employed to implement segmentation on the basis of modified gradient image,realizing the coarse segmentation of mammary gland. For the purpose of accomplishing the fine segmentation,the curve formed by selected seed points on the watershed ridge is chosen as the initial contour of the snake model to dynamically approach target’s real edges.Experiments show that this method has higher accuracy for mammary gland segmentation.
mammary gland;morphological reconstruction filers;marker-controlled watershed;Snake model
在乳腺癌放射治疗过程中,乳腺腺体分割的准确与否直接关系到患者的治疗效果,提出了一种从粗到细的乳腺腺体图像分割方法。首先利用形态学重构滤波器去除图像中的细小毛刺和不规则边缘,避免产生新边界和边界偏移;然后通过面积标记乳腺腺体,采用强制最小技术修正梯度图像并进行分水岭变换,实现乳腺腺体的粗分割;通过在分水岭脊线上人工选择种子点形成的曲线作为Snake模型的初始轮廓来动态逼近目标的真实边缘,实现乳腺腺体的细分割。实验结果表明,该方法对乳腺腺体的分割具有较高的准确性。
乳腺腺体;形态学重构滤波器;标记控制分水岭;Snake模型
A
TP391.4
10.3778/j.issn.1002-8331.1212-0377
WU Shuang,WANG Xiaopeng,WANG Chengyi,et al.Interactive mammary gland segmentation based on marker-controlled watershed and Snake model.Computer Engineering and Applications,2014,50(22):189-192.
国家自然科学基金(No.61261029);高等学校基本科研业务费项目(No.212090);甘肃省科技支撑计划项目(No.1204GKCA051)。
吴双(1989—),女,硕士研究生,研究领域为图像处理;王小鹏(1969—),男,硕士生导师,教授,研究领域为数字图像处理,多媒体技术以及虚拟现实技术等;王称意(1989—),男,硕士研究生,研究领域为图像处理;万生阳(1987—),男,硕士研究生,研究领域为图像处理。E-mail:shwull@126.com
2012-12-31
2013-04-01
1002-8331(2014)22-0189-04
CNKI网络优先出版:2013-04-18,http://www.cnki.net/kcms/detail/11.2127.TP.20130418.1618.018.html
