急性冠脉综合征外周血单核细胞Toll样受体4、锌指蛋白A20与组织因子的表达及意义
2014-08-04于春杨王昭军蒲肖君陈小节
于春杨,王昭军,蒲肖君,陈小节
(江苏大学附属医院心内科,江苏镇江212001)
急性冠脉综合征外周血单核细胞Toll样受体4、锌指蛋白A20与组织因子的表达及意义
于春杨,王昭军,蒲肖君,陈小节
(江苏大学附属医院心内科,江苏镇江212001)
目的:观察急性冠脉综合征(acute coronary syndrome,ACS)患者外周血单核细胞Toll样受体4(Toll-like receptor 4,TLR4)、锌指蛋白A20(zinc finger protein A20,A20)的表达与血浆组织因子、组织因子途径抑制物(tissue factor passway inhibitor,TFPI)水平的变化。方法:选择ACS患者31例和稳定型心绞痛(stable angina pectoris,SAP)患者21例为研究对象。ACS组包括急性心肌梗死(acutemyocardial infarction,AMI)15例和不稳定型心绞痛(unstable angina pectoris,UAP)16例;对照组共入选20例,均为同期住院的非心血管疾病患者。根据病变血管数目将全部冠心病患者进一步分为3组:单支病变组17例;双支病变组15例;多支病变组20例。采用荧光定量PCR检测72例入选对象外周血单核细胞TLR4mRNA、锌指蛋白A20mRNA的表达;采用ELISA法测定血浆组织因子、TFPI质量浓度。结果:①ACS组患者外周血单核细胞TLR4 mRNA及A20 mRNA的表达明显高于对照组和SAP组(P<0.001),而后两组间的差异无统计学意义(P>0.05)。多支病变组TLR4、A20 mRNA表达均明显高于单支病变组(P=0.006,P=0.000)。②ACS组血浆组织因子、TFPI水平明显高于SAP和正常对照组(P均<0.01);多支病变组血清组织因子含量高于单支病变组(P=0.017)。ACS外周血单核细胞TLR4 mRNA表达与A20 mRNA的表达呈正相关(r=0.640,P=0.002),与血浆组织因子浓度亦呈正相关(r=0.716,P=0.000)。结论:冠心病患者冠状动脉病变程度和粥样硬化斑块稳定性与外周血单核细胞TLR4表达水平有关;TLR4炎症信号通路激活可能参与ACS冠脉粥样斑块破裂、促进凝血异常及血栓形成。
急性冠脉综合征;Toll样受体4;锌指蛋白A20;组织因子;组织因子途径抑制物
本研究观察冠心病患者单核细胞TLR4、A20 mRNA表达的变化,并检测了血浆组织因子、TFPI质量浓度,以探讨TLR4介导的炎症通路和凝血异常在ACS发病中的作用,及其与冠状动脉病变严重程度及粥样硬化斑块稳定性的关系,进一步探讨TLR4信号通路的激活是否参与凝血异常及血栓形成。
1 对象与方法
1.1 研究对象
52例冠心病患者均为2012年3月至2012年11月在本院心内科住院病例,诊断根据典型的临床表现、心肌酶学、心电图等指标,符合世界卫生组织
急性冠状动脉综合征(acute coronary syndrome,ACS)是由冠状动脉不稳定斑块在炎症基础上发生破裂出血,启动外源性凝血系统,引起冠状动脉不完全或完全阻塞所致[1-3]。Toll样受体4(Toll-like receptor 4,TLR4)是Toll样受体家族中的重要一员,TLR4激活后可以通过信号转导,诱导单核、巨噬细胞产生免疫炎性细胞因子、黏附分子以及共刺激分子等,这些分子在动脉粥样硬化的发生发展过程中起着重要作用[4]。锌指蛋白A20(zinc finger protein A20,A20)是机体炎症反应过程中内源性表达的一种炎症调节蛋白,通过泛素化和去泛素化调节参与TLR4/NF-кB(核转录因子кB)信号通路的调控。近年来国外一些学者发现冠心病患者的高凝状态、凝血异常与组织因子、组织因子途径抑制物(tissue factor passway inhibitor,TFPI)系统的失衡有关[5-6]。国外学者认为炎症和凝血系统不是独立存在的,两者相互激活,相互促进,(WHO)关于冠心病的诊断标准。经冠状动脉造影评价冠状动脉狭窄程度,至少有1支主要血管狭窄≥50%。根据病史、体检及冠状动脉造影结果将患者分为两组:ACS组31例,稳定型心绞痛(stable angina pectoris,SAP)组21例。另外设立正常对照组20例,均来自本院住院病例,既往无糖尿病、高血压病史,经体格检查和实验室检查其血压、血脂、血糖正常;且经冠状动脉造影检查排除冠心病。根据冠心病患者病变血管数目进一步分为单支病变组(17例),双支病变组(15例),多支病变组(20例)。以上入选者均排除败血症、肺部感染等严重感染、严重肝肾功能衰竭、弥漫性血管内凝血、恶性肿瘤和自身免疫性疾病及目前正在进行抗凝、抗栓治疗的患者。
1.2 方法
1.2.1 主要试剂和仪器 淋巴细胞分离液(天津灏洋生物有限公司)、Trizol试剂(上海普飞生物公司)、反转录试剂盒(加拿大Fermentas公司)、荧光定量试剂盒(宝生物工程大连有限公司)、CFX96荧光定量PCR仪、聚合酶链反应扩增仪(美国BioRad公司)、ELISA试剂盒(苏州赛德生物有限公司)、450 nm酶标仪(Model 570,日本Bio-Rad公司)。
1.2.2 标本采集与细胞分离 用EDTA-2K抗凝管采集动脉血4 mL,采用Ficoll法分离外周血淋巴细胞,Trizol提取总RNA;上层血浆于-70℃保存备用。1.2.3 荧光定量PCR反应 引物由上海生工合成,TLR4上游引物:5′-CCATTTCAGCTCTGCCTTCAC-3′,下游引物:5′-ACAACAATCACCTTTCGGCTTT-3′,扩增片段104 bp;A20上游引物:5′-GGAAGCTTGTGGCGCTGAA-3′,下游引物:5′-TCCAGTTGCCAGCGGAATTTA-3′,扩增片段166 bp;β-肌动蛋白上游引物:5′-CACGAAACTACCTTCAACTCC-3′,下游引物:5′-CATACTCCTGCTTGCTGATC-3′,扩增片段265 bp。按照Fermentas试剂盒说明书反转录合成cDNA,进行PCR反应。反应条件:95℃30 s预变性,然后95℃10 s,58℃30 s,72℃30 s,共38个循环。
1.2.4 血浆组织因子、TFPI水平检测 严格按照试剂盒说明书操作,绘制标准曲线。
1.3 统计学处理
应用SPSS 16.0统计软件进行统计分析。计量资料以¯x±s表示,多个样本均数的比较采用单因素方差分析,两两比较采用LSD-t检验,计量资料采用χ2检验;采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组临床基线资料比较
各组年龄、性别间的差异无统计学意义(P>0.05);ACS组与SAP组高血压、糖尿病等冠心病相关危险因素间的差异有统计学意义(P<0.05);ACS组与SAP组空腹血糖均高于对照组,而HDL低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 各组基础临床资料比较 ±s

表1 各组基础临床资料比较 ±s
a:P<0.05,与对照组比较
项目 ACS组 SAP组 对照组 F/χ2值 P值n 31 21 20年龄(岁) 64.64±9.04 64.19±7.86 55.2±8.58 1.915 0.155男/女 27/4 11/10 6/14 5.617 0.081高血压[n(%)]18(58.06) 14(66.67) — 10.340 0.006糖尿病[n(%)]9(29.03) 6(28.57) — 7.289 0.026吸烟[n(%)]15(48.39) 7(33.33) 2(18.00) 6.004 0.050饮酒[n(%)]10(32.26) 3(14.29) 2(10.00) 4.422 0.110血糖(mmol/L) 5.50±1.19a 5.52±1.47a 4.79±0.55 3.902 0.049 TC(mmol/L) 4.44±0.98 4.42±0.87 4.37±0.91 0.039 0.961 TG(mmol/L) 2.10±1.75 1.66±0.74 1.27±0.54 2.603 0.081 ApoA(g/L) 1.15±0.43 1.12±0.17 1.22±0.29 0.515 0.600 ApoB(g/L) 0.87±0.23 0.87±0.51 0.74±0.17 1.147 0.324 LDL(mmol/L) 2.75±0.82 2.71±0.68 2.63±0.69 0.165 0.849 HDL(mmol/L) 1.12±0.23a 1.11±0.29a 1.36±0.39 4.847 0.011单支病变(n1) 8 9 —双支病变(n2) 8 7 — 3.325 0.190多支病变(n3) 15 5—
2.2 外周血单核细胞TLR4 mRNA,A20 mRNA相对表达量
ACS组TLR4、A20 mRNA的表达明显高于SAP组和对照组,差异有统计学意义(P均<0.01)。多支病变组TLR4,A20 mRNA的表达明显高于单支病变组(P=0.006,P=0.000)。见表2、表3。
表2 外周血单核细胞TLR4、A20 m RNA的表达±s
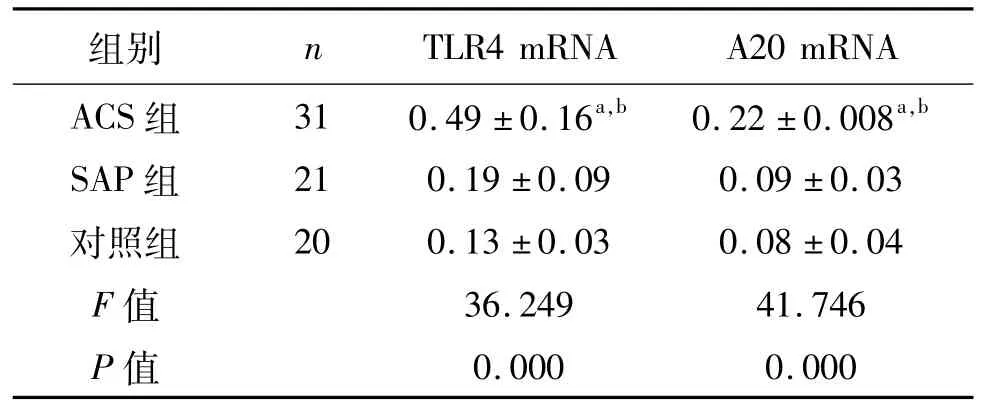
表2 外周血单核细胞TLR4、A20 m RNA的表达±s
a:P<0.01,与对照组比较;b:P<0.01,与SAP组比较
TLR4 mRNA A20 mRNA ACS组 31 0.49±0.16a,b 0.22±0.008a,组别 n b SAP组 21 0.19±0.09 0.09±0.03对照组 20 0.13±0.03 0.08±0.04 F值 36.249 41.746 P值0.000 0.000
表3 不同病变血管数患者间TLR4,A20 m RNA的表达±s

表3 不同病变血管数患者间TLR4,A20 m RNA的表达±s
a:P<0.01,与单支病变组比较
TLR4 mRNA A20 mRNA单支病变组组别 n 17 0.27±0.18 0.12±0.07双支病变组 15 0.39±0.17 0.18±0.08多支病变组 20 0.47±0.15a 0.22±0.08a F值 3.482 5.519 P值0.045 0.015
2.3 各组血浆组织因子和TFPI的浓度
ACS组患者血浆组织因子、TFPI水平高于SAP组和对照组,差异有统计学意义(P均<0.05);多支病变组与单支病变组血浆组织因子水平差异有统计学意义(P=0.017)。见表4、表5。
表4 各组患者间血浆组织因子和TFPI浓度的比较±s

表4 各组患者间血浆组织因子和TFPI浓度的比较±s
a:P<0.01,与对照组比较;b:P<0.01,与SAP组比较
组别 n 组织因子(ng/L) TFPI(μg/L)ACS组 31 22.79±1.49a,b 22.50±1.87a,b SAP组 21 19.31±0.51 20.44±0.48对照组 20 19.25±0.75 19.63±0.65 F值 18.937 50.216 P值0.000 0.000
表5 不同冠状动脉病变血管数病例间血浆组织因子、TFPI含量的比较 ±s

表5 不同冠状动脉病变血管数病例间血浆组织因子、TFPI含量的比较 ±s
a:P<0.05,与单支病变组比较
组别 n 组织因子(ng/L) TFPI(μg/L)单支病变组17 20.31±1.22 21.71±1.75双支病变组 15 20.77±1.33 22.18±2.14多支病变组 20 21.66±1.86a 21.47±1.88 F值 0.653 2.114 P值0.528 0.139
2.4 ACS外周血TLR4 mRNA与A20 mRNA表达、血浆组织因子含量的相关性
ACS患者外周血单核细胞TLR4 mRNA的表达与A20 mRNA的表达呈正相关(r=0.640,P=0.002),与组织因子含量亦呈正相关(r=0.716,P=0.000)。见图4。

图4 ACS患者外周血TLR4 m RNA表达与A20 m RNA、血浆组织因子含量的相关性
3 讨论
Toll样受体(TLRs)是重要的先天免疫模式识别受体,TLR4是TLRs家族中的重要成员,TLR4与配体结合后,经MyD88依赖途径和非MyD88依赖途径启动下游分子的级联反应,引起NF-кB转位进入核内。活化的NF-кB可诱导炎性介质和趋化因子等细胞因子的表达、分泌,参与炎症反应,从而促进动脉粥样硬化发生和进展[3,10-11]。研究显示,在动脉粥样斑块内的血管内皮细胞、巨噬细胞、血管平滑肌细胞和血管外膜成纤维细胞中,TLR4表达上调[12]。我们检测了ACS患者外周血单核细胞TLR4 mRNA的表达情况,结果发现TLR4在冠心病患者外周血单核细胞的表达上调,ACS患者的单核细胞TLR4 mRNA的表达明显高于SAP患者和对照组,与国外研究者的结论相同[13]。ACS外周血单核细胞TLR4 mRNA表达增高,进一步证明了TLR4信号通路可能参与了动脉粥样硬化以及斑块破裂的进程。
锌指蛋白A20是炎症反应过程中一种调节蛋白,由TNF-α、脂多糖等诱导产生,是NF-кB活化的产物[14]。A20同时又可以负反馈抑制NF-кB激活导致的炎症反应[15]。A20通过下调细胞膜受体TLR4的表达,进而抑制炎症。A20表达增高作为NF-кB依赖性基因表达的负反馈,对于终止TLR4诱导的NF-кB活化和前炎症因子的表达非常重要[16]。本研究显示,冠心病患者TLR4信号通路的负反馈调节因子A20 mRNA表达上调,ACS组明显高于SAP组和对照组;ACS患者外周血单核细胞A20 mRNA表达的增加,进一步说明炎症反应参与了不稳定斑块的发生或进展;但可能由于A20功能缺陷或上调不足,并不能完全抑制TLR4介导的信号通路的激活,致使促炎与抗炎因子失衡,导致AS的发生和发展,具体机制尚不明确。A20表达上调可能抑制TLR4信号通路的激活,降低炎症反应,逆转或稳定粥样斑块,这可能为冠心病及其并发症防治提供新的思路和策略。
组织因子即凝血因子Ⅲ(又称组织凝血活酶),是启动凝血过程级联反应的关键因子,通过启动外源性凝血系统而使机体处于高凝状态,导致血栓形成。ACS不稳定斑块存在炎症反应,血管内皮细胞、巨噬细胞、单核细胞、平滑肌细胞等动脉粥样硬化斑块中的主要细胞成分有大量组织因子表达,使斑块内组织因子的促凝活性增加[17-18];同时在炎症基础上由于机械刺激或血流动力学改变,促使冠状动脉内易损性斑块破裂,组织因子暴露,启动凝血瀑布,外源性凝血途径活化导致血栓形成[19-20],引起血管狭窄、闭塞。TFPI是组织因子的生理性抑制物,可抑制活化因子Ⅹa(FⅩa)及活化因子Ⅶ(Ⅶa)/TF复合物,使凝血级联反应不能启动,从而抑制血栓形成,预防ACS的发生。
本研究通过检测冠心病患者血浆组织因子、TFPI的浓度评估机体的凝血状态。结果显示,ACS组患者血浆组织因子、TFPI较对照组明显升高,显示血浆组织因子、TFPI水平可能与冠状动脉斑块的稳定性有关,且血浆组织因子水平与血管病变数目之间亦有相关性。临床工作中有可能通过检测冠心病患者外周血凝血情况来推测冠脉斑块的稳定性,可在条件允许的情况下,加强抗炎、抗凝治疗以预防ACS的发生。
在正常情况下组织因子不存在于循环血液中或不与循环血液接触,而外周血TFPI却持续地表达,以构成生理性抗凝屏障。组织因子、TFPI作为一对平衡系统,对维持机体正常凝血功能起着积极作用。基础研究[21]已经证实,TFPI的升高是机体对内皮损伤及局部炎症的一种代偿反应。但可能由于TFPI对高浓度组织因子介导的凝血途径对抗不足,导致机体呈现高凝状态,容易形成血栓。此外,本研究中冠心病患者外周血TLR4 mRNA表达与血浆组织因子呈正相关,提示炎症通路激活可能促进凝血异常,两者存在一定的相关性,TLR4介导的信号通道可能参与ACS冠脉粥样斑块破裂、促进凝血异常及血栓形成。
本研究尚存在以下局限性:①选择偏倚:由于研究对象采用严格的入选标准,入选病例有明确的影像或临床证据,故样本量较少。②信息偏倚:对于病变特征及狭窄程度的判定尚存偏倚。
综上,ACS患者存在炎症与凝血异常;炎症、凝血系统功能紊乱以及血栓在冠心病的发病机制中发挥重要作用。深入探索炎症、血栓在冠状动脉粥样硬化稳定性中的作用,将有助于为临床提供更有针对性的防治策略。
[1]Vink A,Schoneveld AH,van der Meer JJ,et al.In vivo evidence for a role of toll-like receptor 4 in the development of intimal lesions[J].Circulation,2002,106(15):1985-1990.
[2]Hansson GK,Robertson AK,Soderberg-Naucler C.Inflammation and atherosclerosis[J].Annu Rev Pathol,2006,1:297-329.
[3]Stoll G,Bendszus M.Inflammation and atherosclerosis: novel insights into plaque formation and destabilization[J].Stroke,2006,37(7):1923-1932.
[4]Croce K,Libby P.Intertwining of thrombosis and inflammation in atherosclerosis[J].Curr Opin Hematol,2007,14(1):55-61.
[5]Strukova S.Blood coagulation-dependent inflammation.Coagulation-dependent inflammation and inflammationdependent thrombosis[J].Front Biosci,2006,11:59-80.
[6]Chu AJ.Role of tissue factor in thrombosis.Coagulation-inflammation thrombosis circuit[J].Front Biosci,2006,11:256-271.
[7]Lim WS,Timmins JM,Seimon TA,etal.Signal transducer and activator of transcription-1 is critical for apoptosis in macrophages subjected to endoplasmic reticuleum stress in vitro and in advanced atherosclerotic lesions in vivo[J].Circulation,2008,117(7):940-951.
[8]Marcucci R,Prisco D,Brunelli T,et al.Tissue factor and homocysteine levels in ischemic heart disease are associated with angiographically documented clinical recurrences after coronary angioplasty[J].Thromb Haemost,2000,83(6):826-832.
[9]Morange PE,Simon C,Alessi MC,et al.Endothelial cellmarkers and the risk of coronary heart disease:the Prospective Epidemiological Study of Myocardial Infarction(PRIME)Study[J].Circulation,2004,109(11):1343-1348.
[10]EdfeIdt K,Swedenborg J,Hansson GK,et al.Expression of toll-like receptors in human atherosclerotic lesions:a possible pathway for plaque activation[J].Circulation,2002,105(10):1158-1161.
[11]Li H,Sun B.Toll-like receptor4 in atherosclerosis[J].JCell Mol Med,2007,11(1):88-95.
[12]Xu XH,Shah PK,Faure E,et al.Toll-like receptor-4 is expressed bymacro-phages in murine and human lipid-rich atherosclerotic plaques and unregulated by oxidized LDL[J].Circulation,2001,104(25):3103-3108.
[13]Methe H,Kim JO,Kofler S,et al.Expansion of circulating Toll-like receptor 4-positivemonocytes in patients with acute coronary syndrome[J].Circulation,2005,111(20):2654-2661.
[14]Krikos A,Laherty CD,Dixit VM.Transcriptional activation of the tumor necrosis factor alpha-inducible zinc finger protein,A20,ismediated by kappa B elements[J].JBiol Chem,1992,267(25):17971-17976.
[15]Muhlestein JB,May HT,Jensen JR,et al.The reduction of inflammatory biomarkers by statin,fibrate,and combination therapy among diabetic patients with mixed dyslipidemia:the DIACOR(Diabetes and Combined Lipid Therapy Regimen)study[J].J Am Coll Cardiol,2006,48(2):396-401.
[16]Hogue JC,Lamarche B,Tremblay AJ,et al.Differential effect of atorvastatin and fenofibrate on plasma oxidized low-density lipoprotein,inflammation markers and cell adhesionmolecules in patientswith type 2 diabetesmellitus[J].Metabolism,2008,57(3):380-386.
[17]Zawadzki C,Susen S,Richard F,et al.Dyslipidemia shifts the tissue factor/tissue factor pathway inhibitor balance toward increased thrombogenicity in atherosclerotic plaques:evidence for a corrective effect of statins[J].Atherosclerosis,2007,195(2):117-125.
[18]Levi M,van der Poll T,ten Cate H.Tissue factor in infection and severe inflammation[J].Semin Thromb Hemost,2006,32(1):33-39.
[19]Brummel-Ziedins K,Undas A,Orfeo T,etal.Thrombin generation in acute coronary syndrome and stable coronary artery disease:dependence on plasma factor composition[J].J Thromb Haemost,2008,6(1):104-110.
[20]Becker RC,Mahaffey KW,Yang H,et al.Heparin-associated anti-Xa activity and platelet-derived prothrombotic and proinflammatory biomarkers in moderate to high-risk patients with acute coronary syndrome[J].J Thromb Thrombolysis,2011,31(2):146-153.
[21]Golino P,Ravera A,RagniM,etal.Involvementof tissue factor pathway inhibitor in the coronary circulation of patients with acute coronary syndromes[J].Circulation,2003,108(23):2864-2869.
Research on the correlation of TLR4,zinc finger protein A20 in peripheral blood monocyte and tissue factor in acute coronary syndrome patients
YU Chun-yang,WANG Zhao-jun,PU Xiao-jun,CHEN Xiao-jie
(Department of Cardiology,the Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001,China)
Objective:To investigate the relation between the expression levels of toll-like4/A20mRNA in peripheral blood mononuclear cells(PBMC)and tissue factor,tissue factor passway inhibitor(TFPI)in plasma of patientswith acute coronary syndrome(ACS).M ethods:The patients of coronary artery diseases(CAD)were divided into the group of ACS(n=31),there were 15 patients with acutemyocardial infarction(AMI),and 16 patients with unstable angina pectoris(UAP);and stable angina pectoris(SAP,n=21)group;the group of controlwere a total of20 cases.The expressions of TLR4 and A20 mRNA were detected by real-time fluorescence quantitation polymerase chain reaction(RT-PCR).The concentrations of plasma tissue factor and TFPIwere measured by enzyme-linked immunosorbent assay(ELISA).Results:There was a significant correlation between TLR4 mRNA and A20 mRNA in peripheral blood mononuclear cells(r=0.640,P=0.002).The expressions of A20 and TLR4 mRNA in monocytes in patients with ACS were higher than patients with SAP and healthy persons(P<0.001).Comparing with the single lesion group,TLR4 and A20 mRNA positive expression in the multivessel branch lesion group were increased(P=0.006,P=0.000).The levels of both tissue factor and TFPI in patientswith ACSwere significantly higher than the group of SAP and controls(P<0.01).Plasma tissue factor was statistically significant between themultivessel disease group and the single lesion group(P=0.017).The expression of TLR4 in PBMC group was positively related with the level of TF in ACS(r=0.718,P=0.000).Conclusion:The increased expression of TLR4 in monocyteswas related to atherosclerotic plaque instability as well as coronary artery lesion degree.TLR4-mediated inflammatory pathway activation may promote clotting abnormalities and coronary artery thrombosis in patientswith ACS.
acute coronary syndrome;toll-like receptor4;zinc finger protein A20;tissue factor;tissue factor passway inhibitor形成炎症 凝血 血栓循环,该循环可能在冠心病的发生发展中起重要作用[7-9]。因此,把炎症反应、凝血系统功能紊乱、血栓形成等过程联合起来可能成为冠心病发病机制研究的新方向,但目前相关的临床研究较少。
R544.2
A
1671-7783(2014)01-0063-05
10.13312/j.issn.1671-7783.y130036
于春杨(1987—),女,硕士研究生;王昭军(通讯作者),主任医师,硕士生导师,E-mail:doctorwangzj@aliyun.cn
2013-03-15 [编辑]陈海林
