KSHV vFLIP在血管内皮细胞中的表达及其功能验证
2014-08-04金镠洋严沁卢春
金镠洋,严沁,卢春
(南京医科大学微生物学与免疫学系,江苏南京210029)
KSHV vFLIP在血管内皮细胞中的表达及其功能验证
金镠洋,严沁,卢春
(南京医科大学微生物学与免疫学系,江苏南京210029)
目的:构建含卡波氏肉瘤相关疱疹病毒(Kaposi′s sarcoma-associated herpesvirus,KSHV)编码的病毒FLICE抑制蛋白(viral FLICE inhibitory protein,vFLIP)基因的重组慢病毒表达载体,获得稳定表达vFLIP的人脐静脉内皮细胞株(human umbilical vein endothelial cells,HUVECs),并检测vFLIP在HUVECs中活化NF-κB信号通路的能力。方法:以真核表达质粒pEF-vFLIP为模板扩增vFLIP基因,插入至慢病毒载体pHAGE-CMV-MCS-IZs-Green中构建重组质粒pHAGE-vFLIP。利用脂质体将其与包装质粒psPAX2和包膜质粒pMD2.G共转染293 T细胞,收集过滤后的培养上清获得慢病毒悬液。利用梯度稀释法测定病毒滴度后,以一定感染复数的慢病毒感染HUVECs,通过蛋白质印迹法检测vFLIP的表达。经绿色荧光蛋白(GFP)流式分选以及蛋白质印迹法验证获得稳定表达vFLIP的HUVECs。最后,通过虫荧光素酶报告实验检测NF-κB的活性,免疫荧光染色检测NF-κB亚基p65的细胞定位,蛋白质印迹法检测IκBα蛋白的表达来评价稳定表达vFLIP蛋白的HUVECs功能。结果:核酸序列测定证实含vFLIP基因的慢病毒表达载体已构建成功。重组慢病毒感染HUVECs后可检测到vFLIP的表达。通过流式分选获得了稳定表达vFLIP的HUVECs细胞,并且能通过抑制IκBα的降解,阻碍p65入核来活化NF-κB,从而激活经典NF-κB信号通路。结论:成功包装了含KSHV vFLIP基因的重组慢病毒,并获得具有激活NF-κB信号通路功能、稳定表达vFLIP的HUVECs株。
慢病毒;卡波氏肉瘤;病毒FLICE抑制蛋白;人脐静脉内皮细胞;核因子-κB
卡波氏肉瘤相关疱疹病毒(Kaposi′s sarcoma-associated herpesvirus,KSHV)又称人类疱疹病毒8型(human herpesvirus 8,HHV-8),属于γ-2型疱疹病毒,主要感染内皮细胞和淋巴细胞。KSHV是由Chang等[1]于1994年在人类获得性免疫缺陷综合征有关的卡波氏肉瘤组织中发现的。研究证实,KSHV作为卡波氏肉瘤的病原体,同时与以下两种疾病密切相关,即原发性渗出性淋巴瘤(primary effusion lymphoma,PEL)和多中心卡斯特莱曼病[2]。
卡波氏肉瘤是一种与血管生成密切相关的恶性肿瘤,常见于皮肤、黏膜以及内脏器官。大量的梭形细胞、炎性细胞以及异常增生的新生血管分布在卡波氏肉瘤瘤体组织中[3]。目前已有多个KSHV编码蛋白被证实具有致瘤特性,包括病毒白细胞介素6(viral interleukin-6,vIL-6)、病毒干扰素调节因子(viral interferon regulatory factors,vIRFs)、病毒G蛋白耦联受体(viral G protein coupled receptor,vGPCR)以及病毒FLICE抑制蛋白(viral FLICE inhibitory protein,vFLIP)等[3-4]。其中,由KSHV K13基因编码的vFLIP是一个在潜伏期表达的重要致瘤蛋白[4],结构上与caspase-8/FLICE的前导肽相似。进一步研究发现,vFLIP并不能抑制caspase-8,而是通过活化核因子-κB(nuclear factorκB,NF-κB)信号通路[5-7],促进细胞的存活、增殖,细胞因子分泌以及肿瘤形成[8-11]。
本课题组先前的研究表明,KSHV编码的vIL-6能够通过自分泌和旁分泌方式促进卡波氏肉瘤组织中梭形细胞的主要前体细胞——内皮细胞诱导血管肿瘤形成[12]。鉴于vFLIP同为KSHV重要的致瘤蛋白,本研究构建了含KSHV vFLIP基因的重组慢病毒表达载体,并获得了稳定表达vFLIP的血管内皮细胞株,以期为今后研究vFLIP在内皮细胞诱导血管生成的作用做好实验准备。
1 材料与方法
1.1 细胞和慢病毒载体系统
人胚肾上皮293 T细胞(HEK 293 T细胞,以下简称293 T)和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为本室保存。这两种细胞需要在5%CO2、37℃环境条件下生长于DMEM中,还需添加灭活胎牛血清(293 T细胞和HUVECs细胞培养密度分别为10%和20%)、链霉素(100μg/mL)、青霉素(80 U/mL)和庆大霉素(80 μg/mL)。实验中所使用的胎牛血清和培养基均为美国Hyclone公司产品。
慢病毒载体pHAGE-CMV-MCS-IZs-Green、包膜质粒pMD2.G以及包装质粒psPAX2三者共同构成慢病毒载体系统[12]。含vFLIP基因的真核表达质粒pEF-vFLIP为本室构建并保存[5]。表达海肾荧光素酶的质粒pRL-TK购自美国Promega公司,NF-κB虫荧光素酶报告质粒由本室保管[6]。
1.2 试剂
质粒小量提取试剂盒、凝胶纯化试剂盒为美国Omega公司产品。质粒转染试剂购买自美国Invitrogen公司。PCR高保真酶Primer STAR HS为大连宝生物工程(TaKaRa)有限公司产品。实验过程中所用的工具酶、蛋白标准参照物以及核酸标准分子质量参照均为美国Thermo公司产品。PCR引物为上海英潍捷基(Invitrogen)有限公司合成。基因测序由南京金斯瑞生物科技有限公司完成。抗-Flag M2单克隆抗体、抗-α-微管蛋白单克隆抗体、抗-IκBα单克隆抗体均购自美国Santa Cruz公司。抗-NF-κB p65多克隆抗体为美国Abcam公司产品。Alexa Fluor 555标记的羊抗鼠IgG购自美国Invitrogen公司。4′,6-二脒基-2-苯基吲哚(DAPI)为中国碧云天公司产品。双荧光素酶检测系统购自美国Promega公司。
1.3 方法
1.3.1 vFLIP基因的扩增和含vFLIP基因重组质粒pHAGE-vFLIP的构建 vFLIP基因上游引物:5′-CTAGCTAGC GCCACC ATGGCCACTT-3′(斜体部分为Kozak序列,下划线部分为NheⅠ识别序列);下游引物:5′-CGCGGATCCTCA CTTGTCATCGTCGTCCTTGTAGTC TGGTGTA-3′(斜体部分为Flag标签蛋白编码序列,下划线部分为Bam HⅠ识别序列)。
应用PCR法从pEF-vFLIP质粒中扩增出vFLIP基因。PCR反应条件:94℃变性5 min,然后98℃15 s,58℃30 s,72℃1min扩增25个循环,最后72℃延伸6 min。获得的产物经1%琼脂糖凝胶电泳检测,切胶回收备用。
vFLIP PCR回收产物和慢病毒载体需在37℃条件下进行限制性内切酶NheⅠ、Bam HⅠ双酶切。酶切产物经琼脂糖凝胶电泳检测,切胶纯化后用T4DNA连接酶于4℃连接12~16 h。
连接产物转化大肠埃希菌DH5α感受态细胞,挑选氨苄西林抗性菌落,获得重组质粒。经PCR和双酶切鉴定,并对重组质粒进行基因测序分析。大量提取经序列鉴定正确的重组质粒,命名该质粒为pHAGE-vFLIP。
1.3.2 慢病毒包装与滴度测定 用pHAGE-vFLIP、psPAX2、pMD2.G 3种质粒共同转染293 T细胞,将细胞置于37℃,5%CO2细胞培养箱中培养。10 h后吸弃原培养基,加入新鲜培养基以终止转染。培养24 h后通过荧光显微镜可以观察到绿色荧光蛋白(green fluorescent protein,GFP)的表达。48 h后收集含有病毒颗粒(Lv-vFLIP)的细胞培养上清。阴性对照为慢病毒空载体pHAGE-Mock,所获得的病毒为Lv-Mock。获得病毒后按实验步骤计算病毒滴度[8]。
1.3.3 vFLIP基因在HUVECs细胞中的表达 将HUVECs细胞接种于明胶包被的6孔板中,调整细胞密度为0.5×106/mL,用无血清DMEM培养。24 h后去除培养基,用重组慢病毒Lv-vFLIP或空载体Lv-Mock上清感染HUVECs细胞,8 h后吸弃上清加入新鲜培养基以终止感染。感染72 h后,采用蛋白质印迹法检测vFLIP在细胞中的表达情况。
1.3.4 稳定表达vFLIP的内皮细胞的构建 按“1.3.3”所述方法感染HUVECs细胞。72 h后以未感染的HUVECs细胞为对照,流式细胞仪分选出GFP表达阳性的细胞,置于含20%灭活胎牛血清的DMEM中继续培养。获得的高阳性率感染细胞分别命名为HUVEC-vFLIP和HUVEC-Mock,并提取细胞总蛋白,通过蛋白质印迹法检测vFLIP在内皮细胞中的表达。
1.3.5 虫荧光素酶报告实验检测NF-κB活性 转染前24 h将HUVEC-vFLIP细胞和HUVEC-Mock细胞按每孔0.3×105/mL密度接种于48孔板。按LipofectamineTM2000说明书推荐步骤将NF-κB虫荧光素酶报告质粒与pRL-TK质粒转染HUVECs细胞。转染48 h后虫荧光素酶和海肾荧光素酶可以产生荧光,按照双荧光素酶检测系统介绍的方法检测荧光强度。参照海肾荧光素酶报告质粒荧光强度,以获得标准化后的虫荧光素酶报告质粒活性。
1.3.6 免疫荧光法(immunofluorescence assay,IFA)检测p65的表达 用0.25%胰酶消化HUVEC-vFLIP和HUVEC-Mock细胞,将重悬细胞分别接种于玻底培养皿中。次日,弃去皿中培养基并用PBS洗涤,待皿自然风干后以冰丙酮固定20 min;PBS洗涤后于37℃以0.5%Triton X-100穿膜30min,0.5% BSA封闭1 h。加入以0.5%BSA 1∶50稀释的抗-p65单克隆抗体,于4℃孵育过夜。第2天加入以0.5%BSA(1∶200)稀释的Alexa Fluor555标记羊抗鼠IgG以及DAPI。染色后用Zeiss Axiovert 200 M金相显微镜观测p65定位的变化。
1.3.7 统计学方法 采用SPSS 18.0软件对实验数据进行统计学处理,以荧光强度的均数±标准差±s)表示各组虫荧光素酶报告质粒活性,采用t检验进行统计分析,P<0.05为差异具有统计学意义。
2 结果
2.1 PCR扩增vFLIP基因
以pEF-vFLIP质粒为模板,通过PCR技术扩增出vFLIP基因,全长约625 bp(图1 A),基因大小正确。
2.2 鉴定pHAGE-vFLIP重组质粒
重组质粒经过限制性内切酶NheⅠ、Bam HⅠ双酶切,产生载体pHAGE-CMV-MCS-IZs-Green和vFLIP两个基因片段,大小分别约为4 625 bp和625 bp(图1 B)。经核酸序列分析软件DNAssist比对,结果显示克隆基因序列与基因库中登记的vFLIP基因序列完全一致,说明重组质粒pHAGE-vFLIP构建成功。
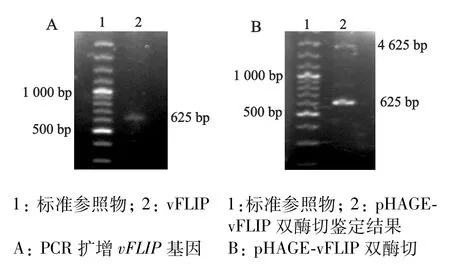
图1 PCR扩增vFLIP基因以及NheⅠ、Bam HⅠ双酶切鉴定重组质粒pHAGE-vFLIP
2.3 慢病毒包装及其滴度的测定
将pHAGE-vFLIP、psPAX2和pMD2.G 3种质粒共转染293 T细胞,24 h后可以观察到GFP的表达(图2)。通过荧光计数法测得重组慢病毒vFLIP(Lv-vFLIP)滴度和空载体病毒Mock(Lv-Mock)滴度分别约为3×106TU/mL和4×106TU/mL。

图2 3种质粒共转染293T细胞36 h后GFP的表达(×100)
2.4 HUVECs内vFLIP的表达
HUVECs细胞经过Lv-vFLIP感染48 h后提取细胞蛋白,以蛋白质印迹法检测vFLIP蛋白的表达,同时以Lv-Mock作为对照。结果显示,一条特异性条带在约22 000处出现,而vFLIP-Flag蛋白的相对分子质量正是22 000(图3)。这说明Lv-vFLIP能够有效感染HUVECs细胞,并介导vFLIP蛋白在其中表达。

图3 重组慢病毒介导vFLIP在HUVECs细胞中的蛋白表达
2.5 稳定表达vFLIP的血管内皮细胞株的获得
用Lv-vFLIP感染HUVECs细胞,并将细胞进行流式分选以获得GFP阳性率近100%的细胞,即HUVEC-vFLIP细胞。同时以同样方法获得的HUVEC-Mock细胞作为对照(图4)。通过蛋白质印迹法检测两种细胞蛋白,发现HUVEC-vFLIP细胞在约22 000处出现特异性条带(图5),提示vFLIP在流式分选后所获得的HUVEC-vFLIP细胞中获得稳定表达。

图4 流式分选获得的HUVEC-vFLIP细胞和HUVEC-M ock细胞(×100)
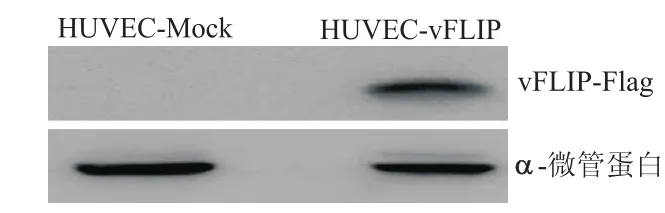
图5 蛋白质印迹法检测两类细胞中vFLIP的表达
2.6 稳定表达vFLIP的血管内皮细胞株的功能验证
鉴于vFLIP能够激活经典NF-κB信号通路,我们将NF-κB虫荧光素酶报告质粒和表达海肾荧光素酶的pRL-TK质粒共转染HUVEC-Mock和HUVEC-vFLIP细胞。结果显示,与对照组比较,HUVEC-vFLIP细胞组的虫荧光素酶报告质粒活性(1.6 ±0.17)明显高于对照组(1.0±0.12,t=4.53,P= 0.006 9)。这说明稳定表达于血管内皮细胞的vFLIP有效活化了NF-κB信号。
进一步采用IFA检测NF-κB亚基p65在稳定表达vFLIP的血管内皮细胞中的定位。如图6所示,与HUVEC-Mock细胞核中的p65表达量相比,移位进入HUVEC-vFLIP细胞核中的p65明显增多。提示稳定表达于血管内皮细胞的vFLIP能诱导p65的核转位,从而发挥活化NF-κB的生物学功能。
进一步提取HUVEC-Mock和HUVEC-vFLIP的细胞总蛋白,采用蛋白质印迹法检测IκBα蛋白的表达。与对照组比较,HUVEC-vFLIP细胞中IκBα蛋白表达量明显降低,表明稳定表达于血管内皮细胞的vFLIP可通过抑制IκBα的降解,阻碍p65入核,从而激活经典NF-κB信号通路(图7)。
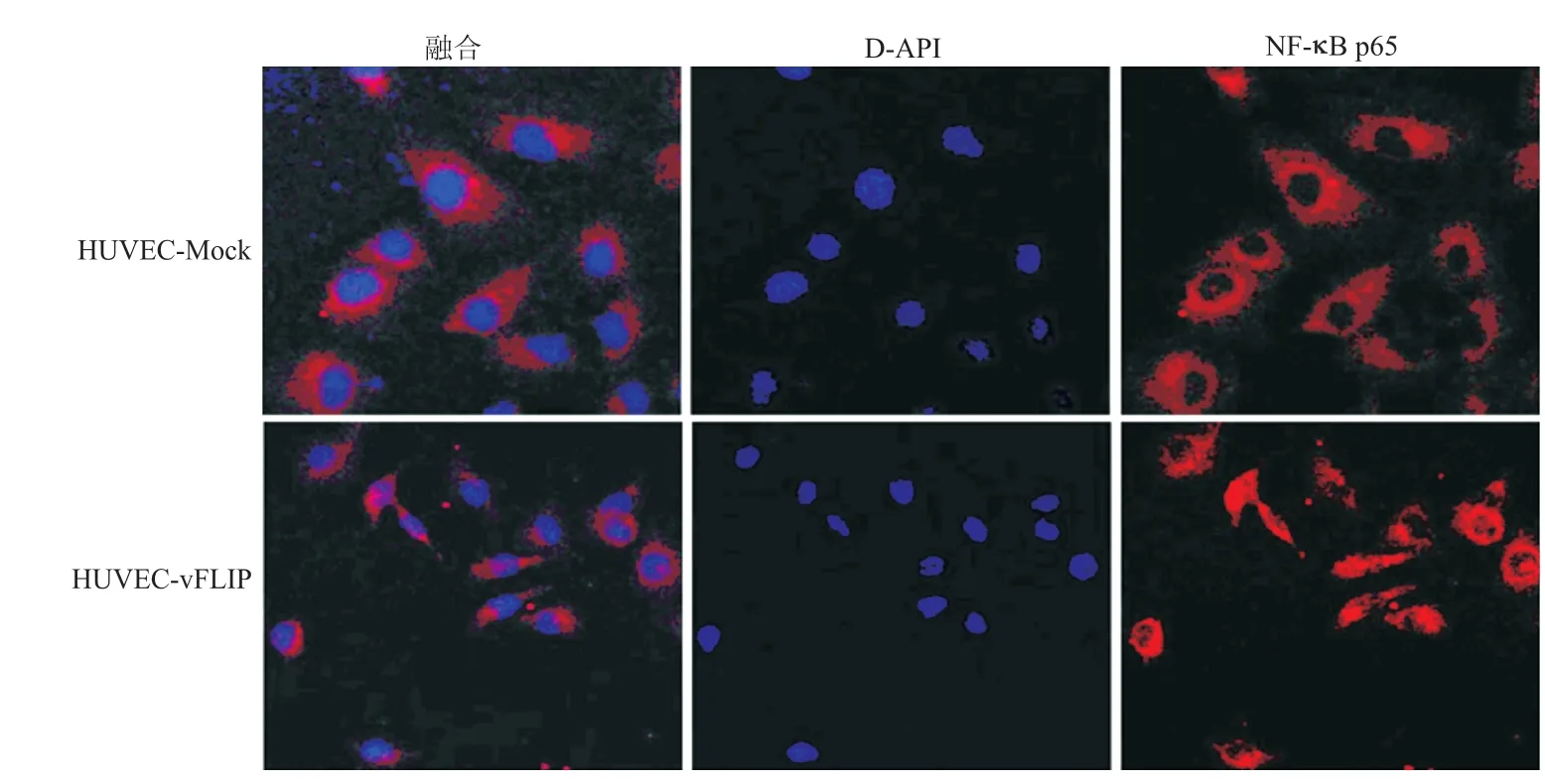
图6 稳定表达于血管内皮细胞的vFLIP对p65亚基细胞定位的影响(×400)

图7 IκBα蛋白在HUVEC-M ock和HUVEC-vFLIP细胞中的表达
3 讨论
FLIP(FLICE抑制蛋白)的全称是Fas相关死亡区域蛋白样白介素-1β转换酶抑制蛋白,是新近发现的一种与恶性肿瘤发生与转移侵袭密切相关的凋亡抑制蛋白,能通过抑制Fas以及肿瘤坏死因子相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)介导的细胞凋亡促进肿瘤生成[8-9]。FLIP首先是由Thome等[13]在病毒研究中发现,被KSHV感染的细胞凋亡率明显低于正常细胞,在其中发挥关键作用的为病毒型FLIP(vFLIP)。随后研究者们又发现黑色素瘤细胞的胞质中有一种类似于vFLIP、呈高水平表达的蛋白,称为细胞型FLIP(cFLIP)[10]。vFLIP与cFLIP具有一定的同源性,且都能抑制肿瘤细胞凋亡。但是,两种类型的FLIP之间也存在明显的区别。cFLIP主要通过抑制细胞凋亡蛋白caspase-8介导的细胞凋亡来促进细胞分化和肿瘤形成;而vFLIP主要通过诱导经典NF-κB信号通路来促进肿瘤生成[11]。既往研究证明,vFLIP可以与IκB激酶(IκB kinase,IKK)IKKγ结合进而招募IKKα和IKKβ形成复合物,IKK复合物活化后使下游的IκB降解,进而使“囚禁”于胞质的NF-κB二聚体p50/p65释放进入细胞核,从而调控相关基因转录,促进细胞分化与肿瘤形成[14-17]。
vFLIP在卡波氏肉瘤组织中的表达,在促进肿瘤生长和抑制细胞凋亡方面发挥着一定的作用,而其表现出的功能大多都依赖于NF-κB信号通路[18]。目前研究证实,vFLIP能够保护KSHV潜伏感染的B淋巴细胞存活,其机制是通过NF-κB信号通路抑制抗IgM诱导的生长阻滞与细胞凋亡[19],而下调KSHV感染的PEL细胞系中vFLIP的表达则会引起细胞凋亡和坏死[20-21]。锌指蛋白A20能够通过抑制肿瘤坏死因子受体相关因子(tumor necrosis factor receptor-associated factor,TRAF)和RNAⅢ抑制肽(RNAⅢ-inhibiting peptide,RIP)来阻断经典NF-κB信号通路,进而降低趋化因子IP-10的表达以抑制vFLIP诱导的细胞增殖[22]。此外,vFLIP还能通过NF-κB信号通路诱导IL-8和CXCL16的分泌[23-24]。vFLIP还可以调控Notch信号通路[25],同时下调AP-1信号通路来抑制KSHV分子“开关基因”复制转录激活因子(replication and transcription activator,RTA)的启动子活性,进而抑制KSHV的裂解性复制和病毒颗粒的产生[26]。
依赖NF-κB通路的vFLIP能够促进细胞增殖、迁移、侵袭和肿瘤的生成。近来的研究表明,vFLIP能够通过上调zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)的表达来促进血管生成[27]。然而目前有关KSHV vFLIP促进卡波氏肉瘤组织中梭形细胞的主要前体细胞——内皮细胞诱导血管生成的分子机制尚不清楚。为此,本研究利用慢病毒载体系统,构建含有vFLIP基因的重组慢病毒,获得了高阳性率的稳定表达vFLIP的HUVECs。通过虫荧光素酶报告实验、免疫荧光染色和蛋白质印迹法,证明稳定表达vFLIP的HUVECs能有效抑制IκBα的降解,阻碍p65的核转运,最终活化NF-κB信号。NF-κB二聚体p50/p65转运进入细胞核后,通过调控哪些基因的转录从而导致细胞增殖迁移、血管生成和肿瘤形成,目前尚未可知。本研究所获得的稳定表达KSHV vFLIP,并且具备激活经典NF-κB信号通路功能的HUVECs,为今后进一步研究KSHV vFLIP促进内皮细胞诱导血管生成的分子机制奠定了实验基础,同时也有助于阐明卡波氏肉瘤的发病机制。
[1]Chang Y,Cesarman E,Pessin MS,et al.Identification of herpesvirus-like DNA sequences in AIDS-associated Kaposi′s sarcoma[J].Science,1994,266(5192):1865-1869.
[2]Katano H,Sata T.Human herpesvirus 8 virology,epidemiology and related diseases[J].Jpn J Infect Dis,2000,53(4):137-155.
[3]Ganem D.KSHV infection and the pathogenesis of Kaposi′s sarcoma[J].Annu Rev Pathol,2006,1:273-296.
[4]Nicholas J.Human herpesvirus 8-encoded proteins with potential roles in virus-associated neoplasia[J].Front Biosci,2007,12:265-281.
[5]马新廷,郝婷婷,朱小飞,等.KSHV抗凋亡蛋白vFLIP编码vFLIP多克隆抗体的制备与鉴定[J].江苏大学学报:医学版,2012,22(1):1-8.
[6]Zhu X,Zhou F,Qin D,etal.Human immunodeficiency virus type 1 induces lytic cycle replication of Kaposi′s-sarcoma-associated herpesvirus:role of Ras/c-Raf/MEK1/2,PI3K/AKT,and NF-κB signaling pathways[J].JMol Biol,2011,410(5):1035-1051.
[7]王平,黄敏,卢春.含HIV-1Vif基因重组慢病毒表达载体的构建及其对KSHV裂解性周期复制影响的初探[J].南京医科大学学报:自然科学版,2010,30(3):286-290,355.
[8]Bullani RR,Huard B,Viard-Leveugle I,et al.Selective expression of FLIP inmalignantmelanocytic skin lesions[J].J Invest Dermatol,2001,117(2):360-364.
[9]Liu K,McDuffie E,Abrams SI.Exposure of human primary colon carcinoma cells to anti-Fas interactions influences the emergence of pre-existing Fas-resistant metastatic subpopulations[J].J Immunol,2003,171(8):4164-4174.
[10]Irmler M,Thome M,Hahne M,etal.Inhibition of death receptor signals by cellular FLIP[J].Nature,1997, 388(6638):190-195.
[11]Sun Q,Zachariah S,Chaudhary PM,et al.The human herpes virus8-encoded viral FLICE-inhibitory protein induces cellular transformation via NF-kappa B activation[J].JBiol Chem,2003,278(52):52437-52445.
[12]Zhu X,Guo Y,Yao S,et al.Synergy between Kaposi′s sarcoma-associated herpesvirus(KSHV)vIL-6 and HIV-1 Nef protein in promotion ofangiogenesis and oncogenesis:role of the AKT signaling pathway[J].Oncogene,2013,[Epub ahead of print]
[13]Thome M,Schneider P,Hofmann K,et al.Viral FLICE-inhibitory proteins(FLIPs)preventapoptosis induced by death receptors[J].Nature,1997,386(6624):517-521.
[14]Bagnéris C,Ageichik AV,Cronin N,et al.Crystal structure of a vFlip-IKKgamma complex:insights into viral activation of the IKK signalosome[J].Mol Cell,2008,30(5):620-631.
[15]Chaudhary PM,Jasmin A,Eby MT,et al.Modulation of the NF-κB pathway by virally encoded death effector domains-containing proteins[J].Oncogene,1999,18(42):5738-5746.
[16]Field N,Low W,Daniels M,et al.KSHV vFLIP binds to IKK-γto activate IKK[J].J Cell Sci,2003,116(18):3721-3728.
[17]Matta H,Chaudhary PM.Activation of alternative NF-κB pathway by human herpes virus 8-encoded Fas-associated death domain-like IL-1β-converting enzyme inhibitory protein(vFLIP)[J].Proc Natl Acad Sci USA,2004,101(25):9399-9404.
[18]Sturzl M,Hohenadl C,Zietz C,et al.Expression of K13/v-FLIP gene of human herpesvirus 8 and apoptosis in Kaposi′s sarcoma spindle cells[J].J Natl Cancer Inst,1999,91(20):1725-1733.
[19]Graham C,Matta H,Yang Y,et al.Kaposi′s sarcomaassociated herpesvirus oncoprotein K13 protects against B cell receptor-induced growth arrest and apoptosis through NF-κB activation[J].JVirol,2012,87(4):2242-2252.
[20]Godfrey A,Anderson J,Papanastasiou A,et al.Inhibiting primary effusion lymphoma by lentiviral vectors encoding short hairpin RNA[J].Blood,2005,105(6):2510-2518.
[21]Guasparri I,Keller SA,Cesarman E.KSHV vFLIP is essential for the survival of infected lymphoma cells[J].JExp Med,2004,199(7):993-1003.
[22]Sakakibara S,Espiqol-Frigole G,Gasperini P,et al.A20/TNFAIP3 inhibits NF-κB activation induced by the Kaposi′s sarcoma-associated herpesvirus vFLIP oncoprotein[J].Oncogene,2012,32(10):1223-1232.
[23]Xu Y,Ganem D.Induction of chemokine production by latent Kaposi′s sarcoma-associated herpesvirus infection of endothelial cells[J].JGen Virol,2007,88(1):46-50.
[24]Sun Q,Matta H,Lu G,et al.Induction of IL-8 expression by human herpesvirus8 encoded vFLIPK13 via NF-κB activation[J].Oncogene,2006,25(19):2717-2726.
[25]Emuss V,Lagos D,Pizzey A,etal.KSHVmanipulates Notch signaling by DLL4 and JAG1 to alter cell cycle genes in lymphatic endothelia[J].PLoS Pathog,2009,5(10):e1000616.
[26]Ye FC,Zhou FC,Xie JP,etal.Kaposi′s sarcoma-associated herpesvirus latent gene vFLIP inhibits viral lytic replication through NF-κB-mediated suppression of the AP-1 pathway:a novelmechanism of virus control of latency[J].JVirol,2008,82(9):4235-4249.
[27]He M,Zhang W,Bakken T,et al.Cancer angiogenesis induced by Kaposi sarcoma-associated herpesvirus ismediated by EZH2[J].Cancer Res,2012,72(14):3582-3592.
Construction of the recombinant expression lentivirus vector carrying KSHV vFLIP gene and its protein expression in human umbilical vein endothelial cells
JIN Liu-yang,YAN Qin,LU Chun
(Department of Microbiology and Immunology,Nanjing Medical University,Nanjing Jiangsu 210029,China)
Objective:To construct the recombinant lentivirus carrying Kaposi′s sarcoma-associated herpesvirus(KSHV)-encoded viral FLICE inhibitory protein(vFLIP)gene and to obtain human umbilical vein endothelial cells(HUVECs)stably expressing vFLIP protein.M ethods:The fragment of vFLIP gene from expression plasmid pEF-vFLIP was cloned into the lentivirus vector pHAGE-CMV-MCS-IZs-Green.Then,the recombinant plasmid pHAGE-vFLIP,packaging plasmid psPAX2 and envelope plasmid pMD2.G were co-transfected into 293 T cells.The filtered culturemediawere harvested and the recombinant lentiviruswas obtained.After detecting the titer of recombinant lentivirus,the expression of vFLIP protein in lentivirus-infected HUVECswas detected byWestern blot.Next,HUVECs stably expressing vFLIPwere obtained by flow cytometry assay(FCM)and verified the expression of vFLIPbyWestern blot.Finally,the functional verificationswere performed in HUVECs stably expressing vFLIP,including detecting the activity of NF-κB by luciferase assay,the location of p65 by immunofluorescence assay(IFA),and the expression of IκBαprotein byWestern blot.Results:The recombinant lentivirus vector containing vFLIPwas constructed successfully,and the expression of vFLIP in HUVECs infected with lentivirus-vFLIPwas detectable.The HUVECs stably expressing vFLIP were gained successfully by FCM,which could inhibit the degradation of IκBαand the translocation of p65 to activate NF-κB pathway.Conclusion:The recombinant lentivirus carrying KSHVvFLIP gene was successfully constructed,and the HUVECs stably expressing vFLIPwith the ability of activating NF-κB pathway were obtained.
recombinant lentivirus;Kaposi′s sarcoma-associated herpesvirus;viral FLICE inhibitory protein;human umbilical vein endothelial cells;NF-κB
R392.11
A
1671-7783(2014)01-0006-06
10.13312/j.issn.1671-7783.y130235
国家自然科学基金资助项目(81371824)
金镠洋(1986—),女,硕士研究生;卢春(通讯作者),教授,博士生导师,E-mail:clu@njmu.edu.cn
2013-10-17 [编辑]陈海林
