血管内皮祖细胞移植对大鼠重症急性胰腺炎肾损伤的保护作用
2014-08-04党胜春王平江曾艳华陈荣芳王豪冯舒崔磊张建新
党胜春,王平江,曾艳华,陈荣芳,王豪,冯舒,崔磊,张建新
(江苏大学附属医院普外科,江苏镇江212001)
血管内皮祖细胞移植对大鼠重症急性胰腺炎肾损伤的保护作用
党胜春,王平江,曾艳华,陈荣芳,王豪,冯舒,崔磊,张建新
(江苏大学附属医院普外科,江苏镇江212001)
目的:探讨内皮祖细胞(endothelial progenitor cells,EPCs)对大鼠重症急性胰腺炎(severe acute pancreatitis,SAP)合并肾损伤的保护作用。方法:通过共沉淀法制备超顺磁性氧化铁(superparamagnetic iron oxide,SPIO);密度梯度离心法分离培养SD大鼠骨髓来源EPCs;使用SPIO标记EPCs;将72只SD大鼠随机分为对照组、SAP组和SPIOEPCs组,采用胰腺被膜下均匀注射5%牛磺胆酸钠制作SAP模型。对照组和SAP组经尾静脉注射生理盐水,SPIOEPCs组注射等量的SPIO-EPCs;分别于造模2,6,12 h检测各组大鼠血清中淀粉酶、尿素氮、肌酐和肿瘤坏死因子 α(TNF-α)的水平;苏木精染色观察肾组织各时相病理变化及进行病理评分,普鲁士蓝染色观察肾组织各时相铁颗粒含量。结果:SAP组2,6,12 h的血清淀粉酶、尿素氮、肌酐和TNF-α的水平较对照组明显升高(P<0.01);而SPIO-EPCs组均显著低于SAP组(P<0.01)。与对照组比较,SAP组2,6,12 h肾病理改变明显加重,肾病理评分明显提高(P<0.05);与SAP组比较,SPIO-EPCs组肾病理改变明显减轻,肾病理评分明显降低(P<0.05)。普鲁士蓝染色见SPIOEPCs组在2,6和12 h肾组织血管内皮铁颗粒含量逐渐增多。结论:移植EPCs可减少炎症介质释放,减轻SAP肾的血管内皮损伤,对大鼠SAP肾损伤具有保护作用。
内皮祖细胞;重症急性胰腺炎;肾损伤;超顺磁性氧化铁;大鼠
重症急性胰腺炎(severe acute pancreatitis,SAP)常引起全身多器官障碍综合征和全身炎症反应综合征,具有发病急、变化快、并发症较多等特点。其中,急性肾损伤(acute renal injury,ARI)是SAP时常见并发症,且病死率较高[1]。SAP时释放的大量胰源性毒素、炎症介质、多种细胞因子、血管活性物质及微循环改变引起的级联反应是导致SAP相关性肾损伤的重要因素。
内皮祖细胞(endothelial progenitor cells,EPCs)是一类具有游走特性并能定向增殖分化为成熟血管内皮细胞的前体细胞,首次由Asahara等[2]在研究成体外周血时发现,并将细胞表面标志是CD133+、CD34+、VEGFR-2+的细胞定义为EPCs。大量研究表明,通过移植EPCs或基因修饰的EPCs在治疗缺血性心脏病、脑血管病及周围血管病等方面具有重要的作用[3-5]。超顺磁性氧化铁(superparamagnetic iron oxide,SPIO)可作为磁共振成像分子探针标记EPCs,进而检测活体内细胞的迁徙、代谢和生物学行为,为以后移植EPCs治疗器官损伤的磁共振成像示踪奠定基础。
本实验通过移植SPIO标记的EPCs到SAP合并ARI大鼠模型中,目的在于探索EPCs能否更有效地保护SAP合并的肾损伤。
1 材料与方法
1.1 材料
成年SD大鼠(江苏大学实验中心提供),淋巴细胞分离液(美国BD公司),CD34-FITC抗体、VEGFR-2-PE(美国Chemcon公司),EPCs培养基(齐氏生物科技有限公司),细胞消化酶液(齐氏生物科技有限公司),胎牛血清(美国HyClone公司),牛磺胆酸钠(美国Sigma公司),六水合三氯化铁(国药集团化学试剂有限公司),七水合硫酸亚铁(上海试剂二厂)。
1.2 实验方法
1.2.1 SPIO制备 氧化铁纳米粒子的合成并与精氨酸(arginine)偶联参考文献[6-7]制备,采用共沉淀法制备Fe2O3水基磁流体(质量浓度为16 g/L),以精氨酸修饰,配成表面带正电荷的纳米 Fe2O3精氨酸水基磁性液体,质量浓度调整为2 g/L。1.2.2 大鼠骨髓EPCs的分离、培养及鉴定 大鼠骨髓EPCs的制备参照文献[8]获取。鉴定方法采用CD34、VEGFR-2表达的免疫荧光染色;EPCs培养2 d后,取部分EPCs,4%多聚甲醛固定30 min,PBS洗去固定液。分别加入15μL 0.2 mg/mL的抗鼠FITC-CD34和FITC-VEGFR-2,湿盒避光孵育2 h后,将PBS作为空白对照。PBS将多余抗体洗去,60%缓冲甘油封片后置于荧光显微镜下观察细胞。
1.2.3 SPIO标记EPCs 将SPIO加入第5代EPCs细胞培养液中进行标记,SPIO的终质量浓度为25 μg/mL,置培养箱内再孵育24 h,PBS洗涤3次以去除未进入细胞的铁离子,37℃培养48 h后用0.25%胰蛋白酶消化细胞,制备成密度为4×109/L的细胞悬液并备用,测细胞标记率>95%。
1.2.4 动物模型与分组及标记的EPCs移植 SD大鼠72只,体质量250~300 g,雌雄不限,实验前12 h禁食不禁饮。SD大鼠随机分为对照组、SAP组、SPIO-EPCs组。各组术后又分为2,6,12 h组,每组8只。按20 mg/kg体质量计算肌注氯胺酮进行麻醉,SAP组和SPIO-EPCs组麻醉后采用胰腺被膜下均匀注射5%牛磺胆酸钠制作SAP模型[9],对照组则用等量生理盐水注射,关腹。
取备用的SPIO-EPCs悬液,无菌PBS稀释悬液至2×109/L[10]。SPIO-EPCs组制模后尾静脉缓慢注射0.4 mL SPIO-EPCs悬液,对照组和SAP组尾静脉缓慢注射等量PBS。每组于2,6及12 h后分别抽取血样及组织学观察。
1.2.5 标本测定 每组分别于2,6及12 h各时相点取大鼠肠系膜上静脉血液5 mL,3 000 r/min离心10 min,取上层血清-20℃保存。采用全自动生化分析仪测定血清淀粉酶、尿素氮、肌酐;采用酶联免疫吸附反应(ELISA)方法检测TNF-α,严格按照其试剂盒说明操作测定。
1.2.6 组织病理学检查 分别于移植后2、6及12 h,取大鼠左肾(其中12 h后SAP组大鼠死亡2只,死亡率为25%),PBS清洗后,置于10%中性甲醛溶液中固定15~20 h,经过脱水、透明、浸蜡等过程制成蜡块。苏木精(HE)染色,光镜下观察肾组织病理变化;普鲁士蓝染色,光镜下观察各组肾组织铁颗粒情况。肾组织损伤评分参照文献[11]。每张切片随机选取20个视野,对每个视野按标准进行单独评分,20个视野的平均分数为动物的最后病理评分。
1.3 统计学处理
使用SPSS 16.0统计软件进行数据分析。计量指标以均数±标准差(±s)表示,组间比较用单因素方差分析,方差不齐采用Kruskal-Wallis H检验,等级资料用非参数统计法的Man-Whitney检验,P< 0.05为差异有统计学意义。
2 结果
2.1 Fe2O3-精氨酸粒子的制备
产物为近单个分散的球形纳米颗粒,粒度均匀,未见明显团聚,粒径分布窄,约20 nm。
2.2 EPCs的形态学变化及免疫荧光鉴定
分离、培养大鼠骨髓来源的EPCs 2 d后,光镜下观察见细胞开始贴壁,呈长梭形、三角形、纺锤形或不规则形样改变;免疫荧光染色可见经FITC标记的CD34,VEGFR-2染色的细胞表面呈绿色荧光,表达均为阳性。
2.3 移植EPCs预处理对SAP大鼠血清淀粉酶、尿素氮、肌酐和TNF-α的影响
SAP组2,6及12 h的淀粉酶、尿素氮、肌酐和TNF-α水平较对照组明显升高(P<0.01);SPIOEPCs组血清淀粉酶、尿素氮、肌酐和TNF-α水平均显著低于SAP组(P<0.01),见图1。
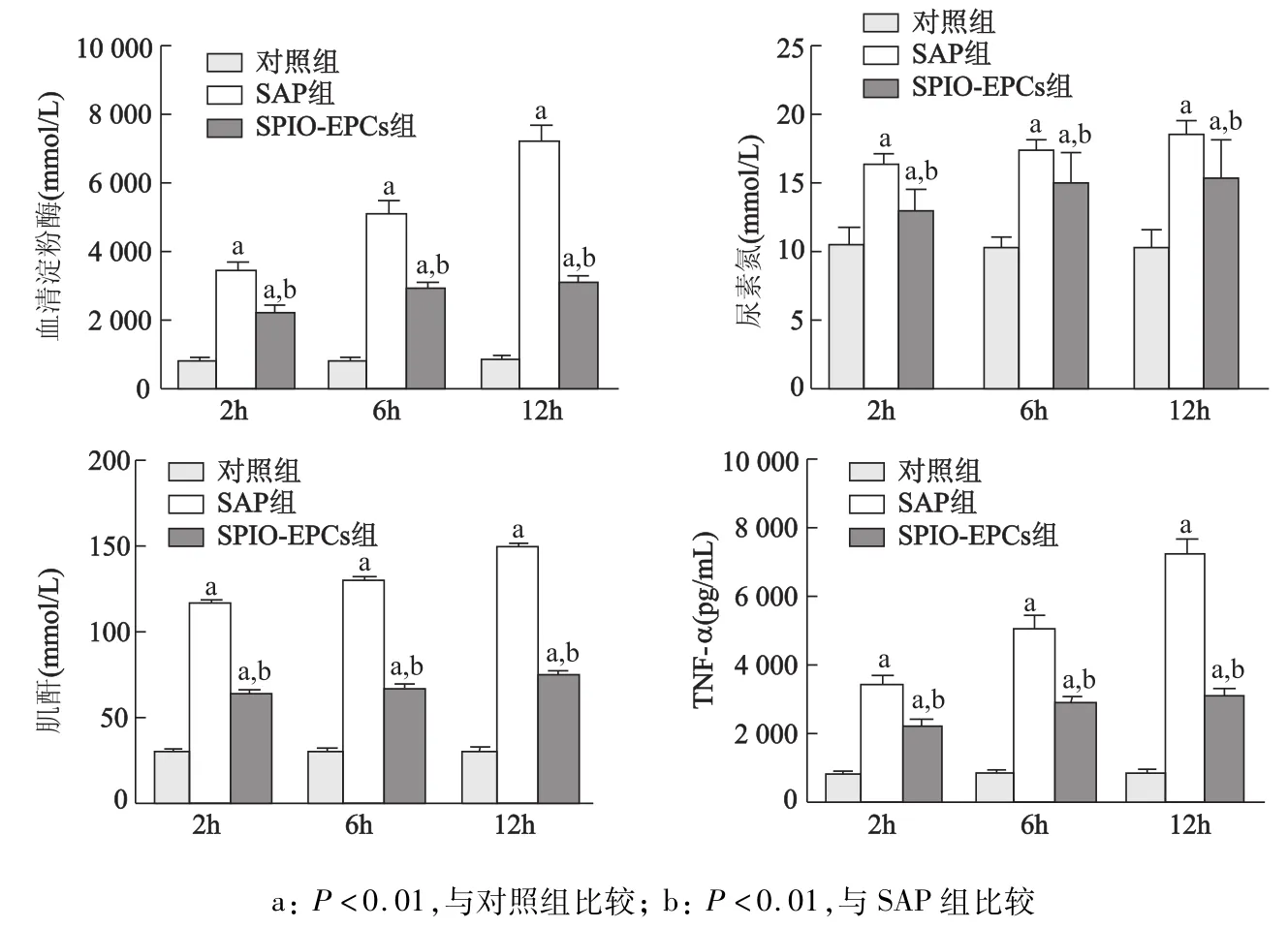
图1 移植EPCs预处理对SAP大鼠血清淀粉酶、尿素氮、肌酐和TNF-α的影响
2.4 病理变化
2.4.1 肾组织学改变 大体观察:对照组肾脏及肾脏周围脂肪组织结构基本正常,SAP组2 h肾脏无明显肉眼改变;6 h肾脏稍肿胀,被膜紧张,表面有散在出血点;12 h肾脏肿胀明显,被膜高度紧张,肾脏表面有大量出血点。SPIO-EPCs组2 h肾脏病理改变不明显,6 h及12 h肾病理变化较SAP组均明显减轻。光镜检查:对照组2、6及12 h肾小球结构完整,未见异常;SAP组2 h肾小球结构变得稍模糊,间质结构界限欠清,间质细胞稍有变性;6 h肾小球结构破坏,间质内可见较多红细胞;12 h肾小球萎缩,肾小球细胞形态破坏,间质内可见大量红细胞;SPIO-EPCs组较SAP组均有明显的改善。见图2。
2.4.2 肾组织普鲁士蓝染色结果 SPIO-EPCs组在2,6及12 h肾组织血管内皮铁颗粒含量逐渐增多,说明随着时间的推移,SPIO标记的EPCs定向归巢到受损伤的肾组织含量逐渐增多。见图3。
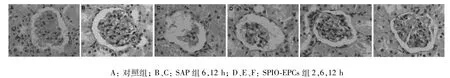
图2 光镜下肾组织病理变化(HE×200)
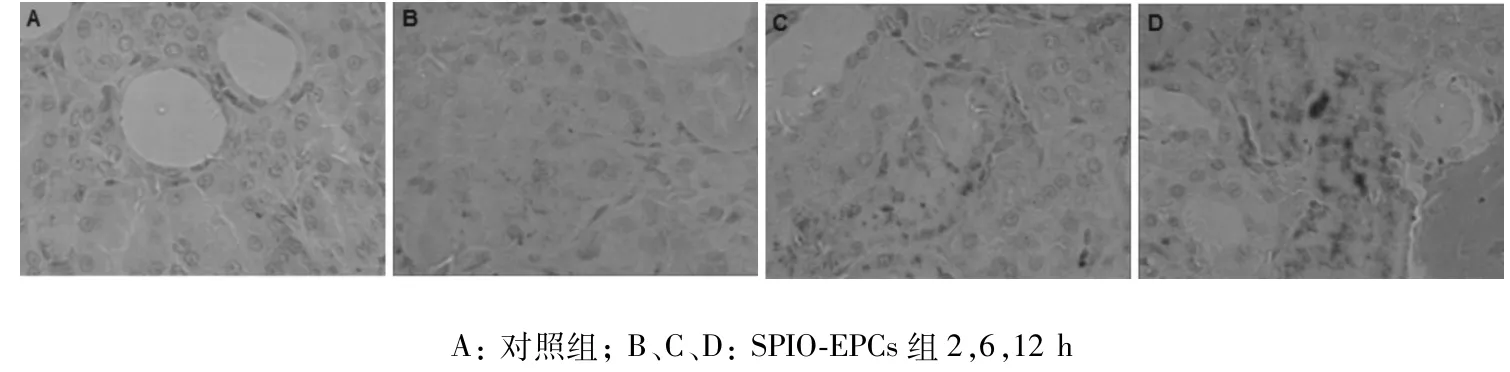
图3 肾组织普鲁士蓝染色(×200)
2.4.3 肾脏组织学评分 对照组肾组织结构正常;与对照组比较,SAP组肾病理改变明显加重,肾病理评分显著提高(P<0.05);与SAP组比较,SPIOEPCs组病理评分明显降低(P<0.05),见图4。

图4 肾脏损伤评分
3 讨论
SAP时大量的炎症细胞被激活,同时伴随大量的炎症因子释放,导致胰腺及胰外多器官的损伤。ARI是SAP常见并发症之一,其主要的病理改变是肾小管的变性坏死。Mangione等[12]研究表明TNF-α是SAP发生发展中重要的细胞因子,能诱导IL-1和IL-6等产生,促进肾小球内皮细胞和上皮细胞合成内皮素-1,导致肾血管强烈收缩,加重肾缺血和血栓形成,并使炎性介质与氧自由基释放增多,直接损伤肾组织。Zhang等[13]研究发现SAP时释放的TNF-α通过Fas/Fasl系统将信号传递至Caspase家族导致细胞凋亡,同时能加强肾小球系膜细胞表达的细胞间黏附分子(ICMC-1)释放,导致核转录因子(NF)-κB和活化蛋白(AP)-1结合从而引起肾细胞的凋亡。SAP合并ARI时由于炎性反应引起水电解质、酸碱平衡紊乱,肾小球滤过率降低及肾血流量减少,导致尿酸排出减少,加上肾小球内膜细胞下免疫复合物的形成,胰腺及其周围炎性病变累及毗邻的肾脏等,这些机制都在SAP引起ARI中发挥了重要的作用。
血管EPCs是血管内皮细胞的前体细胞,脐带血、成体外周血及骨髓中均存在能分化为血管内皮细胞的EPCs。最近的研究表明EPC在内皮损伤或功能不全的修复中起重要作用[14]。从脐带血或自身骨髓、外周血中分离EPCs,体外扩增后再向体内输注,进行定向细胞治疗,这可能成为SAP合并多器官损伤治疗的理想方法。Rookmmaaker等[15]研究发现EPCs对肾小球内皮细胞的修复具有促进作用。Chade等[16]在研究猪肾动脉狭窄时,通过输注自体EPCs,发现肾狭窄血管内皮生长因子表达增加,并伴有新血管生长成熟,进而减缓了肾微血管重构及动脉的纤维化。Patschan等[17]发现肾脏急性缺血时能够快速动员EPCs到肾髓质乳头部位,使其在肾脏内皮细胞中具有潜在修复作用。
SPIO在较弱的外磁场中产生巨大的磁性,而当磁场撤离后磁性也迅速消失,即所谓的超顺磁性,该特性使其成为磁共振成像应用较广的对比剂之一。利用干细胞吞噬SPIO来标记其本身,再通过体外细胞共培养,从而应用磁共振成像技术对细胞进行活体示踪。但如何确定铁浓度的安全有效范围以有效标记EPCs,也是我们研究的重点。实验表明,细胞内游离的铁过多可使细胞的氧化作用加强,引起过多的氧化自由基释放,损伤甚至破坏细胞[18]。Arbab等[19]研究表明,浓度为25μg/mL SPIO标记细胞不影响其生物活性,且能获得较好的标记效果,但50μg/mL SPIO标记则影响其生物活性。
本实验采用带正电荷的精氨酸修饰纳米化处理的氧化铁颗粒,通过培养大鼠骨髓来源的EPCs,使带负电荷的EPCs通过非特异性膜表面吸收摄取铁颗粒进入细胞内,成功标记后,将EPCs移植到大鼠SAP合并ARI模型中。通过检测大鼠血清中淀粉酶、尿素氮、肌酐和TNF-α的含量,同时观察肾病理损伤的变化。结果表明,移植EPCs治疗后,SPIOEPCs组血清淀粉酶、尿素氮、肌酐和TNF-α的含量均较SAP组显著降低,肾病理损伤亦显著降低。基于本实验的结果,我们做出了如下推断:SAP肾损伤炎症反应释放的炎症介质以及多种未知因素能动员EPCs进入外周循环,进而迁移到受损部位,修复损伤的内皮组织,减少炎症介质的释放。但EPCs的动员、归巢及修复血管内皮的具体机制目前尚不清楚,有待于进一步研究。
[1]Pupelis G.Renal failure in acute pancreatitis.Timing of dialysis and surgery[J].Przegl Lek,2000,57(suppl 5):29-31.
[2]Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964-967.
[3]Schuh A,Liehn EA,Sasse A,et al.Transplantation of endothelial progenitor cells improves neovascularization and left ventricular function aftermyocardial infarction in a ratmodel[J].Basic Res Cardiol,2008,103(1):69-77.
[4]Hess DC,Hill WD,Martin-Studdard A,et al.Bone marrow as a source of endothelial cells and NeuN-expressing cells After stroke[J].Stroke,2002,33(5):1362-1368.
[5]Kalka C,Masuda H,Takahashi T,et al.Transplantation of ex vivo expanded endothelial progenitor cells for therapeutic neovascularization[J].Proc Natl Acad Sci U SA,2000,97(7):3422-3427.
[6]党胜春,张勇,沙鑫,等.Clodronate—SPIO脂质体对
重症急性胰腺炎大鼠肝损伤的保护作用及MRI评价
[J].中华肝胆外科杂志,2005,16(11):870-874.
[7]曹爱红,石红建,聂芳,等.纳米磁性探针转染大鼠外周血内皮祖细胞的磁共振成像实验研究[J].第三军医大学学报,2008,30(20):1948-1951.
[8]党胜春,陈纪芳,冯舒,等.小鼠骨髓源性内皮祖细胞的体外培养及标志物鉴定[J].江苏大学学报:医学版,2013,23(5):382-384.
[9]Zhang JX,Dang SC,Qu JG,et al.Preventive effect of tetramethylpyrazine on intestinal mucosal injury in rats with acute necrotizing pancreatitis[J].World JGastroenterol,2006,12(39):6386-6390.
[10]毛梅,张波,傅祖红,等.内皮祖细胞移植对肺损伤炎症状态的影响[J].中国组织工程研究,2013,17(10):1780-1784.
[11]雷文章,韦靖江,沈文律.实验性坏死性胰腺炎多器官损伤与内毒素血症的关系[J].中华实验外科杂志,1995,12(3):131-132.
[12]Mangione F,Calcaterra V,Esposito C,et al.Renal blood flow redistribution during acute kidney injury[J].Am JKidney Dis,2010,56(4):785-787.
[13]Zhang XP,Zhang J,Xu Q,et al.Influence of baicalin and octreotide on NF-kappaB and p-selectin expression in liver and kidney of rats with severe acute pancreatitis[J].Inflammation,2009,32(1):1-11.
[14]Kawamoto A,Losordo DW.Endothelial progenitor cells for cardiovascular regeneration[J].Trends Cardiovasc Med,2008,18(1):33-37.
[15]Rookmaaker MB,Tolboom H,Goldschmeding R,etal.Bone-marrow-derived cells contribute to endothelial repair after thromboticmicroangiopathy[J].Blood,2002,99(3):1095.
[16]Chade AR,Zhu X,Lavi R,et al.Endothelial progenitor cells restore renal function in chronic experimental renovascular disease[J].Circulation,2009,119(4):547-557.
[17]Patschan D,Krupincza K,Patschan S,etal.Dynamics ofmobilization and homing of endothelial progenitor cells after acute renal ischemia:modulation by ischemic preconditioning[J].Am J Physiol Renal Physiol,2006,291(1):F176-185.
[18]Ben-Hur T,van Heeswijk RB,Einstein O,etal.Serial in vivo MR tracking of magnetically labeled neural spheres transplanted in chronic EAE mice[J].Magn Reson Med,2007,57(1):164-171.
[19]Arbab AS,Bashaw LA,Miller BR,et al.Characterization of biophysical and metabolic properties of cells labeled with superparamagnetic iron oxide nanoparticles and transfection agent for cellular MR imaging[J].Radiology,2003,229(3):838-846.
Protecting effect of endothelial progenitor cell transplantation on renal injury w ith severe acute pancreatitis
DANG Sheng-chun,WANG Ping-jiang,ZENG Yan-hua,CHEN Rong-fang,WANG Hao,FENG Shu,CUILei,ZHANG Jian-xin
(Department of General Surgery,the Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001,China)
Objective:To explore the protecting effect of endothelial progenitor cells(EPCs)transplantation on renal complicated injury with severe acute pancreatitis(SAP).M ethods:Tomanufacture the superparamagnetic iron oxide(SPIO)by the coprecipitation method;collecting rat EPCs from bonemarrow,mononuclear cellswere isolated with ficoll,VEGF,fibroblast growth factor(FGF)in the culturemedium;EPCswere labeled by the SPIO;72 ratswere randomly divided into control group,SAP group,SPIO-EPCs group.The SAPmodels were established by injection of sodium taurocholate into the pancreatic capsule.Rats in the SPIO-EPCs group were injected with SPIO-EPCs through tail vein.Rats in SAP group and control group only
phosphate buffered solution with the same dose.Then the serum levels of AMS,BUN,Cr and TNF-αat2 h,6 h,12 h aftermodeling.Pathologic alteration of kidney were also observed.HE staining was used to observe the pathologic change of kidney tissue on different time between three groups.Prussian blue staining was used to observe the change of iron particles in SPIO-EPCs group on different time.Results:In SAP group serum levels of AMS,BUN,Cr and TNF-αwere significantly elevated compared with control group(P<0.01).Compared with SAP group,serum levels of AMS,BUN,Cr andTNF-αwere significantly decreased in SPIO-EPCs group(P<0.01).The pathological scores of renal in SAP group were higher than those of control group(P<0.05).The pathological scores of renal in SPIOEPCs group were lower than those of SAP group(P<0.05).From the Prussian blue staining,we can observe that the iron particles in renal vascular endothelial increased gradually on the time passed.Conclusion:EPCs transplantation can reduce the release of inflammatory mediators,reduce renal vascular endothelial injury SAP.The transplanting EPCs can alleviate the renal injury with SAP.
endothelial progenitor cells;severe acute pancreatitis;renal injury;superparamagnetic iron oxide;rat
R576
A
1671-7783(2014)01-0001-05
10.13312/j.issn.1671-7783.y130253
国家自然科学基金资助项目(81070287);江苏省自然科学基金资助项目(BK2011484,BK2012704)
党胜春(1972—),男,江苏泗阳人,副教授,副主任医师,博士,主要从事胰腺炎基础和临床研究。
2013-11-12 [编辑]何承志
