血清铁蛋白、叶酸检测在血液系统恶性肿瘤患者中的临床价值
2014-08-04张秀娟于文征
张秀娟 于文征
1 滨州医学院,山东省滨州市 256603; 2 山东省巨野县人民医院血液科; 3 滨州医学院附属医院血液科
近年来的研究表明,血清SF水平的明显上升与恶性肿瘤相关,且与疾病的严重程度成正比,随临床分期的升级,血清SF水平逐渐升高[1]。叶酸是B族维生素的一种,其主要生物学功能是参与细胞内的甲基化反应和脱氧核糖核酸的从头合成。叶酸缺乏可能与肿瘤发生有关,其中研究最多的是结肠癌。本研究回顾性分析97例血液系统恶性肿瘤患者病程中血清SF、叶酸水平,并结合疗效进行相关性分析。观察血清叶酸、SF水平的变化在恶性血液病患者病程中的变化规律及临床价值。
1 资料与方法
1.1 一般资料 97例血液系统恶性肿瘤病例均为2008年1月-2013年6月我院住院患者,经临床、骨髓检查及免疫分型、组织活检确诊,诊断及疗效标准符合张之南主编的《血液病诊断及疗效标准》(第3版)[2]。无近期活动性心、肝、肾疾患及其他恶性肿瘤、无感染性疾病、无营养不良及消化道疾患;近3周无叶酸、铁剂等用药史。其中慢性淋巴细胞白血病15例,慢性粒细胞白血病20例,急性淋巴细胞白血病21例,急性髓系白血病17例,淋巴瘤13例,多发性骨髓瘤11例。所有患者中初发69例,复发28例。男46例,女51例,年龄14~72岁,中位年龄为47岁。
1.2 方法 患者诱导化疗前及诱导化疗骨髓抑制恢复后(感染控制、肝功能正常)检测血清SF、叶酸,同时行血常规、骨髓细胞学检查评价疗效。对照组为健康体检人群的结果,清晨空腹抽静脉血,各指标的测定均由本院检验科和骨髓室完成,正常值参照检验科及骨髓室的正常值参考范围。血清SF及叶酸测定均采用化学发光免疫分析法(贝克曼库尔特公司ACESS全自动化学发光免疫分析仪)。
1.3 统计学处理 组间均数比较采用t检验,率的比较采用卡方检验,各指标间相关性分析采用SPSS16.0。
2 结果
2.1 患者治疗前血清SF及叶酸水平 治疗前恶性血液疾病患者SF明显增高、叶酸明显减低,与正常对照组相比均有显著性差异(P<0.01)。见表1。
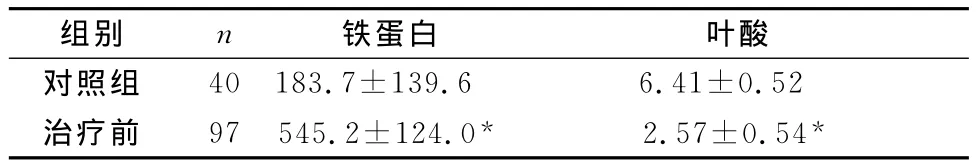
表1 治疗前患者血清铁蛋白、叶酸水平与对照组比较(ng/ml)
2.2 患者治疗后血清SF及叶酸水平 治疗后完全缓解的54例恶性血液疾病患者SF、叶酸与治疗前相比有明显变化(P<0.01),但仍未恢复正常,与对照组相比仍有有统计学意义,其中SF(P<0.05)、叶酸(P<0.01);部分缓解的20例SF、叶酸与对照组及治疗前比较均有统计学意义(P<0.01);未缓解的23例恶性血液疾病患者SF、叶酸与对照组比较均有统计学意义(P<0.01),与治疗前相比变化不大,但其中叶酸仍有可比性(P<0.05)。见表2。
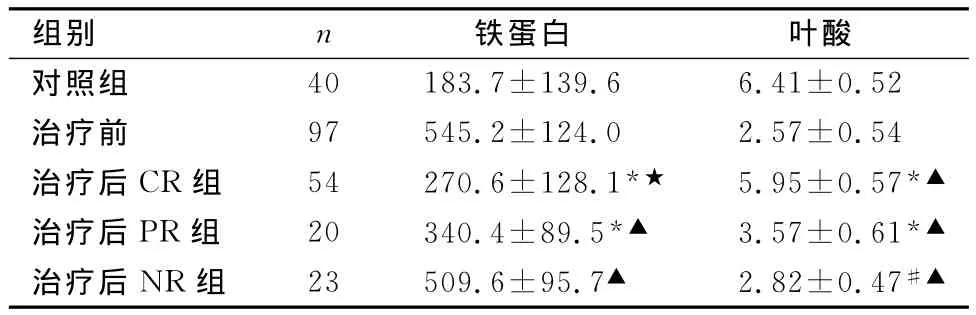
表2 治疗后患者血清铁蛋白、叶酸水平与对照组及治疗前比较(ng/ml)
2.3 血液系统恶性肿瘤患者SF的表达水平与临床疗效的关系 随着患者SF表达水平的增高,用常规的化疗方案,患者的缓解率越来越低,SF<600ng/ml组的缓解率明显高于SF>600ng/ml组(P<0.05)。见表3。

表3 血清SF的表达水平与临床疗效的关系
3 讨论
血清SF是一种分子量较大的含铁蛋白质,具有强大的铁结合和储备能力,是铁储存的形式之一[3]。广泛存在于机体组织细胞内、体液中,主要分布于肝、脾、骨髓内,是网状内皮系统储存铁的主要形式[4]。在正常条件下血清中含量稳定,为机体合成含铁物质时提供铁。多项临床研究发现,恶性肿瘤患者SF增高,以肝癌为最高,肺癌、白血病、恶性淋巴瘤患者转移时SF更高[5]。叶酸又称蝶酰谷氨酸,主要被小肠上段吸收,在十二指肠和空肠上皮黏膜细胞内叶酸还原酶(辅酶NADPH)的作用下甲基化生成二氢叶酸,再甲基化后生成四氢叶酸。甲基四氢叶酸为一碳单位的载体,参与组成DNA和RNA的嘌呤、嘧啶等重要物质的生物合成[6]。Fang等[7]研究证实胃、肠恶性肿瘤组织中的癌基因普遍存在低甲基化现象,这些特殊基因低甲基化状态会使肿瘤抑制基因变异。
急性白血病是造血干细胞疾病,表现为原始细胞分化停滞、成熟凋亡障碍,其发病机制与染色体、基因水平改变相关。已有资料显示铁蛋白及其编码基因在多种肿瘤细胞中表达显著升高[8],已经证明急性粒细胞白血病患者原始细胞中铁蛋白含量较高。本组资料显示,血液系统肿瘤患者各阶段均存在不同程度的铁蛋白增高、叶酸减低。化疗前血清铁蛋白水平明显高于对照组(P<0.01);与文献[9]报道的一致,恶性肿瘤患者由于铁蛋白的运转、清除能力降低和释放入血增加导致血清铁蛋白水平显著升高。另外,肿瘤细胞自身合成了在质和量上均有异常的特异性异构铁蛋白。叶酸缺乏可导致尿嘧啶脱氧核苷酸取代胸腺嘧啶核苷酸掺入DNA,使DNA股链断裂、甲基化减低、损伤修复障碍、细胞生长受抑制、染色体脆性易变以及细胞周期被阻滞于S和G2M/期,且不依赖于p53的表达,从而影响细胞凋亡[10]。本资料显示的结果患者化疗前叶酸明显低于对照组(P<0.01),这与上述低叶酸状态促使肿瘤的发生相一致。化疗后完全缓解组的患者SF仍高于对照组(P<0.05),叶酸仍低于对照组(P<0.01),这可能因为达到完全缓解时患者体内仍有约106~108左右的白血病细胞,说明恶性血液肿瘤缓解后尚需进一步治疗。但完全缓解患者铁蛋白及叶酸水平较化疗前有明显的改变(P<0.01)。这是由于化疗后缓解患者随着肿瘤细胞负荷减低、增生受抑制,血清铁蛋白的表达水平逐渐下降,而叶酸的代谢也逐渐恢复正常。部分缓解及未缓解患者SF仍较高,与对照组比较(P<0.01),与治疗前比较仅叶酸有统计学意义(P<0.05)。因为残存的大量白血病细胞中铁蛋白及其编码基因仍在显著表达,合成大量铁蛋白,同时分裂增值过快的白血病细胞,需要更多的叶酸作为辅酶参与DNA的合成。另外患者消化系统器官胃肠道受累,致叶酸的摄入、吸收不良进一步促使叶酸的低水平形成。因此血清铁蛋白与叶酸水平可以间接反应患者病情的进展情况以及对治疗的反应程度。同时发现SF<600ng/L的血液系统恶性肿瘤缓解率达81.2%,而SF>600ng/ml者缓解率仅57.1%,二者相比较(P<0.05),进一步提示铁蛋白可以作为判断肿瘤预后的指标。
血清铁蛋白、叶酸作为一种常见检查,具有无创性、价格便宜、无不良反应等优点,容易被医生和患者接受,尤其适合条件有限的基层医院推广应用。动态监测血液系统恶性肿瘤患者铁蛋白及叶酸水平变化不仅有助于临床诊断、治疗与预后的判断,还能够初步进行疗效评价,指导化疗方案的及时调整。
[1]董毅,刘蕾,朱太岗,等.血清铁蛋白检测在贫血性疾病中的临床价值〔J〕.中华全科医学2010,8(4):438.
[2]张之南,沈悌.血液病诊断及疗效标准〔M〕.第3版.北京:科学出版社,2007:103-234.
[3]Zou Y,Qin Z,Silveus A,et al.Polymorphisms of MICA recognized by human alloantibodies〔J〕.Immunogenetics,2009,61(2):91-100.
[4]熊梅,吴林,王旖旎,等.血清铁蛋白在嗜血细胞综合征治疗效果评价中的临床意义〔J〕.临床和实验医学杂志,2011,10(5):334.
[5]马春红,张坤燕.血清铁蛋白测定的临床意义〔J〕.中国煤炭工业医学杂志,2010,13(8):1258.
[6]Davis CD,Uthus EO.DNA methylation,cancer susceptibility,and nutrient interactions〔J〕.Exp Biol Med(Maywood),2004,229:988-995.
[7]Fang JY,Xiao SD.Alteration of DNAmethylation in gastrointestinal carcinogenesis〔J〕.J Gastroenterol Hepato,2001,16(9):960-968.
[8]Toyokuni S.Role of iron in carcinogenesis:cancer as a ferrotoxic disease〔J〕.Cancer Sci,2009,100(1):9-16.
[9]高绍华,李宝军.急性白血病化疗前后血清叶酸、铁蛋白水平变化及其临床意义〔J〕.武警医学院学报,2009,18(5):447.
[10]刘琰,刘息平,曹祥山,等.血清铁蛋白、叶酸和维生素B12水平的变化在急性早幼粒细胞白血病中的意义〔J〕.肿瘤,2010,30(3):241-242.
