刺参黏多糖抑制胰腺癌SW1990细胞增殖的机制研究
2014-08-04孙菲李晓宇张翠萍徐永红武军单信芝赵坤田字彬
孙菲 李晓宇 张翠萍 徐永红 武军 单信芝 赵坤 田字彬
刺参酸性黏多糖(stichopus japonieus acidic mucopolysaccharide,SJAMP)是由刺参体壁提取的一种动物酸性黏多糖,它可以通过抑制癌细胞增殖、促进癌细胞凋亡发挥抗肿瘤作用[1-2]。本研究组曾报道[3],刺参黏多糖呈时间、剂量依赖性抑制胰腺癌细胞的增殖,诱导其凋亡,但具体机制不明。Hippo信号通路参与调控器官大小及细胞增殖和凋亡[4],其抑癌基因失活与人类肿瘤发生密切相关[5]。本研究应用刺参黏多糖干预胰腺癌SW1990细胞,观察干预后细胞Hippo信号通路靶基因及相关基因表达的变化,探讨其在胰腺癌细胞增殖机制中的作用。
材料和方法
一、材料
人胰腺癌细胞株SW1990购自青岛大学医学院附属医院中心实验室,刺参黏多糖购自中国海洋大学药学院,1640培养基购自GIBCO公司,标准胎牛血清购自杭州四季青公司,RNA提取试剂、逆转录试剂盒和SYBR Green荧光定量PCR试剂盒均购自TaKaRa公司,兔抗人YAP、pYAP、GAPDH一抗及辣根过氧化物酶(HRP)标记羊抗兔二抗购自美国Cell Signaling公司。
二、方法
1.细胞培养:人胰腺癌细胞株SW1990常规培养、传代。取对数生长期细胞接种于6孔板中,每孔1.5×105个细胞。贴壁生长后用8 mg/ml刺参黏多糖分别干预细胞24、48、72 h,以未干预的SW1990细胞作为对照。每组设3个复孔。
2.荧光定量RT-PCR:提取各组细胞的总RNA,采用荧光定量PCR方法检测Hippo信号通路靶基因YAP、MST1、Survivin、Caspase-9、TEAD1 mRNA的表达。引物序列:YAP上游序列为3′-TGAACA-AACGTCCAGCAAGATAC-5′,下游序列为3′-CAG-CCCCCAAAATGAACAGTAG-5′;MST1上游序列为3′-AGCCGCAGTTCACGTTTACCT-5′,下游序列为3′-GATCCACCCTCTTGCCACACT-5′;Survivin上游序列为3′-GATGACGACCCCATAGAGGAAC-5′,下游序列为3′-GGGTTAATTCTTCAAACTGCTTCT-5′;Caspase-9上游序列为3′-AACAGGCAAGCAGCAAAGTT-5′,下游序列为3′-CACGGCAGAAGTTCACATTG-5′;TEAD1上游序列为3′-CAAGGTTTGAGAATGGCCGAT-5′,下游序列为3′-AAACACACAGGCCATGCAGAG-5′。内参GAPDH上游序列为3′-CACCAGGGCTGCTTTTAA-CTC-5′,下游序列为3′-TGGAAGATGGTGATGGGA-TTT-5′。所有引物均由上海生工生物工程技术服务有限公司合成。先应用逆转录试剂盒逆转录为cDNA,再行实时PCR,反应条件:95 ℃ 30 s,95 ℃ 5 s、60 ℃ 30 s,40个循环。通过PCR仪自动获取Ct值,按2-△△Ct的公式计算mRNA表达量。△△Ct=(实验组目的基因平均Ct值- 实验组内参基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参基因平均Ct值)。
3.蛋白质印迹法:收集各组对数生长期细胞,提取总蛋白,采用常规蛋白质印迹法检测YAP、磷酸化YAP(pYAP) 蛋白的表达,以GAPDH为内参。兔抗人YAP、pYAP、GAPDH工作浓度1∶6 000,HRP标记的羊抗兔二抗工作浓度1∶3 000,最后ECL显色, Vilber Fusion Fx7凝胶成像仪摄取图像,Quantity One软件测定条带灰度值,以目的条带与内参条带灰度比值表示目的蛋白的相对表达量。实验重复3次,取均值。
三、统计学处理
结 果
一、各组SW1990细胞Hippo信号通路靶基因及相关基因mRNA表达的变化
8 mg/ml的刺参黏多糖呈时间依赖性下调YAP、TEAD1、Survivin mRNA的表达,上调Caspase-9、MST1 mRNA的表达(图1,表1)。
图1 刺参黏多糖处理24 h后SW1990细胞各基因mRNA的表达
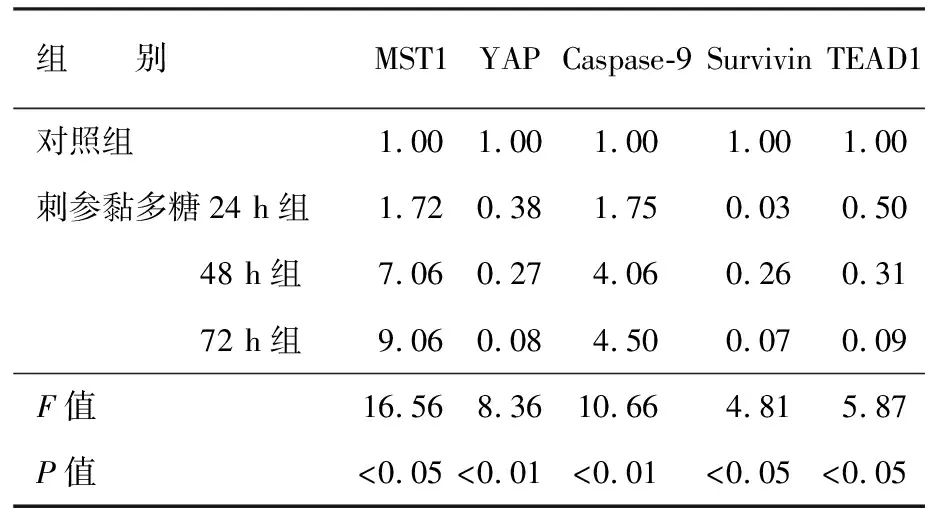
表1 各组SW1990细胞各基因mRNA的表达量
二、各组SW1990细胞YAP、pYAP蛋白表达的变化
8 mg/ml的刺参黏多糖呈时间依赖性下调YAP蛋白的表达,但上调pYAP蛋白的表达(图2,表2)。
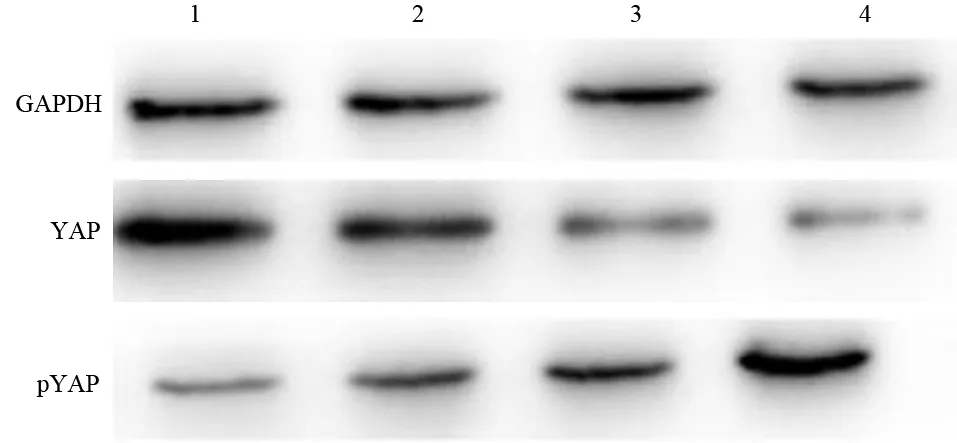
图2 对照组(1)及刺参黏多糖干预24(2)、48(3)、72 h(4)组SW1990细胞YAP、pYAP蛋白的表达

表2 各组SW1990细胞YAP、pYAP蛋白的表达量
讨 论
2005年Huang等首次在果蝇中发现Hippo信号通路[6],该通路在进化过程中高度保守,参与调控细胞增殖和凋亡以及调节器官大小[4],在细胞接触性抑制(细胞接触后改变其运动方向)乃至肿瘤的发生过程中起重要的作用[7]。Hippo通路调节异常被认为是引起癌症发生的原因之一[8]。哺乳动物的Hippo通路成员有MST、WW45、Lats、Mob1、YAP等。MST(磷酸化蛋白激酶)分为MST1和MST2两个亚型,是Hippo信号通路中抑制癌症发生的关键元件[9]。MST2 与MST1蛋白激酶结构相似度88%,二者通过磷酸化负性调控YAP水平[10]。YAP是Hippo信号通路核心效应因子,是一种候选癌基因,位于人类染色体11q22。YAP转录辅助活性取决于YAP在细胞内的位置。位于细胞核内时,它与TEAD转录激活因子一起共同促使下游转录因子Cyclin E、 DIAP1等表达增加,启动基因转录,促进细胞增殖、抑制细胞凋亡[11];YAP磷酸化后转位进入胞质,胞质中的YAP通过磷酸化的ser127与14-3-3蛋白相结合而丧失作为转录辅助激活因子的功能[12]。在多种人类肿瘤中, YAP的表达以及在细胞核的定位都明显增加[13]。有研究发现Hippo-YAP通路在胰腺胚胎发育过程中起到重要作用,YAP可以维持胚胎中胰腺腺泡细胞正常分化[14]。TEAD转录因子家族对YAP导致的肿瘤细胞过度增殖和上皮间质转化(EMT)起重要作用,其中TEAD1和TEAD2与YAP关系尤为密切[15]。
刺参酸性黏多糖是由刺参体壁提取的一种动物酸性黏多糖,具有抗凝血、抗血栓、降血脂、降低血黏度、抗肿瘤、免疫调节、抗菌、抗病毒及促细胞生长等作用[16]。有研究发现,刺参黏多糖可以通过抑制细胞周期因子CyclinD1和CDK4的表达而抑制宫颈癌Hela细胞增殖,通过抑制癌基因c-myc的表达来诱导Hela细胞分化[17]。它可通过抑制细胞增生并诱导凋亡来抑制人肝癌细胞HepG2的生长,通过诱导Bcl-2和nm23-H1蛋白含量的改变来发挥其抗肿瘤作用[18]。但在胰腺癌中无相关文献报道。
本研究组以往的研究发现,刺参黏多糖能抑制胰腺癌细胞的增殖,诱导其凋亡,并呈时间、剂量依赖性[3]。本实验结果显示,随着刺参黏多糖作用时间的延长, MST1 mRNA水平升高,YAP mRNA水平及蛋白表达水平均逐渐下降,而pYAP蛋白水平逐渐升高,表明刺参黏多糖能激活SW1990细胞Hippo信号通路,并促进YAP磷酸化,从而削弱了YAP作为癌基因的作用,抑制了下游基因的转录和胰腺癌细胞的增殖。
细胞凋亡主要有两种通路:一种是以Fas和TNFR为代表的死亡受体信号转导途径;另一种是以线粒体为核心的凋亡途径。伴随着线粒体膜电位的下降,线粒体内凋亡活性物质如Ca2+、细胞色素C的释放进而激活位于凋亡途径上游的Caspase-9,进一步诱导效应Caspase-3的活化,导致Caspase-3发生断裂,最终使细胞走向凋亡[19]。Survivin能直接或间接抑制Caspase依赖或Caspase非依赖的凋亡途径。Survivin与胰腺癌肿瘤大小、血管浸润、淋巴结转移有密切关系。Survivin基因沉默可以使胰腺癌细胞周期阻滞,促进细胞凋亡[20]。本研究结果显示,刺参黏多糖作用SW1990细胞后明显下调凋亡抑制基因Survivin mRNA和上调凋亡因子Caspase-9 mRNA,激发线粒体凋亡途径,从而促使胰腺癌细胞的凋亡。
综上所述,刺参黏多糖可以上调Hippo通路中主要效应因子MST的表达,使得YAP磷酸化增加,从而抑制其癌基因的作用,抑制胰腺癌细胞增殖。同时还可以抑制抑癌基因Survivin的表达,促进Caspase-9介导的细胞凋亡。这可能是刺参黏多糖对胰腺癌的抑制机制。
[1] 刘风仙,宋扬.刺参酸性黏多糖对宫颈癌HeLa细胞凋亡及Bax、Bcl-2基因表达的影响[J]. 实用医学杂志,2010,26(12):2089-2091.
[2] 孙希宝,王宝磊,刘家宏,等.刺参黏多糖诱导人肝癌细胞凋亡的实验研究[J]. 国际外科学杂志,2010,37(5):303-306.
[3] 薛魁金,田字彬,孔心涓,等. 刺参黏多糖对人胰腺癌细胞株SW1990增殖的抑制作用[J]. 中华胰腺病杂志, 2012,12(2):23-25.
[4] Halder G,Johnson RL.Hippo signaling:growth control and beyond[J]. Development,2011,138(1):9-22.
[5] Zhao B, Lei QY, Guan KL. The Hippo-YAP pathway:new connections between regulation of organ size and cancer[J]. Currt Opin Cell Biol,2008,20(6):638-646.
[6] Huang JB, Wu S, Barrera J, et al. The Hippo signaling pathway coordinately regulates cell proliferation and apoptosis by inactivating Yorkie, the Drosophila Homolog of YAP[J]. Cell,2005,122(3):421-434.
[7] Camargo FD, Gokhale S, Johnnidis JB, et al. YAP1 increases organ size and expands undifferentiated progenitor cells[J]. Curr Biol,2007,17(23):2054-2060.
[8] Harvey KF, Zhang X, Thomas DM. The Hippo pathway and human cancer[J].Nat Rev Cancer, 2013,13(4):246-257.
[9] Artemenko Y, Batsios P, Borleis J, et al. Tumor suppressor Hippo/MST1 kinase mediates chemotaxis by regulating spreading and adhesion[J]. Proc Natl Acad Sci U S A, 2012,109(34):13632-13637.
[10] Song H, Mak KK, Topol L, et al. Mammalian Mst1 and Mst2 kinases play essential roles in organ size control and tumor suppression[J]. Proc Natl Acad Sci U S A,2010,107(4):1431-1436.
[11] 陆克, 薛斌. 肝再生终止阶段的研究进展[J].世界华人消化志, 2012, 20(10): 837-845.
[12] Basu S, Totty NF, Sudol M, et al.Akt phosphorylates the Yes-associated protein,YAP,to induce interaction with 14-3-3 and attenuation of p73-mediated apoptosis[J].Mol cell,2003,11(1):11-23.
[13] Jianbin H, Shian W, Barrera J, et al. The Hippo signaling pathway coordinately regulates cell proliferation and apoptosis by inactivating Yorkie, the Drosophila Homolog of YAP[J].Cell,2005,122(3):421-434.
[14] Gao T, Zhou D, Yang C, et al. Hippo signaling regulates differentiation and maintenance in the exocrine pancreas[J]. Gastroenterology, 2013,144(7): 1543-1553.
[15] Li Z,Zhao B,Wang P, et al. Structural insights into the YAP and TEAD complex[J].Genes Dev,2010,24(3):235-240.
[16] 胡人杰,于苏萍,姜卉.刺参酸性黏多糖与可的松联用方案对小鼠肿瘤的抑制作用[J]. 癌症,1997,16(6):422.
[17] 彭玲,于壮,宋扬.刺参黏多糖对Hela细胞增殖分化的影响[J].青岛大学医学院学报, 2008,44(3):212-215.
[18] 孙希宝,王宝磊,刘家宏,等. 刺参黏多糖诱导人肝癌细胞凋亡的实验研究[J].国际外科学杂志,2010,37(5):303-306.
[19] Blanc C, Deveraux QL, Krajewski S, et al. Caspase-3 is essential for procaspase-9 processing and cisplatin-induced apoptosis of MCF-7 breast cancer cells[J]. Cancer Res, 2000, 60(16):4386-4390.
[20] 田维军,赵金伟,宋晓斌.RNAi沉默survivin基因对胰腺癌细胞增殖、凋亡和细胞周期的影响[J].中国老年学杂志,2010,30(2):214-216.
