QuEChERS-高效液相色谱-串联质谱法同时测定水果中21种植物生长调节剂的残留量
2014-08-03黄何何徐敦明吕美玲陈树宾王连珠
黄何何, 张 缙, 徐敦明*, 周 昱, 罗 佳,吕美玲, 陈树宾, 王连珠
(1.厦门出入境检验检疫局,福建 厦门361026;2.福建农林大学,福建 福州350002;3.安捷伦科技(中国)有限公司,北京100102;4.宁波出入境检验检疫局,浙江 宁波315000)
植物生长调节剂是一类具有植物激素活性,可影响植物生长发育的小分子化合物[1]。根据来源的不同,植物生长调节剂可分为天然植物激素和人工合成两种。按作用方式可分为生长促进剂、生长延缓剂和生长抑制剂。这类化合物在增强植物抗逆性、促进植物细胞分裂与生长、提高产量以及改善品质等方面发挥着重要的作用,为农业生产和发展做出了巨大的贡献。然而,随着科技与农业的发展,植物生长调节剂的种类越来越多,应用也日益广泛,盲目或过量使用的现象时有发生,影响到农产品的品质安全,对公众的健康造成了潜在的威胁。因此,针对植物生长调节剂各国制定了相应的最大残留限量(MRL)标准,如日本规定抗倒酯在苹果、西瓜中MRL为0.02 mg/kg,欧盟规定丁酰肼在苹果、西瓜中的MRL为0.02 mg/kg,中国规定氯吡脲在葡萄中的MRL为0.05 mg/kg,英国规定矮壮素在西瓜和葡萄中MRL为0.05 mg/kg等。
目前,国内外有关植物生长调节剂残留的检测方法主要有酶联免疫法(ELISA)[2,3]、气相色谱法(GC)[4-6]、气相色谱-质谱法(GC-MS)[7-11]、高效液相色 谱 法 (HPLC)[12-14]、液 相 色 谱-质 谱 法 (LCMS)[15-22]和离子色谱法(IC)[23]。采用 ELISA易产生假阳性,运用GC和GC-MS时通常要进行衍生化的复杂操作,HPLC的灵敏度较低且难以实现确证分析。液相色谱-串联质谱法(LC-MS/MS)具有高特异性和高灵敏度,是目前广泛应用的检测方法。国内外已有采用LC-MS/MS测定植物生长调节剂残留的报道,但这些报道所涉及的种类较少,不能满足国内外快速检测样品的要求。本文通过优化质谱参数和色谱条件,考察流动相、提取方法和基质效应等因素,建立了HPLC-MS/MS同时测定水果中21种植物生长调节剂残留的分析方法。
1 实验部分
1.1 仪器与试剂
Agilent 6460三重四极杆质谱,配Agilent 1290高效液相色谱仪(美国Agilent),Agilent Jet Stream电喷雾离子源(AJS ESI);IKA T18 Basic均质器(德国IKA);离心机(上海安亭科学仪器厂);固相萃取装置(美国Supelco);氮吹仪(美国Caliper);涡旋混匀器(IKA3 Basic,德国IKA);Milli Q超纯水系统(美国 Millipore)。
乙腈和甲醇(色谱纯,德国Merck);甲酸(色谱纯,美国Fluka),乙酸铵(色谱纯,美国TEDIA),乙酸和氢氧化钠为分析纯;实验用水符合GB/T6682规定要求。21种植物生长调节剂标准品:氯化胆碱(choline chloride)、矮壮素(chlormequat chloride)、助壮素(mepiquat chloride)、丁酰肼(daminozide)、赤霉素(gibberellic acid,GA3)、6-苄氨基嘌呤(6-benzylaminopurine,6-BA)、吲 哚-3-乙 酸 (indol-3-ylacetic acid,IAA)、脱落酸(abscisic acid,ABA)、1-萘乙酸(1-naphthaleneacetic acid,NAA)、噻苯隆(thidiazuron)、2,4-D、调果酸(cloprop)、2,3,5-三碘苯甲酸(2,3,5-triiodobenzoic acid,TIBA)、对氯苯氧乙酸(4-chlorophenoxyacetic acid,4-CPA)、氯吡脲(forchlorfenuron)、环丙酸酰胺(cyclanilide)、抗倒胺(inabenfide)、抗倒酯(trinexapac-ethyl)、多效唑(paclobutrazol)、烯效唑(uniconazole)和抑芽唑(triapenthenol)(纯度均大于96%,德国 Dr.Ehrenstorfer)。
称取适量标准品,分别用甲醇配制成100 mg/L的储备液并储存在-4℃冰箱中。根据实验需要用乙腈稀释标准储备液,配成适当浓度的标准工作溶液。
1.2 样品前处理
称取10.00 g(精确至0.01 g)样品于50 mL离心管中,加入10 mL含1%(v/v)乙酸的乙腈溶液,匀浆2 min后,加入脱水试剂(4 g无水硫酸镁和1.5 g醋酸钠),涡旋振荡1 min,以4 000 r/min离心3 min,取2.0 mL上清液于分散固相萃取管(25mg C18和150 mg无水硫酸镁)中,涡旋混匀1 min后于16 000 r/min速率下离心5 min,所得上清液经0.22μm有机滤膜过滤后,待测定。
1.3 HPLC-MS/MS条件
色谱柱:Agilent XDB-C18(150 mm×4.6 mm,5μm)。流动相A:5 mmol/L乙酸铵-0.05%(v/v)甲酸水;流动相B:乙腈;梯度洗脱程序:0~2 min,5%B;2~12 min,5%B~80%B;12~18 min,80%B;18.1 min,5%B;18.1~24 min,5%B。流速:0.5 mL/min;柱温:35 ℃;进样量:5μL。采用AJS ESI源,正离子、负离子分段多反应监测模式(MRM)检测(其中第1段:0~5 min,正离子扫描;第2段:5~13 min,负离子扫描;第3段,13~24 min,正离子扫描)。雾化气压力:310.3 kPa;喷嘴电压:500 V;干燥气温度与流速:300℃,10 L/min;鞘气温度与流速:375℃,11 L/min;毛细管电压:4 000 V。21种植物生长调节剂的定量和定性离子、碰撞能量和碎裂电压等参数见表1。
2 结果与讨论
2.1 质谱条件优化
使用单针自动进样分析目标化合物的标准溶液,优化21种植物生长调节剂的质谱条件。化合物进入一级质谱后,可产生稳定的[M+H]+离子或[M-H]-离子。其中6-苄氨基嘌呤、噻苯隆、氯吡脲和抗倒胺可产生[M+H]+离子,也可以形成稳定的[M-H]-离子,在综合考虑灵敏度与分段扫描等因素后,最终选用6-苄氨基嘌呤、噻苯隆和氯吡脲的[M-H]-离子为母离子,抗倒胺的[M+H]+离子为母离子;确定了化合物母离子后,在SIM模式下,对化合物的Fragmentor(碎裂电压)进行优化;母离子进入二级质谱,发生断裂或重排等反应产生不同的离子碎片。在Product Ion模式下,对化合物母离子施加一定量的碰撞能量(CE),得到其相应的离子碎片;最后在MRM模式下,优化目标物离子碎片的最佳碰撞能量。21种植物生长调节剂的二级离子质谱图见图1,MRM色谱图见图2。
2.2 色谱条件优化
实验对比了Thermo Accucore-C18(100 mm×2.1 mm,2.6μm)、Phenomenex Kinetex-C18(100 mm×2.1 mm,2.6μm)和 Agilent XDB-C18(150 mm×4.6 mm,5μm)色谱柱对待测物分离的效果。由于21种待测物的极性差异较大,极性较强的丁酰肼、矮壮素、助壮素和氯化胆碱在反相色谱柱上的保留较弱,且在 Thermo Accucore-C18和Phenomenex Kinetex-C18的保留时间均小于2 min,而在Agilent XDB-C18柱上的保留大于2.5 min。因此,选取了Agilent XDB-C18色谱柱来分析待测物。
分析物的测定采用正离子和负离子模式,本研究采用的质谱仪毛细管支持正负模式快速切换。试验比较了分段与不分段对待测分析物灵敏度的影响,如图3所示,采用分段的方法分析物的分离度与峰形较好,同时也提高了大部分待测分析物的灵敏度。因此,本研究通过对流动相与洗脱梯度的优化后,以不同的离子扫描模式将分析监测过程分为3段。
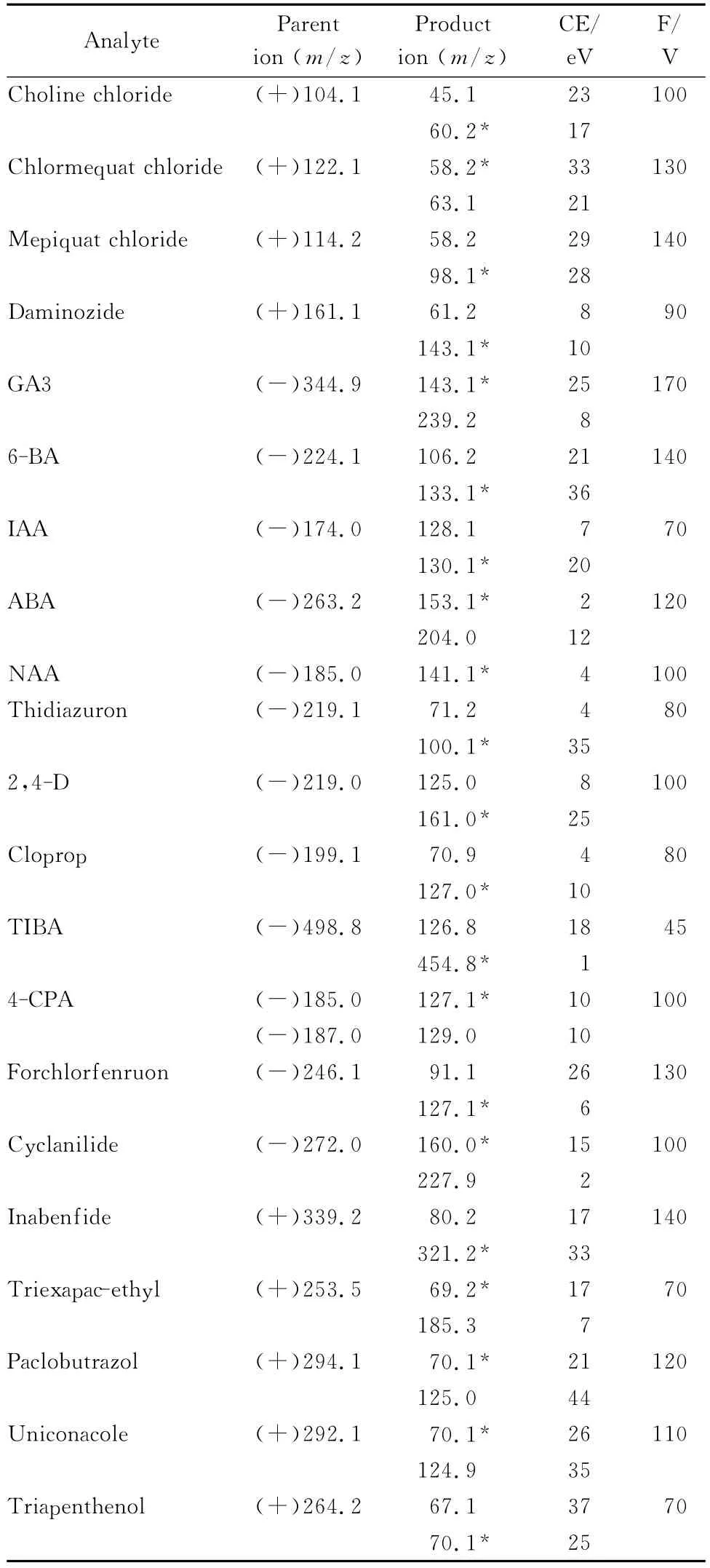
表1 21种植物生长调节剂的质谱分析参数Table 1 MS/MS parameters of the 21 plant growth regulators

图1 21种植物生长调节剂的二级离子质谱图Fig.1 MS/MS spectra of the 21 plant growth regulators
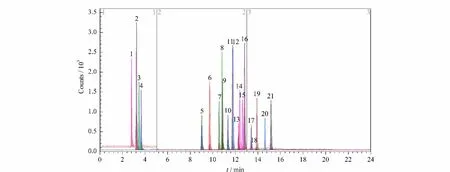
图2 21种植物生长调节剂的MRM色谱图Fig.2 MRM chromatograms of the 21 plant growth regulators
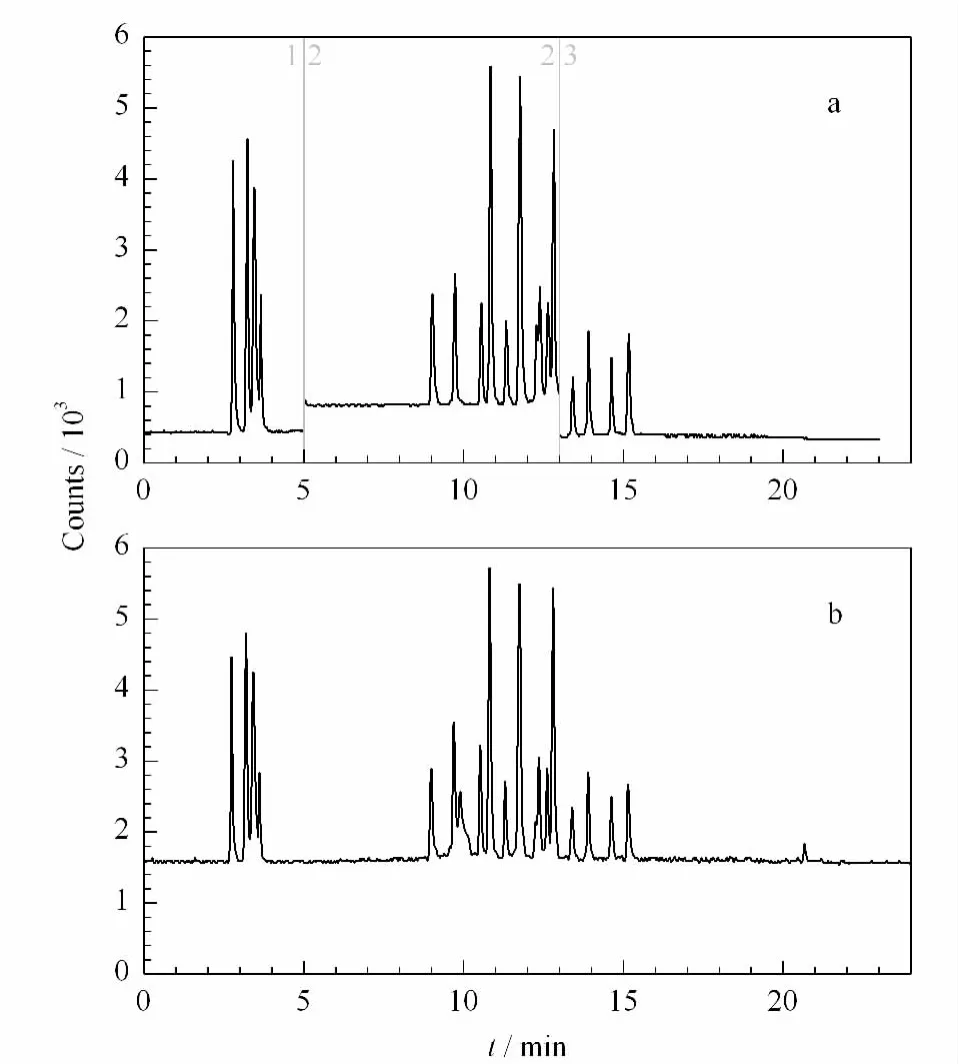
图3 分段采集模式和正负离子快速切换模式对化合物分离效果的影响Fig.3 Effect of separation of compounds in segment mode and quick swiching mode a.segment mode;b.quick swiching mode.
液相色谱-质谱分析中有机相通常使用乙腈,水相常使用甲酸水溶液、乙酸铵水溶液或甲酸-乙酸铵水溶液。通过试验对比,使用同时含5 mmol/L乙酸铵和0.05%(v/v)甲酸时,待测物的分离度和峰形都比较好。因此,本文选择流动相水相为含5 mmol/L乙酸铵和0.05%(v/v)甲酸的水溶液,有机相为乙腈。
2.3 提取溶剂的选择
根据现有的文献方法,结合目标化合物的性质,试验比较了乙腈、含1%(v/v)乙酸的乙腈、2%(v/v)乙酸乙腈和含1%(v/v)1 mol/L NaOH 的乙腈溶液4种不同提取溶剂对21种植物生长调节剂的提取效果,结果见图4。从试验结果可以看出,当提取溶剂为1%(v/v)乙酸乙腈时,21种目标物的回收率均大于80%。其中,氯化胆碱、氯吡脲、抗倒胺、抑芽唑和抗倒酯在采用不同的提取溶剂时均有较高回收,而三碘苯甲酸、赤霉素、环丙酸酰胺、脱落酸、2,4-D、调果酸、对氯苯氧乙酸、1-萘乙酸和吲哚-3-乙酸因结构中均含有羧基,在酸化乙腈条件下,萃取效率较高。这是由于酸性条件抑制了羧基在溶液中电离成离子形态,从而提高了回收率。因此,综合各物质的提取效率,选择1%(v/v)乙酸乙腈作为本研究的提取溶剂。
2.4 净化条件的优化
分散固相萃取技术具有快速、高效等优点,被广泛运用于残留检测的前处理中。它主要通过非极性相互作用、极性相互作用、离子相互作用等选择性地保留基质干扰成分,进而达到净化的效果。N-丙基乙二胺(PSA)、C18和石墨化炭黑(GCB)是常用的吸附剂材料。PSA吸附剂在硅胶上键合了乙二胺-N-丙基官能团,主要作用力是极性相互作用及弱阴离子交换作用,可有效去除样品中的有机酸、脂肪酸和糖等干扰物,但对分子结构中带有羧基的化合物有一定的保留作用;C18吸附剂在硅胶上键合了十八烷基官能团,产生强非极性相互作用,对极性较弱的脂肪酸、烯烃类及甾醇类、色素等大分子基质干扰物有较好的吸附效果;GCB吸附剂对去除叶绿素、类胡萝卜素等色素以及固醇类杂质有很好的效果,但对具有平面结构的化合物有很大的吸附作用。
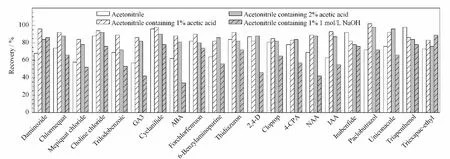
图4 21种植物生长调节剂在采用不同提取溶剂时的提取效率Fig.4 Extraction efficiencies of the 21 plant growth regulators with different solvents
试验比较了 MgSO4+PSA、MgSO4+C18、Mg-SO4+PSA+C18和MgSO4+PSA+GCB的净化效果,结果见图5。在使用含有PSA的净化材料时,极性较强的化合物(丁酰肼、矮壮素、助壮素和氯化胆碱)和含羧酸结构的化合物(三碘苯甲酸、赤霉素、环丙酸酰胺、脱落酸、2,4-D、调果酸、对氯苯氧乙酸、1-萘乙酸和吲哚-3-乙酸)被吸附,回收率均低于30%;氯吡脲、抗倒胺、多效唑、烯效唑和抑芽唑在MgSO4+PSA、MgSO4+C18和 MgSO4+PSA+C18 3种净化条件下有较高的回收率,均大于75%。但净化材料中含有GCB时,其回收率明显降低,表明GCB对目标化合物有一定的吸附作用。采用MgSO4+C18作为净化剂时,21种目标化合物的回收率均高于75%,因此最终选其为本研究的净化材料。
2.5 基质效应、线性范围、检出限和定量限
基质效应是在提取基质中的目标物时,基质中的干扰物影响目标化合物的离子化,使得目标化合物在仪器上的响应发生了增强或者抑制的现象。为提高目标化合物的测定准确度,需要对不同基质产生的基质效应做出评价,并选择合适的方法减小基质效应的干扰[24]。本研究采用相对响应值法(基质效应=空白基质标准响应值/纯溶剂标准响应值×100%,基质效应大于1时,表现为基质增强效应;基质效应小于1时,为基质抑制效应)评价了21种植物生长调节剂在不同水果中的基质效应,见表2。结果显示,51%的基质效应值超出80%~120%,因此基质效应不可忽略。
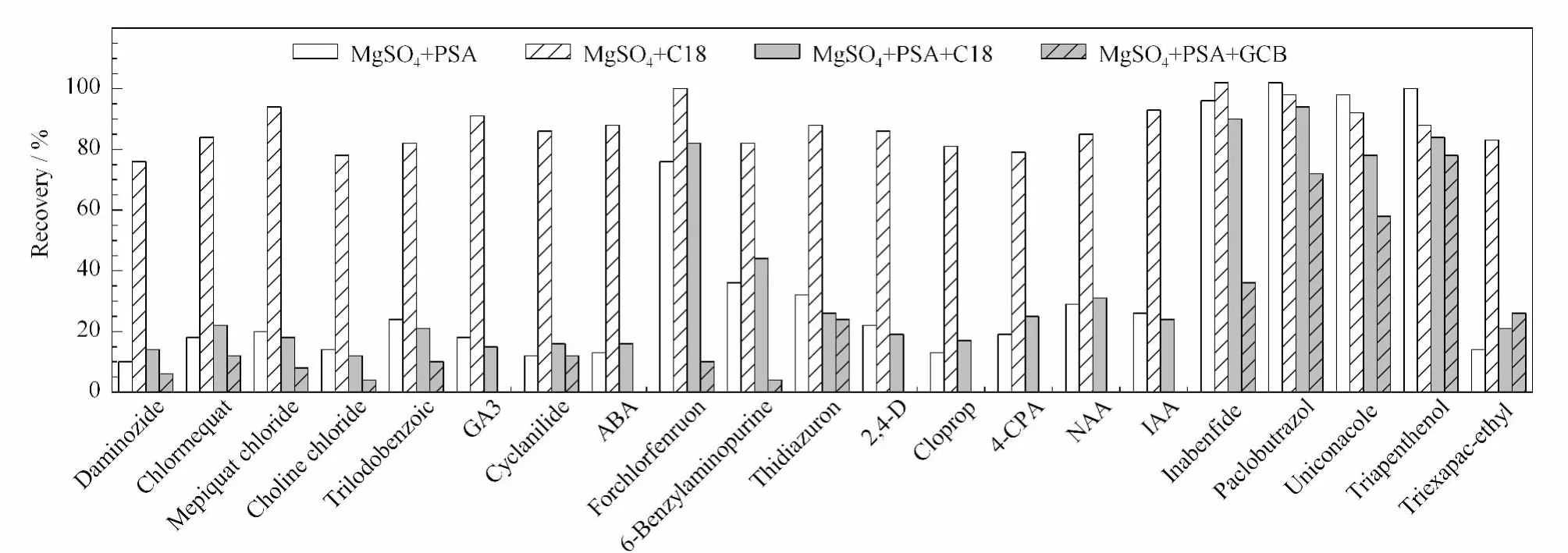
图5 21种植物生长调节剂在不同净化方法中的回收率Fig.5 Recoveries of the 21 plant growth regulators with different purification methods
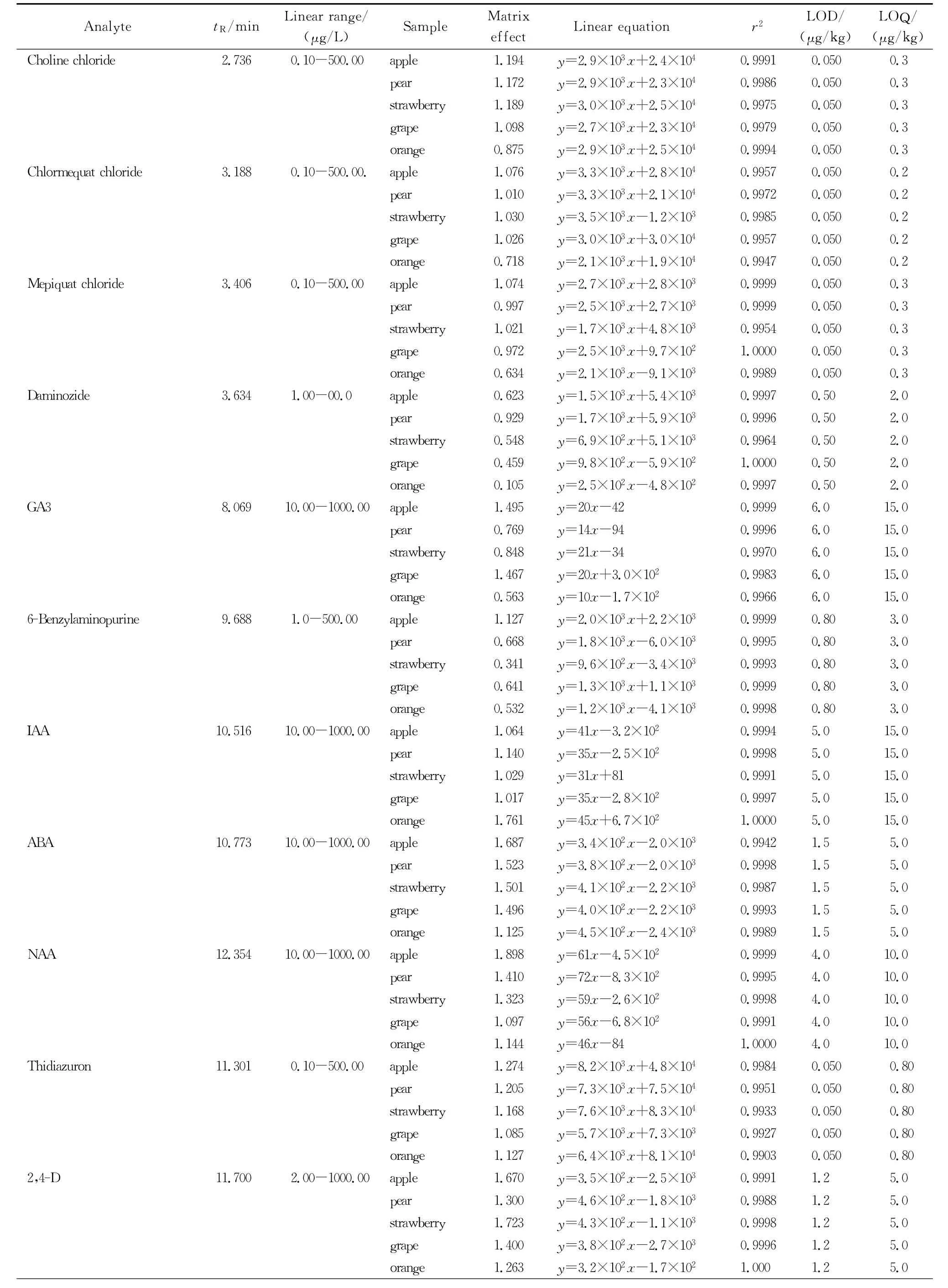
表2 21种植物生长调节剂的保留时间、基质效应、在基质中的线性关系、检出限和定量限Table 2 Retention times,matrix effects,linear relationships in matrixes,LODs and LOQs of the the 21 plant growth regulators
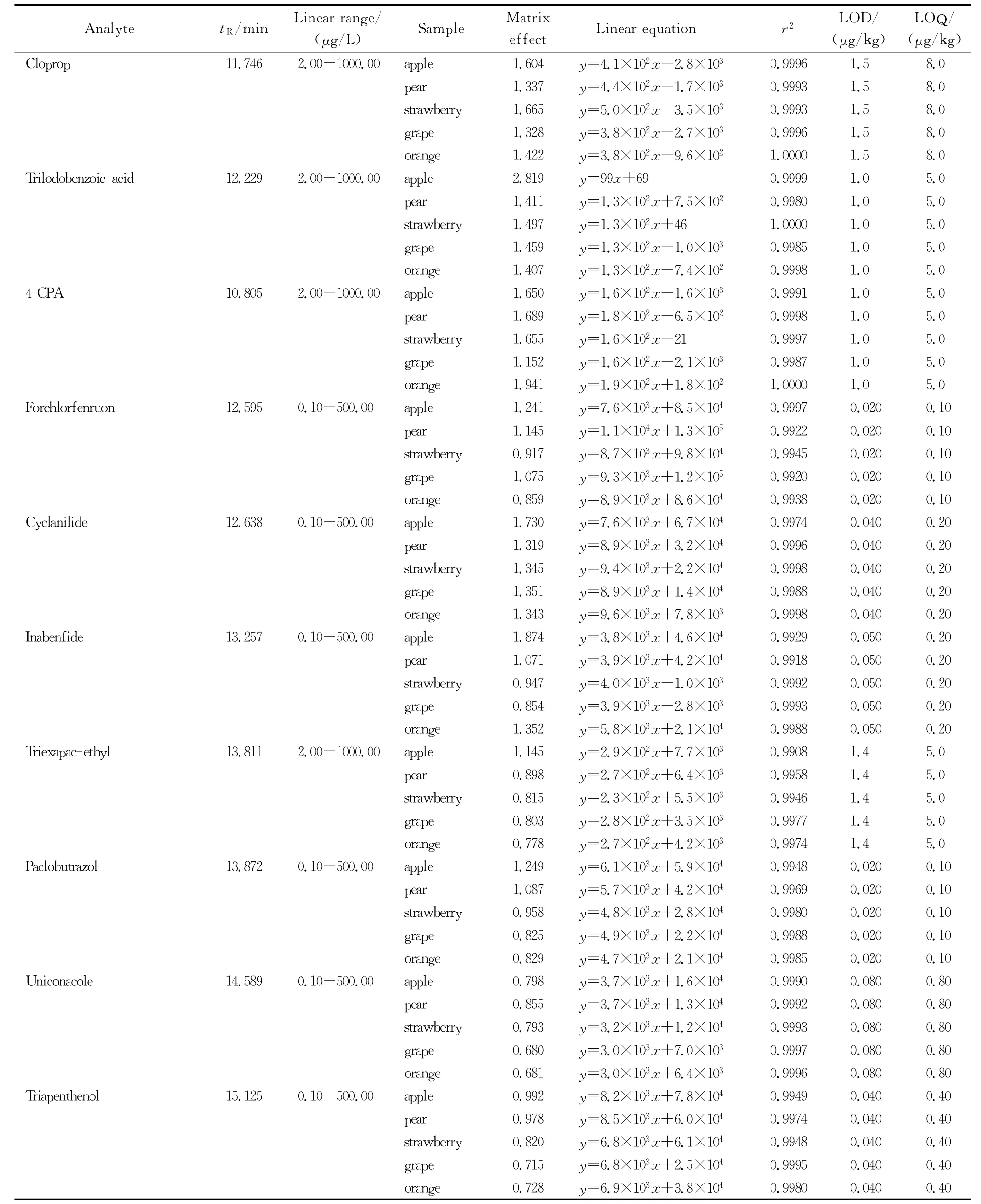
表2 (续)Table 2 (Continued)
为提高定量的准确度和可靠性,本研究采用空白基质添加不同浓度的目标化合物混合标准溶液,在已优化的色谱与质谱条件下,以质量浓度为横坐标(x),定量离子的峰面积为纵坐标(y)绘制标准曲线,并计算各目标化合物线性回归方程及其相关系数。21种植物生长调节剂的保留时间以及线性范围、基质效应、线性方程、相关系数、方法的检出限(信噪比(S/N)≥3))和定量限(S/N≥10)见表2。结果表明,各目标化合物在基质中的线性关系良好,方法的检出限和定量限远低于当前各国现行残留限量标准。
2.6 准确度和精密度
选用不含目标化合物的苹果、梨、草莓、葡萄和柑橘等空白样品,通过添加回收试验,考察了方法的准确度和精密度(n=6)。丁酰肼、矮壮素、助壮素、氯化胆碱、环丙酸酰胺、氯吡脲、6-苄氨基嘌呤、噻苯隆、抗倒胺、多效唑、烯效唑和抑芽唑的添加水平为0.005 0、0.010和0.020 mg/kg,三碘苯甲酸、赤霉素、脱落酸、2,4-D、调果酸、对氯苯氧乙酸、1-萘乙酸、吲哚-3-乙酸和抗倒酯的添加水平为 0.020、0.050和0.10 mg/kg,添加回收试验结果见表3。结果表明,21种植物生长调节剂的平均加标回收率范围为73.0%~111.0%,RSD在3.0%~17.2%之间,方法的准确度和精密度均符合残留分析要求。
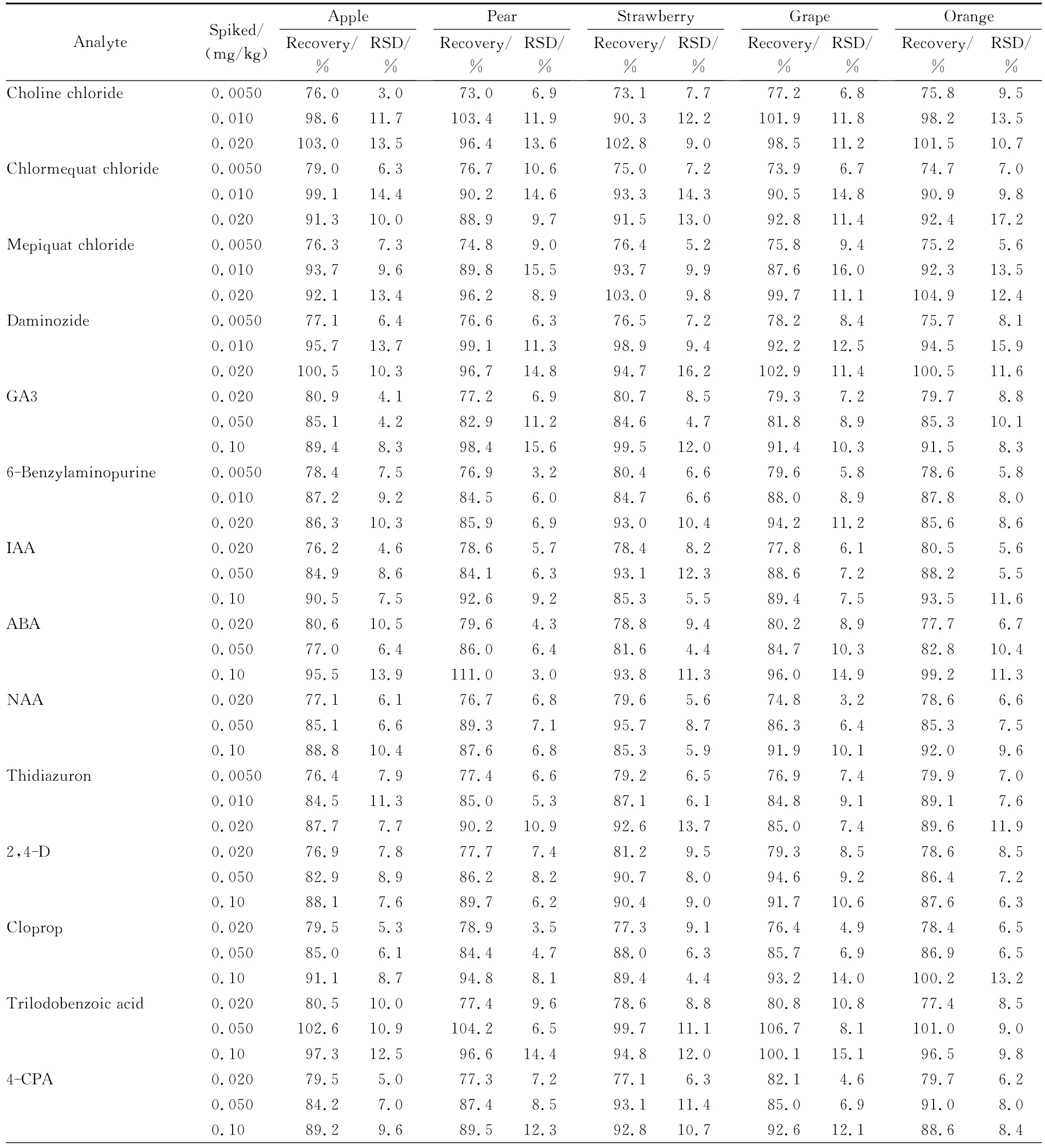
表3 21种植物生长调节剂在水果基质中的添加回收率和相对标准偏差(RSD)(n=6)Table 3 Spiked recoveries and relative standard deviations(RSDs)of the 21 plant growth regulators in fruits(n=6)
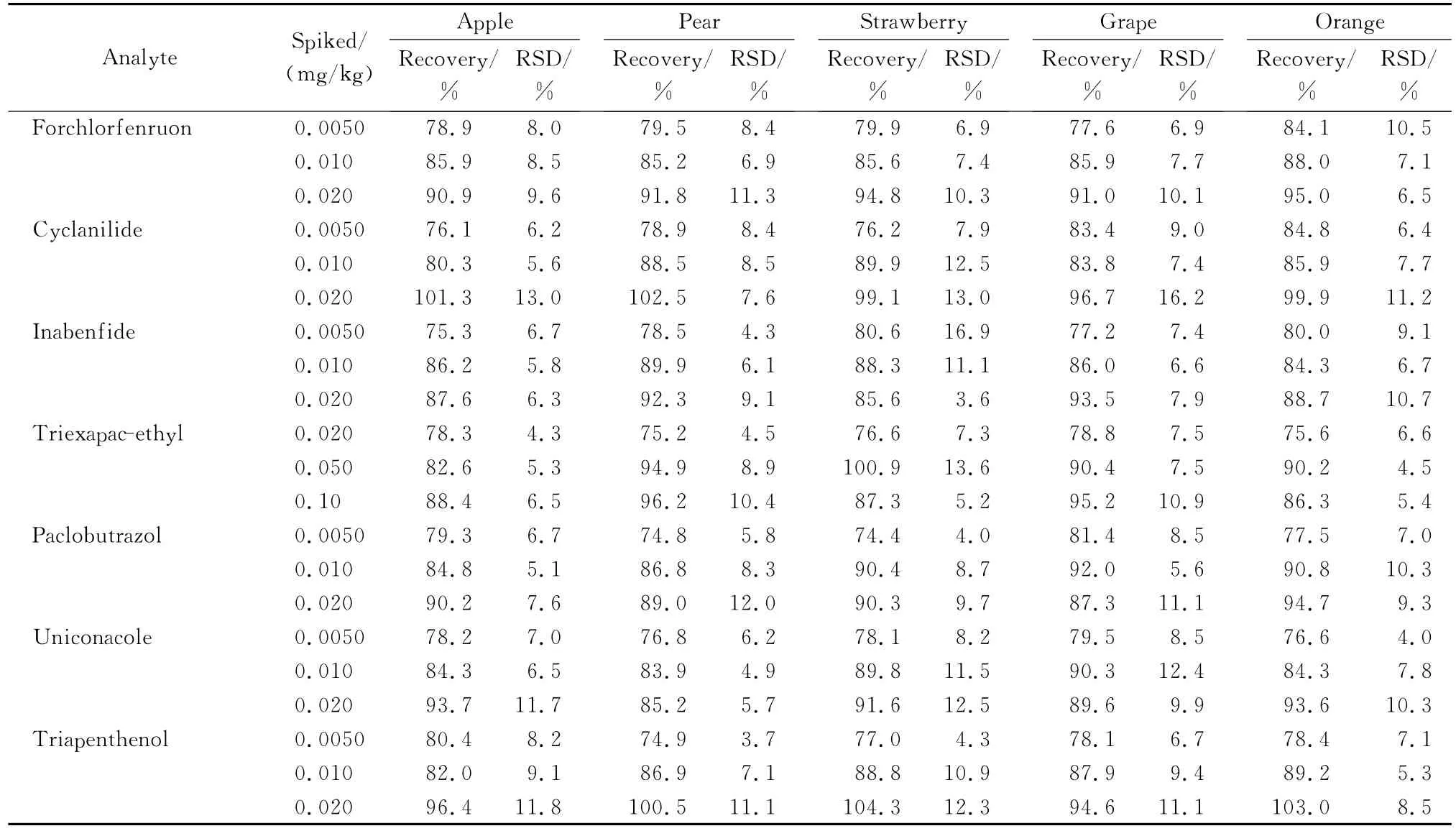
表3 (续)Table 3 (Continued)
3 小结
本文通过优化色谱条件和质谱条件,考察提取和净化方法,建立了 QuEChERS-HPLC-MS/MS测定水果中21种植物生长调节剂的分析方法。该方法前处理简单、灵敏度高,线性关系、准确度和精密度等均满足方法学指标,方法定量限均能满足各国的限量要求,能够满足水果中21种植物生长调节剂的残留分析,有效地提高了检测速度和检测通量。
[1] Giannakoula A E,Ilias I F,Dragisic Maksimovic J J,et al.J Food Compos Anal,2012,28(1):46
[2] Li L,Tian S L.Journal of Anhui Agricutural Science(李莉,田士林.安徽农业科学),2007,35(23):7098
[3] Wu S R,Chen W F,Zhou X.Plant Physiology Communications(吴颂如,陈婉芬,周燮.植物生理学通讯),1988(5):53
[4] Santos-Delgado M J,Crespo-Corral E,Polo-Diez L M.Talanta,2000,53(2):367
[5] Zhou Y M,Fu T,Hu R.Food Science(周艳明,付婷,胡睿.食品科学),2010,31(12):178
[6] Jia J,Wang X Y,Yang T Z.Chemical Engineer(贾建,王晓云,杨天祝.化学工程师),2004,18(7):57
[7] Song Y,Zhang Y H,Huang X,et al.Chinese Journal of Analytical Chemistry(宋莹,张耀海,黄霞,等.分析化学),2011,39(8):1270
[8] Xu Y H,Jiang S,Fu H B,et al.Agrochemicals(徐宜宏,蒋施,付海滨,等.农药),2014,53(2):113
[9] Zhao Y X,Song G L,Zhang J,et al.Chinese Journal of Health Laboratory Technology(赵永信,宋国良,张晶,等.中国卫生检验杂志),2008,18(6):1064
[10] Kuang K,Zhao J L,Ying G G,et al.Journal of Instrumental Analysis(匡科,赵建亮,应光国,等.分析测试学报),2008,27(8):816
[11] LüY,Zhao J,Yang T,et al.China Measurement and Test(吕燕,赵健,杨挺,等.中国测试),2010,36(4):57
[12] Lu Y M,Yi G B,Chen C B,et al.Journal of Instrumental A-nalysis(陆益民,易国斌,陈创彬,等.分析测试学报),2011,30(2):186
[13] Zhang Y,Lu Y,Yang T,et al.Journal of Analytical Science(张莹,鹿毅,杨涛,等.分析科学学报),2012,28(5):629
[14] Zhou J K,Xu P,Yang D X,et al.China Condiment(周建科,徐鹏,杨冬霞,等.中国调味品),2011,36(3):99
[15] Dong S Y,Hu Q,Li J,et al.Chinese Journal of Analysis Laboratory(董社英,胡清,李靖,等.分析试验室),2013,32(8):48
[16] Mol H G J,Van Dam R C J,Vreeken R J,et al.J Chromatogr A,1999,833(1):53
[17] Esparza X,Moyano E,Galceran M T.J Chromatogr A,2009,1216:4402
[18] Riediker S,Obrist H,Varga N,et al.J Chromatogr A,2002,966(1):15
[19] Ma L Y,Zhang H Y,Xu W T,et al.Food Anal Methods,2013,6(3):941
[20] Mou Y L,Guo D H,Ding Z P.Chinese Journal of Chromatography(牟艳莉,郭德华,丁卓平.色谱),2013,31(10):1016
[21] Zhang J,Du P.Chinese Journal of Chromatography(张军,杜平.色谱),2011,29(11):1133
[22] Xie W,Shi Y Z,Hou J B,et al.Chinese Journal of Chromatography(谢文,史颖珠,侯建波,等.色谱),2014,32(2):179
[23] Zhou X,Xu J G,Chen Z D,et al.Chinese Journal of Chromatography(周旭,许锦钢,陈智栋,等.色谱),2011,29(3):244
[24] Huang B Y,Xiao Z Y,Chen D,et al.Pesticide Science and Administration(黄宝勇,肖志勇,陈丹,等.农药科学与管理),2010,31(3):39
