超高效液相色谱-三重四极杆质谱法快速同时测定牛奶中53种β-内酰胺类抗生素及其代谢产物的残留
2014-08-03张秀尧蔡欣欣
张秀尧, 蔡欣欣
(温州市疾病预防控制中心,浙江 温州325001)
β-内酰胺类抗生素主要有青霉素类和头孢菌素类,是目前治疗奶牛乳腺炎的首选药物,为牛奶中最为常见的抗生素残留之一。经常饮用含有抗生素残留的牛奶可引起敏感人群过敏,还会诱导产生耐药菌株,给人类健康带来潜在的危害。青霉素类抗生素在生物体内代谢,或在β-内酰胺酶的作用下内酰胺环打开生成各自的青霉噻唑酸(penicilloic acid),氨苄西林和阿莫西林还可产生氨苄西林哌嗪-2′,5′-二酮(ampicillin piperazine-2′,5′-dione)和阿莫西林哌 嗪-2′,5′-二 酮 (amoxicillin piperazine-2′,5′-dione)(见图1)。这些分解产物是青霉素类药物引起过敏反应的主要成分[1],在牛奶加工生产过程中青霉素类抗生素也会分解产生这些化合物[2],已有使用一些生物制剂如β-内酰胺酶等分解牛奶中残留的抗生素生产人造“无抗奶”的现象[3,4]。目前牛奶中β-内酰胺类抗生素残留的检测方法大都是测定原药残留[5-9],这些方法不能测定青霉素类药物的代谢产物,有一定的局限性。
有文献[10-12]报道利用LC-MS/MS测定动物组织中阿莫西林及其主要代谢产物阿莫西林青霉噻唑酸(amoxycilloic acid)和阿莫西林哌嗪-2′,5′-二酮,以及测定牛奶和奶粉中4种青霉素及其β-内酰胺酶酶解产物(青霉素G脱羧噻唑酸、青霉素V脱羧噻唑酸、阿莫西林脱羧噻唑酸、氨苄西林脱羧噻唑酸)的残留。但系统地检测牛奶中β-内酰胺类抗生素原药及其代谢产物的残留还未见报道。基于上述原因,我们建立了快速检测牛奶中53种β-内酰胺类抗生素及其代谢产物残留的超高效液相色谱-串联质谱法,方法简单、快速、灵敏,应用于实际样品的监测,取得了满意的结果。

图1 青霉素类酶解反应Fig.1 Enzymic hydrolysis reaction of penicillins
1 实验部分
1.1 仪器与试剂
Acquity UPLC-Quattro Premier XE超高效液相色谱-串联质谱仪,Masslynx 4.1工作站(美国Waters公司);MR32i大容量高速冷冻离心机(法国Jouan公司);TGL-16C高速台式离心机(上海安亭科学仪器厂);N-EVAP氮吹仪(12孔,美国Organomation公司);2510超声波清洗机(美国Branson公司);10 mL聚全氟乙丙烯(FEP)圆底旋盖离心管(美国 Nalgene公司);Amicon Ultra-0.5 mL离心超滤管,截止相对分子质量3 kDa(法国Millipore公司);Gradient A10 Mill-Q超纯水器(法国Millipore公司);Distriman连续加液器(125μL~12.5 mL,法国Gilson公司)。
乙腈为HPLC级(德国 Merck公司);甲酸为HPLC级(美国 Tedia公司);β-内酰胺酶I(TEM1,1.0×107u/瓶,杭州北望生物技术有限公司)
双氯西林钠盐(98%(纯度,下同))、氨苄西林(99.5%)、氯 唑 西 林 (98.5%)、苯 唑 西 林 钠 盐(98.0%)、阿莫西林(98.5%)、美西林(90.0%)、头孢喹肟(95.0%)、头孢匹罗(97.0%)、乙氧萘西林钠盐(93.0%)和头孢噻呋(86.0%)标准品购自德国Dr.Ehrenstorfer公司;甲氧西林钠盐(≥85%)、阿扑西林(97.2%)、青霉素 G钾盐(99.8%)和青霉素V钾盐(99.8%)标准品购自Sigma公司;替卡西林购自英国Apolloscientific公司;头孢匹林(93.3%)为美国药典标准物质;阿洛西林、美洛西林、哌拉西林、氟 氯 西 林、头 孢 氨 苄 (94.2%)、头 孢 哌 酮(96.5%)、头孢唑啉(99.3%)、头孢拉定(91.8%)、头孢羟氨苄(95.0%)、头孢曲松(84.1%)、头孢克洛(93.2%)、头孢他啶(84.2%)、头孢地尼(98.3%)、头孢克肟(85.4%)、头孢米诺(77.4%)、头孢替唑(90.0%)、头孢地嗪(88.6%)、头孢硫脒(95.7%)、头孢吡肟(83.0%)和美罗培南(87.2%)均为化学对照品,购自中国生物制品检定所。以上标准物质分别用乙腈-水(1∶1,如无特殊说明均为体积比)配制成1.0 g/L标准贮备溶液;然后将20种头孢菌素类配制成混合标准贮备液(50 mg/L),将17种青霉素类稀释成混合标准贮备液(50 mg/L)。
磺胺甲噁唑-d4,购自Toronto Research Chemicals Inc.公司,用乙腈配制成1.0 g/L标准贮备溶液,再稀释成1.0 mg/L的内标使用液。
19种青霉素类酶解产物的制备:吸取500μL 17种青霉素类混合标准贮备液于10 mL具塞离心管中,40℃水浴中以氮气吹去乙腈,再加水至1.0 mL,然后加入 30μLβ-内酰胺酶 I(1.0×107u/mL),室温振荡反应40 min,加入乙腈至5 mL,混匀,即为青霉素类酶解产物的标准贮备溶液。此标准溶液含有17种青霉噻唑酸、氨苄西林哌嗪-2′,5′-二酮和阿莫西林哌嗪-2′,5′-二酮,氨苄西林噻唑酸和氨 苄西林哌 嗪-2′,5′-二 酮 质 量 浓 度 之 和 为 5 mg/L(以氨苄西林计),阿莫西林噻唑酸和阿莫西林哌嗪-2′,5′-二酮的质量浓度之和也为5 mg/L(以阿莫西林计),其余15种青霉噻唑酸均为5 mg/L(以原药计)。
临用时将17种青霉素类、20种头孢菌素类和19种青霉素类酶解产物的标准储备液按适当的比例混合得到混合标准使用液,各物质终质量浓度为2.0 mg/L。
1.2 样品前处理方法
取2.00 g牛奶置于10 mL FEP圆底旋盖离心管中,加入20μL 1.0 mg/L的内标物,再加入2.0 mL乙腈并涡旋30 s,超声5 min,然后以12 000 r/min离心5 min,取500μL上清液于超滤管中以14 000 r/min(14 875 g)离心10 min,超滤液于40℃下用氮气吹至约100μL,加水100μL,旋涡混匀,以16 000 r/min离心5 min,上清液待测。
在6个各含2.00 g空白牛奶的离心管中分别按标准曲线的浓度加入适量混合标准使用液,混匀,放置30 min,加入20μL1.0 mg/L内标液,与样品一起处理,制作工作曲线。
1.3 色谱-质谱条件
色谱柱:ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7μm),VanGuard BEH C18保护柱(5 mm×2.1 mm,1.7μm)(美国 Waters公司);流动相为0.1%甲酸水液(A)和0.1%甲酸乙腈溶液(B)。梯度洗脱程序:0~0.50 min,5%B;0.50~5.00 min,5%B~35%B;5.00~7.00 min,35%B~65%B;7.00~7.10 min,65%B~95%B;7.10~8.00 min,95%B;8.00~8.10 min,95%B~5%B;8.10~10.00 min,5%B。流速:0.400 mL/min;柱温:45℃;样品室温度:5℃;进样体积:10μL。
电喷雾离子源正离子多反应监测(MRM)模式。ESI+毛细管电压:3.30 kV;离子源温度:130℃;脱溶剂温度:380℃;脱溶剂气流量:750 L/h;锥孔反吹气流量:50 L/h;碰撞室氩气压力:0.346 Pa。其他质谱参数详见表1。
运行开始时,色谱柱流出液经六通切换阀切换至废液中直到1.10 min,质谱从1.10 min开始采集数据至7.30 min结束,同时六通切换阀又将柱流出液切换至废液中。
2 结果与讨论
2.1 标准溶液的制备
试验发现青霉素类标准物质若用甲醇配制会很快反应生成各自的青霉噻唑酸甲酯;头孢菌素类用甲醇配制即使在-20℃下保存,稳定期也只有数周。故所有标准物质均采用乙腈或乙腈-水混合液配制,-20℃下保存。此条件下至少可稳定储存6个月。
青霉素类药物青霉噻唑酸未见标准物质出售,只得用β-内酰胺酶酶解制备,酶解反应时间由UPLC-MS/MS分析至原药色谱峰完全消失来确定。在本试验条件下,40 min酶解反应完全,此时各青霉噻唑酸为单个色谱峰;随着酶解时间延长青霉噻唑酸会在5位消旋化成一对手性异构体,在色谱上表现为两个相近的色谱峰[13,14]。阿莫西林和氨苄西林酶解时除生成噻唑酸外,还会生成各自的哌嗪-2′,5′-二酮。酶解反应完全后加入高比例的乙腈使β-内酰胺酶变性失活,从而终止反应。
分离制备了青霉素类药物的β-内酰胺酶酶解产物,但制备得到的酶解产物配制成溶液后非常不稳定,保存期很短。故采用17种青霉素类混合标准贮备液临用时酶解制备19种青霉素类酶解产物的标准溶液。
2.2 质谱条件的优化
原药溶液(2.0 mg/L)直接用注射泵进样优化;酶解产物则先将单个原药酶解,用乙腈稀释成2.0mg/L,再用注射泵进样优化。
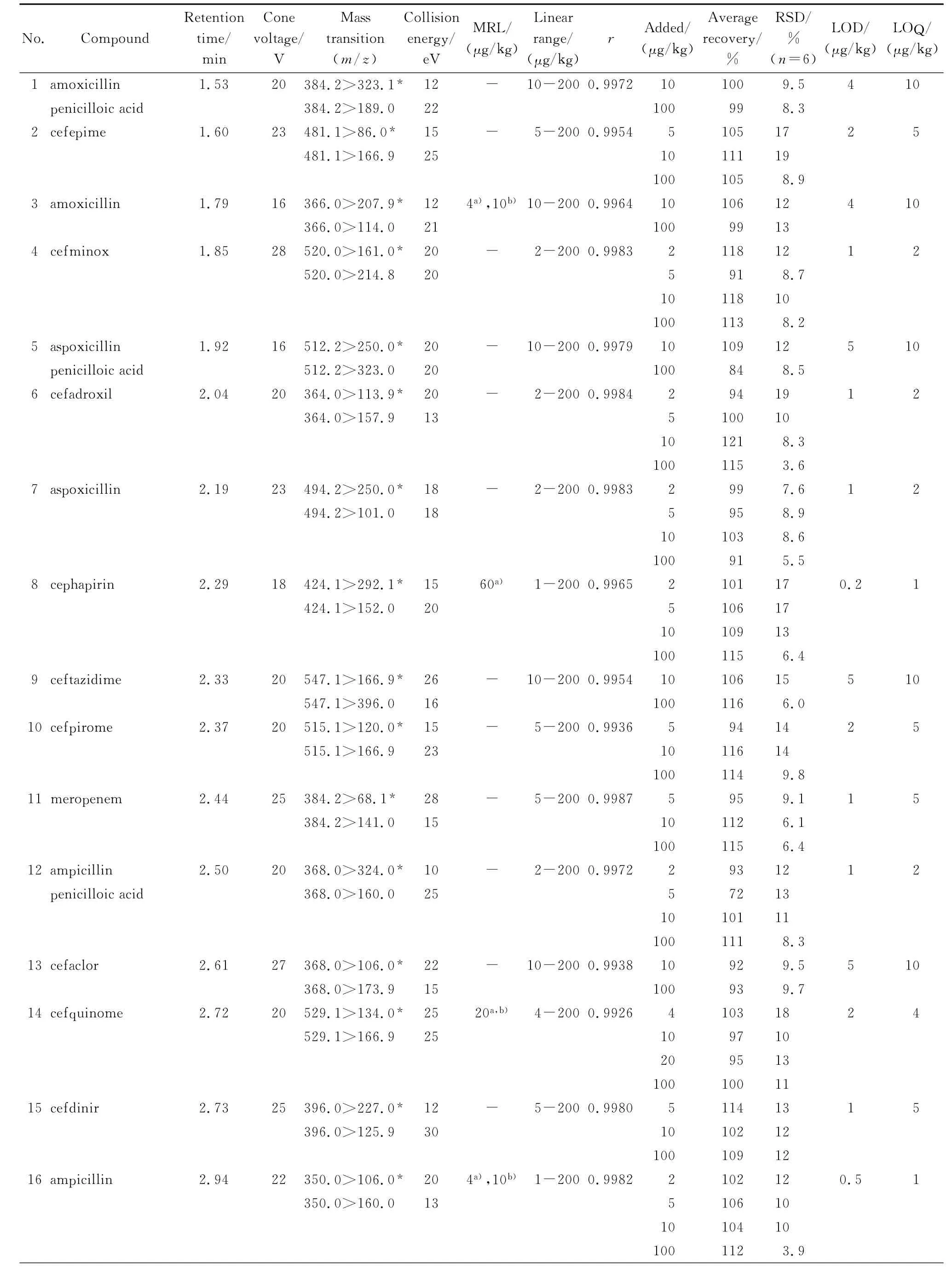
表1 53种β-内酰胺类抗生素的多反应监测质谱参数、保留时间、线性范围、相关系数(r)、加标回收率、相对标准偏差、最高允许限量、检出限和定量限Table 1 MRM parameters,retention times,linearity ranges,correlation coefficients(r),spiked recoveries,relative standard deviations,maximum residue levels(MRLs),LODs and LOQs of the 53β-lactams

表1 (续)Table 1 (Continued)
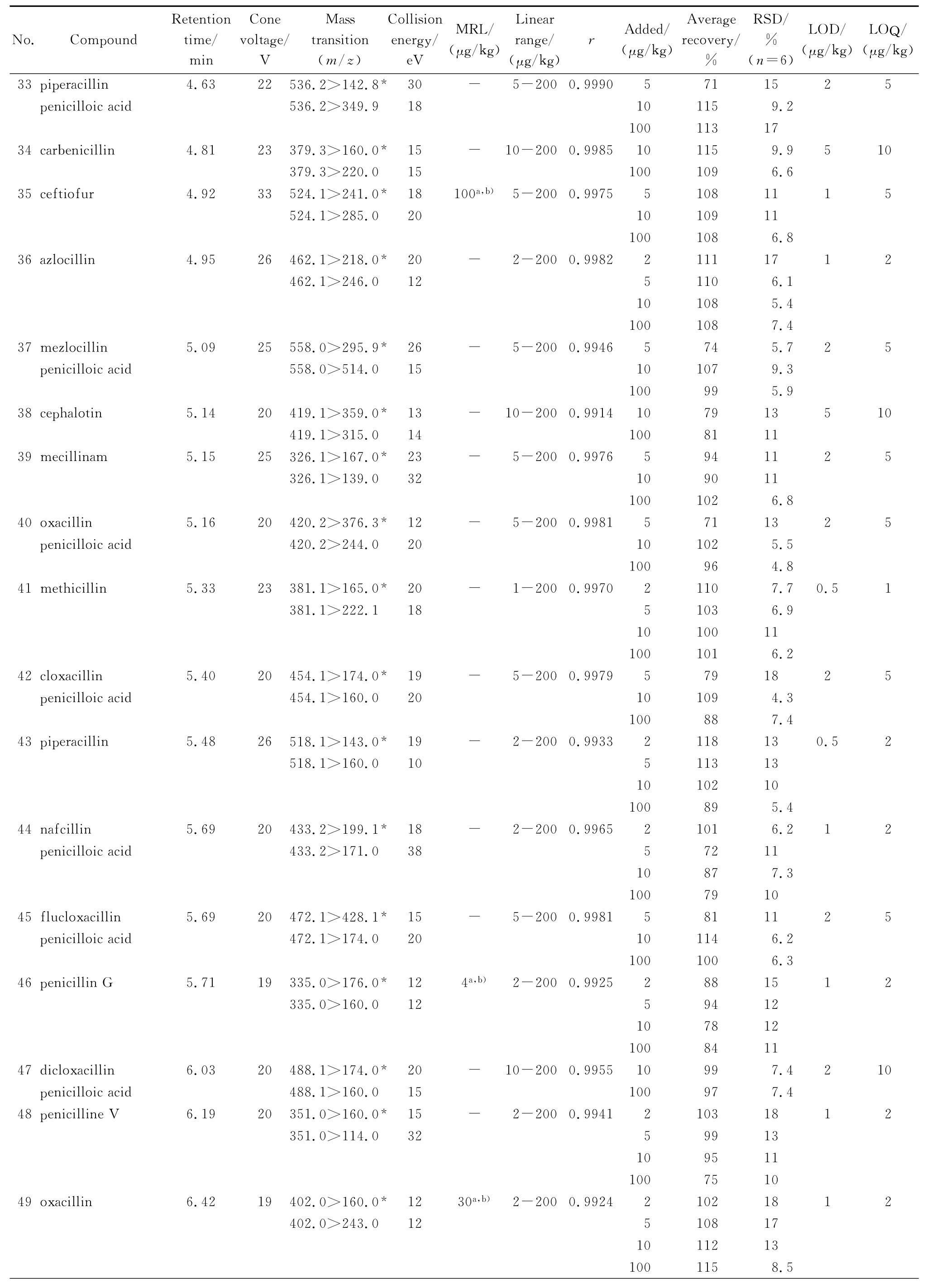
表1 (续)Table 1 (Continued)
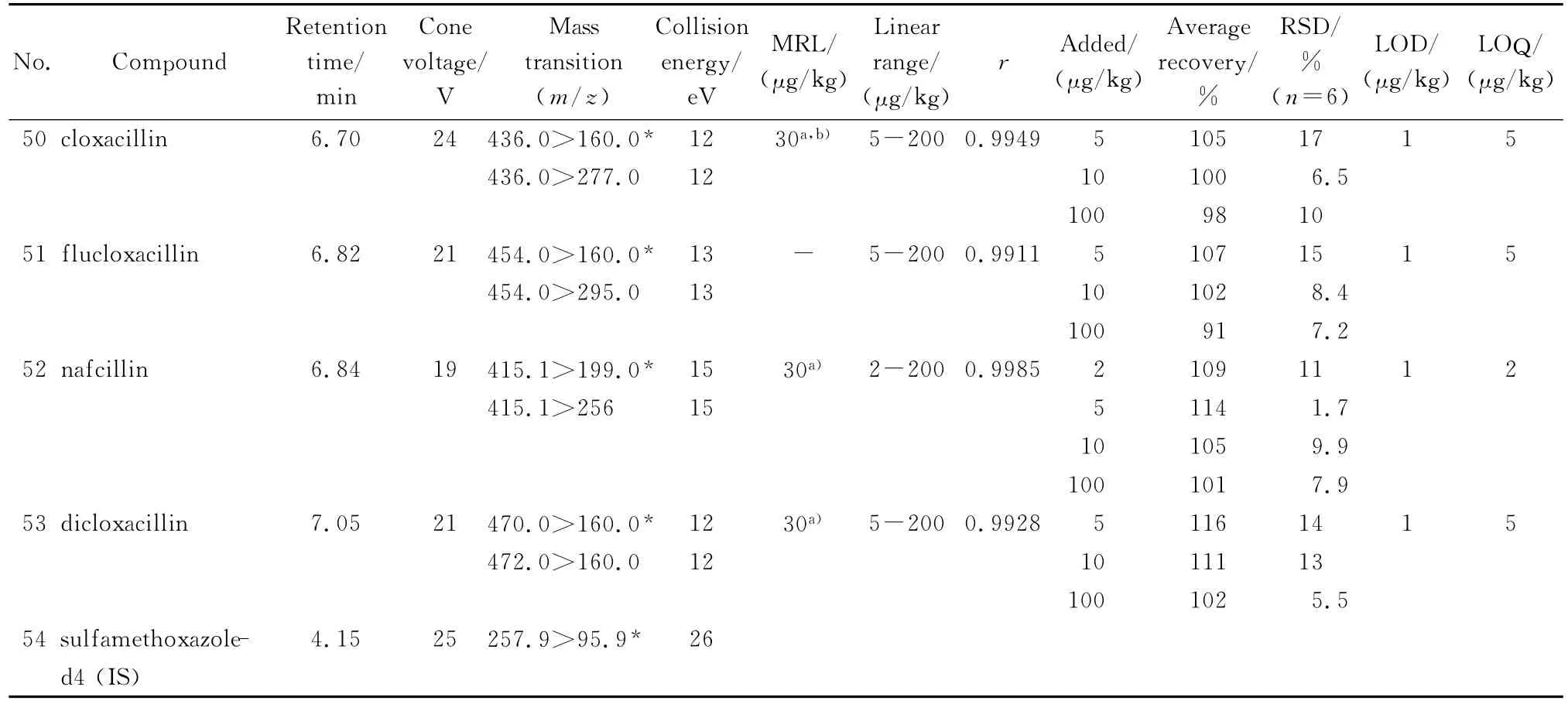
表1 (续)Table 1 (Continued)
注射泵以50μL/min的流速将每种待测组分的标准溶液通过三通汇合一定比例的流动相注入离子源中,在正离子模式下得到准分子离子峰,再对准分子离子峰进行二级质谱分析(子离子扫描),得到碎片离子信息,然后对锥孔电压、碰撞能量等参数进行优化,使每种组分的准分子离子产生的特征碎片离子强度达到最大;然后标准溶液由UPLC进样,再对离子源温度、脱溶剂气温度、脱溶剂气流量等进行优化。遵循国际惯例,确证分析需要4个识别点,选择两对离子对,其中干扰小、信噪比大的离子对作为定量离子对。设定合适的峰驻留时间(dwell time)确保色谱峰的采样点数在12~20点,从而得到较好的定量重复性。由于美西林噻唑酸和替卡西林噻唑酸的灵敏度比较低,美洛西林经样品前处理后回收率不好而使标准曲线不呈线性,因此这3种化合物不予测定。优化后的测定条件见表1。
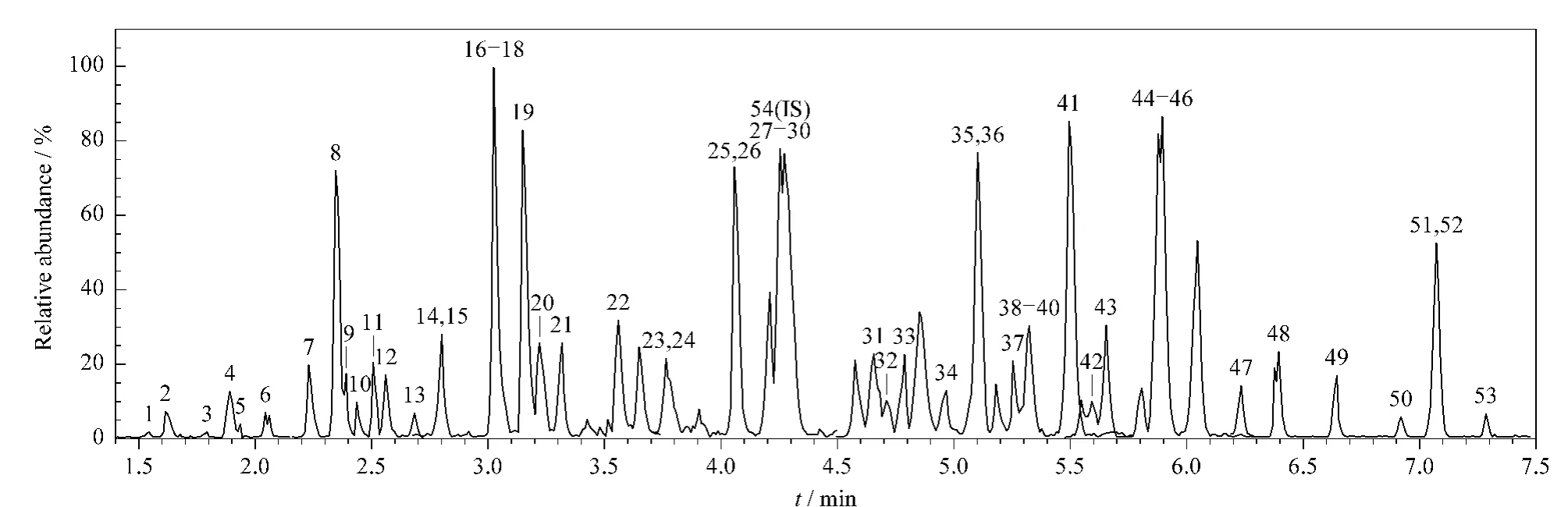
图2 牛奶基质中53种β-内酰胺类抗生素(10μg/L)标准溶液的总离子流色谱图Fig.2 Total ion chromatogram of a milk matrix standard solution of the 53β-lactams(10μg/L)Peak numbers are the same as in Table 1.
2.3 色谱条件的优化
以 ACQUITY UPLC BEH C18柱(100 mm×2.1 mm,1.7μm)作为分析柱,分别采用不同浓度的甲酸水溶液和甲酸乙腈溶液、甲酸甲醇溶液作为流动相进行优化。发现使用0.1%甲酸乙腈溶液和0.1%甲酸甲醇溶液都能得到较高的灵敏度和较好的分离效果。由于乙腈的柱压较低、洗脱能力较强,最终选用的流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈溶液。同时选择适当的梯度洗脱程序使53种待测组分得到较好的分离,一次分析仅需10 min。为了防止待测物在液相色谱进样前分解,将样品室的温度设为5℃。53种待测物的总离子流色谱图见图2。
2.4 样品前处理方法的优化
牛奶中β-内酰胺类抗生素的样品前处理方法主要有乙腈沉淀去除蛋白质的方法[6,9,15]和反相固相萃取法[5,7,8]。采用乙腈沉淀法,处理液中杂质较多,测定时有基质抑制效应;而使用反相固相萃取法后有基质抑制效应,与乙腈沉淀法相比并无明显改善。本试验采用乙腈沉淀法,并增加超声提取步骤,提取液最终经过超滤净化结合液相色谱在线流路切换,利用切换阀将色谱柱开始流出的含强极性成分的杂质切换至废液中,质谱只对待测成分流出部分进行检测,最后将乙腈洗脱的弱极性杂质切换到废液中,避免质谱受到污染。
在2.00 g牛奶样品中分别加入等体积和2倍体积的乙腈提取,结果表明加入等量乙腈时的回收率要优于2倍量乙腈时的回收率。可能是加入2倍量的乙腈使蛋白质迅速沉淀,待测物被包裹在沉淀物中而难于完全提取出来。牛奶样品加入等量的乙腈混匀后不会出现沉淀,经高速离心可去除大部分杂质,上清液基本澄清,再经超滤去除大分子物质,可显著降低基质效应。由于超滤管有一定死体积,500μL乙腈提取液经超滤得到约400μL超滤液。经氮吹去除乙腈至体积约为100μL,基本去除乙腈,避免早出峰组分的峰形变宽,加入100μL水使处理液总体积约为200μL,不需定容。为了校正样品中可能存在的基质效应、处理液最终体积的偏差以及样品前处理过程中的损失,采用基质工作曲线内标法定量。前处理方法简单、快速,每人每天可处理50多份样品。
结果发现青霉素G-d7作为同位素内标加在含有β-内酰胺酶的样品中会被分解,最终无法定量计算。经过试验最终选用磺胺甲噁唑-d4作为内标物。
2.5 线性范围和检出限
在空白样品中加入标准溶液,制作6点系列标准工作溶液,在选定的色谱和质谱条件下进行测定。采用Masslynx 4.1中Targetlynx组件以定量离子对峰面积和内标物定量离子对峰面积的比值对基质标准溶液的质量浓度作图,牛奶中53种待测物的相关系数在0.991 1~0.999 0之间,符合线性关系的要求。在本法操作条件下,信噪比为3时对应的样品质量浓度为检出限(LOD),信噪比为10时对应的样品质量浓度作为定量限(LOQ)(见表1),结果能够满足我国和欧盟对兽药残留最高限量的要求。
2.6 方法的回收率和精密度
用空白牛奶进行加标回收率和精密度实验,样品添加不同水平的标准溶液后,放置30 min,使待测成分与样品基体成分相互作用达到平衡,再按优化的样品前处理方法进行操作,其回收率和精密度结果见表1。加标回收率均在71%~121%范围内,相对标准偏差在1.7%~19%之间,符合兽药多残留分析的要求。
2.7 实际样品的检测
对14份市售品牌牛奶进行检测,共有3份样品检出β-内酰胺类抗生素残留,其中1份样品同时含有头孢拉定和头孢米诺,含量分别为5.6μg/kg和2.8μg/kg(见图3),另外2份样品均检出氨苄西林,但其残留量都低于定量限。
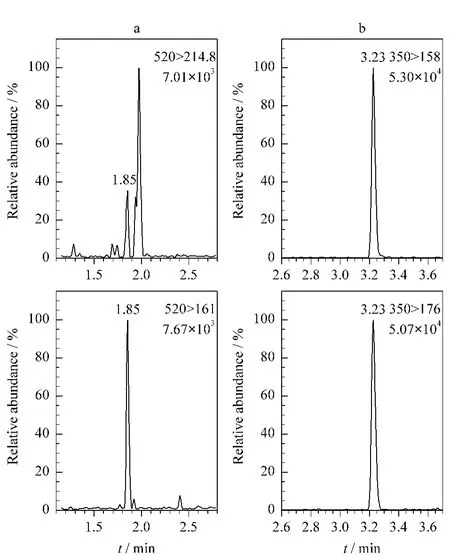
图3 牛奶样品中检出的(a)头孢米诺和(b)头孢拉啶的MRM色谱图Fig.3 MRM chromatograms of(a)cefminox and(b)cefradine in milk samples
3 结论
通过对样品提取、净化以及色谱分离、质谱测定等条件的优化,建立了快速同时测定牛奶中53种β-内酰胺类抗生素及其代谢产物多残留的方法。该方法简单、快速,每人每天可处理50多份样品,且特异性强、灵敏度高,已应用于实际样品的测定,取得了满意的结果。
[1] Grunwald L,Petz M.Anal Chim Acta,2003,483:73
[2] Blaha J M,Knevel A M,Hem S L.J Pharm Sci,1975,64(8):1384
[3] Chen H,Ma W J,Tian J H,et al.Animal Husbandry and Feed Science(陈号,马文静,田晋红,等.畜牧与饲料科学),2010,31(1):67
[4] Tian C Q,Tan H R,Gao L P,et al.Chinese Journal of Chromatography(田春秋,檀华蓉,高丽萍,等.色谱),2011,29(11):1128
[5] Becker M,Zittlau E,Petz M.Anal Chim Acta,2004,520:19
[6] Daeseleire E,Ruyck H D,Renterghem R V.Rapid Commun Mass Spectrom,2000,14:1404
[7] Huang B F,Ren Y P,Cai Z X,et al.Chinese Journal of Food Hygiene(黄百芬,任一平,蔡增轩,等.中国食品卫生杂志),2007,19(1):31
[8] Sun L,Zhang L,Wang X,et al.Journal of Instrumental Analysis(孙雷,张骊,汪霞,等.分析测试学报),2009,28(5):576
[9] Qin F,Zheng W J,Chen G L,et al.Chinese Journal of Antibi-otics(秦峰,郑文捷,陈桂良,等.中国抗生素杂志),2009,34(6):348
[10] Baere S D,Cheriet M,Baert K,et al.Anal Chem,2002,74:1393
[11] Li W,Ai L F,Guo C H,et al.Chinese Journal of Chromatography(李玮,艾连峰,郭春海,等.色谱),2013,31(10):946
[12] Chen C,Yan H,Shen B H,et al.Chinese Journal of Chromatography(陈聪,严慧,沈保华,等.色谱),2012,30(5):445
[13] Degelaen J P,Loukas S L,Feeney J,et al.J Chem Soc,Perkin Trans 2,1979:86
[14] Valvo L,Alimont S,Aliment R,et al.J Pharm Biomed Anal,1997,15:487
[15] Ortelli D,Cognard E,Jan P,et al.J Chromatogr B,2009,877:2363
