微波协同离子液体EmimOAc处理毛竹的研究
2014-08-03周梦阳阮榕生刘玉环张锦胜郑洪立
周梦阳 彭 红,2,* 阮榕生,2 刘玉环,2 张锦胜,2 郑洪立
(1.南昌大学生物质转化教育部工程研究中心,江西南昌,330047;2.南昌大学食品科学与技术国家重点实验室,江西南昌,330047)
近年来,随着全球能源与环境问题的日益严峻,关于发展替代燃料取代传统燃料的研究越来越受关注[1]。木质纤维资源具有产量巨大、可再生等优点,可作为化石能源如煤、石油的替代品或补充[2]。木质纤维生物质主要由纤维素、半纤维素和木素组成。由于木质纤维中三维、交叉的木素网状结构和聚合物基质间的强氢键作用,使木质纤维溶解非常困难[3]。因此,要提高木质纤维生物质的利用率,生物质原料需经过预处理,暴露出其中的纤维素,使其结晶度降低,从而容易被进一步转化。
离子液体(IL)是指在室温或接近室温下呈液态的、完全由阴阳离子组成的盐,也称为低温熔融盐。自2002年Swatloski等[4]首次发现离子液体可以溶解纤维素以来,离子液体为木质纤维生物质的预处理提供了新的思路。带有羧酸根或膦酸根的离子液体具有低熔点、低黏性和接受氢键能力的特点,这些性质都利于生物大分子的溶解[5-7]。离子液体1-乙基-3-甲基咪唑乙酸盐(EmimOAc)作为这类离子液体的代表,其低毒性、低熔点、低黏度以及弱碱性[8]使其成为木质纤维生物质预处理中的新型绿色溶剂。
微波辐射通过将电磁能直接转化为内能而引起物质分子水平的发热[9],因此,被广泛用于有机物的合成和提取[10]。微波辐射能加速木质纤维复合物间化学键与氢键的断裂,从而增大了半纤维素、纤维素和木素溶出的可能性。Wang等[11]研究认为,微波能促进EmimOAc对南方松的溶解和脱木素作用。微波辐射与离子液体共同应用于木质纤维生物质的预处理将有利于木质纤维的生物质转化过程。
毛竹具有产量高、繁殖快、易于种植等特点,在我国分布非常广泛,仅江西省境内就达62.6万hm2。因此,本研究以竹龄为4年的毛竹为原料,探究了球磨并脱脂脱蜡后的竹粉在离子液体EmimOAc中的溶解和提取情况,并采用傅里叶变换红外光谱(FT-IR)、X射线衍射(XRD)、扫描电子显微镜(SEM)等研究了离子液体处理前后毛竹竹粉和提取的富含纤维素物质的结构变化。
1 实 验
1.1材料及仪器
4年生毛竹(PhyllostachyspubescensMazel)取自南昌市梅岭镇官溪村,切成1 cm×1 cm大小的碎片后充分晒干,然后用植物粉碎机粉碎,选取过40目留于100目的竹粉并经干燥后备用;离子液体1-乙基-3-甲基咪唑乙酸盐(EmimOAc)购于上海成捷公司,纯度99%;甲苯、乙醇、丙酮和硫酸等试剂均为分析纯;水为去离子水。
HDJ-5振动球磨机,上海天和制药机械有限公司;蔡司710激光扫描共聚焦显微镜,德国卡尔蔡司公司;Nicolet 5700傅里叶变换红外光谱仪,美国热电尼高力公司;DISYSTEM多功能X射线衍射仪,英国Bede公司;FEI Quanta 200F环境扫描电子显微镜,美国安捷伦公司。
1.2竹粉的脱脂脱蜡及球磨粉碎
取一定量充分干燥的竹粉进行索氏抽提6 h以去除脂质和蜡质物质,抽提剂为甲苯/乙醇(体积比2∶1)。脱脂脱蜡竹粉在振动球磨机中进一步研磨80 h后干燥备用。球磨在室温下进行,钢球直径为3.34 cm。
1.3竹粉在离子液体中的溶解和提取
将1.5 g球磨并脱脂脱蜡后的竹粉与30.0 g离子液体EmimOAc在50 mL烧杯中混合,然后置于微波反应器中进行溶解处理。离子液体极性较强,吸收微波后升温很快,因此,微波辐射功率恒定为200 W,单次辐射时间为2 min,磁力搅拌转速为600 r/min。为防止过高温度导致的离子液体和生物质的降解,每次单次辐射结束后将装有竹粉和离子液体的烧杯在冰水浴中以迅速冷却至室温,然后在同样条件下再次进行微波辐射处理。为探究微波辐射时间对离子液体溶解生物质的影响,取4份样品分别进行20、40、60和80 min的微波辐射。处理完毕后将混合物在4800 r/min条件下离心40 min,分离未溶解的竹粉,未溶解竹粉用去离子水充分洗涤后在60℃烘箱中过夜干燥,记作ILR (ionic liquid residue,未溶竹粉)。如果竹粉被完全溶解,则此步忽略。另取5.0 g竹粉与100.0 g离子液体混合后在110℃油浴中加热16 h,以便与微波加热法进行比较。
竹粉在离子液体中的溶解率按下式计算:
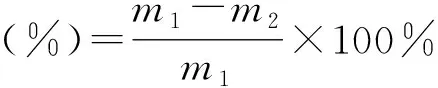
式中,m1为原料竹粉的质量,g;m2为未溶解竹粉的质量,g。
向离心后的上清液(离子液体/竹粉溶液)中加入10倍体积的丙酮/水(体积比1∶1),在室温下搅拌1 h,得到灰色、絮状沉淀。在4800 r/min条件下离心得到沉淀,用去离子水洗涤该沉淀并冷冻干燥,记作CRM(cellulose rich material,富含纤维素物质)。
富含纤维素物质(CRM)得率按下式计算:
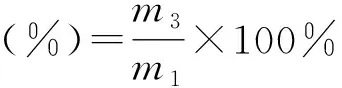
式中,m1为原料竹粉的质量,g;m3为CRM的质量,g。
1.4竹粉在离子液体中溶解进程的观察
微波每辐射5次后取1滴烧杯中的离子液体与竹粉的混合物装片,在激光共聚焦显微镜下观察竹粉的溶解进程。
1.5Klason木素含量的测定
原料竹粉、离子液体处理后未溶竹粉(ILR)和富含纤维素物质(CRM)中Klason木素含量的测定依照 Sun等[12]的方法。
取0.1 g干燥竹粉或0.2 g CRM放入250 mL锥形瓶中,加入1.5 mL(对于竹粉)或4.0 mL(对于CRM)72%的H2SO4,室温下搅拌2 h。再加入56 mL(对于竹粉)或150 mL(对于CRM)的去离子水,在电热板上回流4 h后过滤,残渣洗涤后干燥、称其质量。
Klason木素含量按下式计算:
式中,m4为竹粉或CRM的质量,g;m5为残渣的质量,g。
1.6红外光谱(FT-IR)分析
取干燥后ILR和CRM样品1 mg,经KBr压片,Nicolet 5700 傅里叶变换红外光谱仪于400~4000 cm-1范围内进行扫描测定。
1.7纤维素的X射线衍射(XRD)分析
XRD分析测定条件:X光管靶材,Cu靶,管电压40 KV,管电流20 mA,扫描速率0.02°/s,扫描范围10~100°。
纤维素结晶度按下式计算:
式中,I002为结晶区2θ=22°处的衍射峰强度;Iam为无定形区2θ=18°处的衍射峰强度。
1.8扫描电镜(SEM)分析
取干燥后的ILR和CRM样品,利用SEM观察微观结构,扫描电压为10 kV,观察环境为超高真空。
2 结果与讨论
2.1竹粉在离子液体中的溶解
离子液体能破坏生物质大分子中的氢键,对生物质材料有较强的溶解能力。与其他离子液体如氯化1-烯丙基-3-甲基咪唑(AmimCl)、氯化1-丁基-3-甲基咪唑(BmimCl)等相比,EmimOAc溶解木材的效果更好。这是由于EmimOAc中的乙酸根呈弱碱性,能更有效地断裂纤维素分子内和分子间的氢键[12]。同时,EmimOAc具有较低的黏度和熔点,容易进入生物质大分子内部,这也使其成为溶解生物质的良好溶剂。

图1 竹粉在离子液体中的溶解过程
在激光共聚焦显微镜下竹粉随微波辐射时间的溶解情况如图1所示。由图1可知,未经微波辐射的竹粉颗粒在离子液体中清晰可见,轮廓分明;随微波辐射时间的延长,微波加速了分子运动,离子液体EmimOAc在微波作用下渗入纤维内部,EmimOAc中的阴阳离子攻击纤维素氢键导致竹粉溶解;微波辐射60 min后,显微镜视野里观察不到明显的竹粉颗粒,竹粉已完全溶解。
在Sun等[12]的研究中,0.50 g南方松或红橡木粉与10.0 g 离子液体EmimOAc在 110℃的油浴中加热16 h后,溶解率高达90%以上。在本实验中,竹粉与离子液体按1∶20的质量比在110℃油浴中加热16 h,只有24%的竹粉溶解,表明EmimOAc对生物质的溶解效果可能与生物质种类有关。竹材属于禾本科,木质结构较紧密,在传统加热条件下较少溶解于EmimOAc中。在200 W微波辐射60 min后,竹粉完全被EmimOAc溶解,这说明微波能极大地促进EmimOAc对竹粉的溶解作用。同时,与油浴加热相比,微波加热反应时间短,可降低能耗。
2.2富含纤维素物质(CRM)的提取
竹粉溶解于离子液体后,其中的纤维素可以通过加入水或其他反溶剂提取出来。水分子包围离子液体的离子,使纤维素分子内及分子间氢键重建[13],产生CRM沉淀[14]。不含碳水化合物的木素可以溶解在丙酮/水(体积比1∶1)混合溶液中[15],因此,CRM中纤维素纯度较高。本研究中选用丙酮/水作为提取CRM的反溶剂。
如表1所示,CRM主要来自于竹粉/离子液体溶液中溶解的纤维素,竹粉在离子液体中的溶解率越高,CRM得率越大。微波辐射时间较短时竹粉溶解较少,CRM也较少。微波辐射60 min和80 min后竹粉完全溶解于离子液体中,CRM的得率分别为58.5%和62.7%。另外,还有40 %左右的生物质未被提取出来,可能的原因包括:纤维素和半纤维素在与离子液体加热中部分降解,如半纤维素受热会分解成糠醛[8];加入反溶剂后,溶解于离子液体中的木素会溶解于丙酮/水中,这都会造成提取过程中物质的损失。
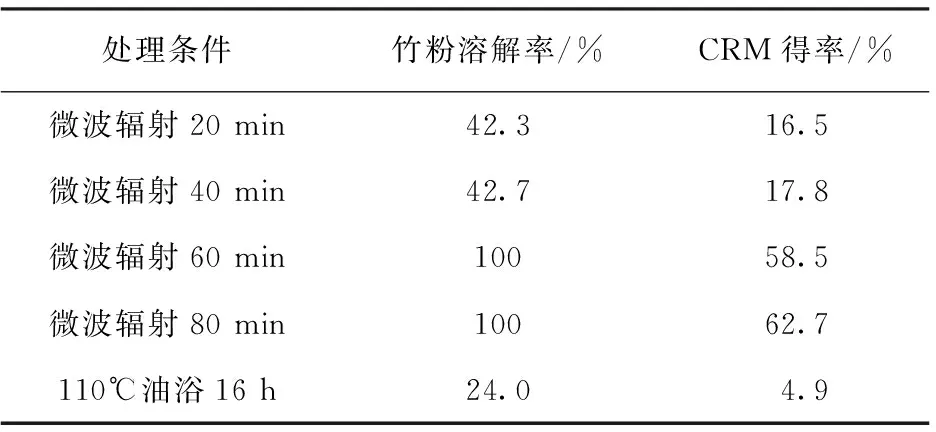
表1 不同处理条件下竹粉在离子液体中的溶解率和CRM得率
2.3离子液体EmimOAc对木素的脱除作用
离子液体中的阳离子与木素分子的π-π作用导致了木素溶解。由于木素与多糖之间存在复杂、牢固的化学键,如C—O—C、C—C和疏水作用,完全脱除木素十分困难。如表2所示,原料竹粉的Klason木素含量为25.9%;经离子液体处理后未溶竹粉中木素含量均有所下降,且随微波辐射时间延长,脱除木素的效果更明显。与未溶竹粉中的Klason木素含量相比,CMR中的Klason木素含量更低;在微波60 min和80 min后,CRM木素的去除率分别高达46.7%和57.1%。油浴加热16 h后,CRM的Klason木素含量为18.5%,说明竹粉的溶解率决定了木素脱除率。微波辐射促进了竹粉在离子液体中的溶解,从而使得到的CRM木素含量更低。

表2 不同样品Klason木素含量
2.4FT-IR分析


图2 原料竹粉和未溶于离子液体竹粉的红外图谱
图3(a)是CRM1、CRM2和CRM5的红外图谱。由相似的红外特征峰可知,微波辐射和油浴加热时获得的富含纤维素物质具有相同的物质组成,但这些物质的含量可能会不同。1161、897 cm-1处的谱带分别对应纤维素/半纤维素的C—O—C伸缩振动和C—H的变形振动,CRM中的这2个峰比原料竹粉的明显,说明CRM糖类含量更高。微波辐射时间大于60 min时,竹粉完全溶解;此条件下CRM3和CRM4的结构与其他CRM略有不同。从图3(b)可知,经过离子液体完全溶解后纤维素中O—H的伸缩振动峰峰值由3420 cm-1处红移至3440 cm-1处,说明纤维素中有更多未形成氢键的自由羟基[16],经历了由纤维素Ⅰ向纤维素Ⅱ晶型转变[17]。木素的特征峰在这2个样品中已不明显,说明木素含量有所降低,该结果与表2结果一致。
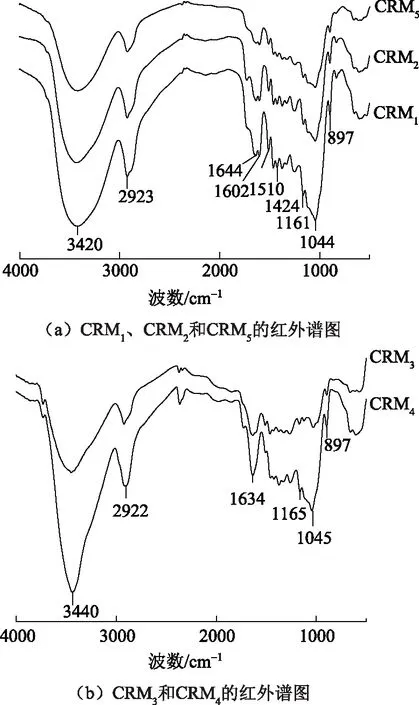
图3 富含纤维素物质的红外谱图
2.5XRD分析
图4是OB和ILR的XRD图谱。图4显示,2θ为18°、22°和34°处的衍射峰分别属于纤维素Ⅰ的(101)、 (002)和 (040)晶格面。经过离子液体处理后,(101) 和 (040) 峰消失, (002)峰变宽变弱。原料竹粉与微波辐射20和40 min、传统加热16 h后未溶于离子液体竹粉的纤维素结晶度依次为31.7%、27.8%、30.3%和19.9%。结果表明,EmimOAc能有效降低竹粉纤维素结晶度。
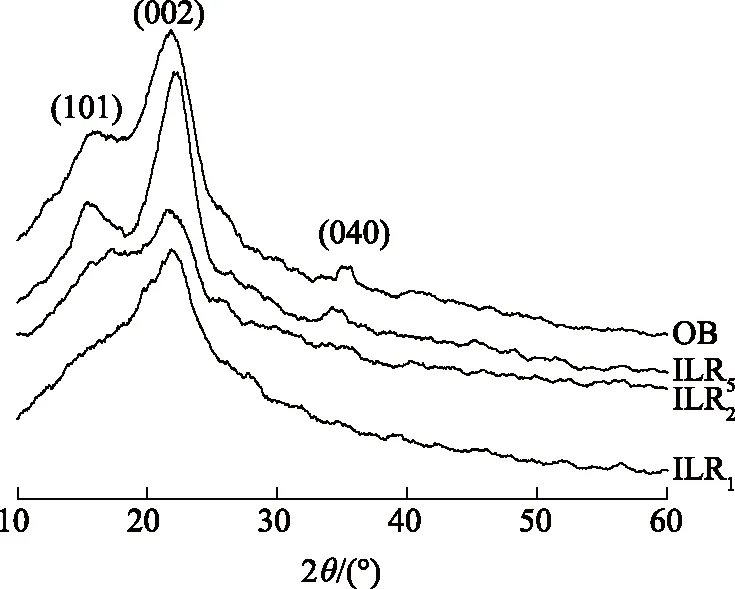
图4 原料竹粉和未溶于离子液体竹粉的XRD图谱
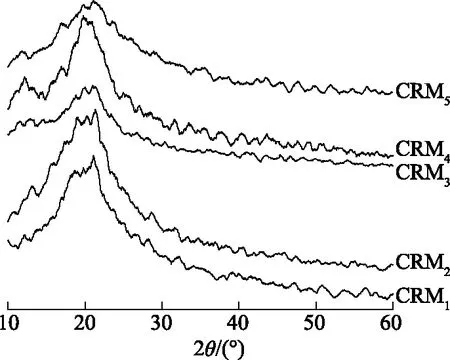
图5 富含纤维素物质的XRD图谱

图6 原料竹粉、未溶于离子液体的竹粉和富含纤维素物质的SEM图
图5为CRM的XRD图谱。CRM仅在2θ=20°处出现一个宽峰,此为纤维素Ⅱ的衍射特征峰。这表明,毛竹竹粉经离子液体处理后纤维素晶型发生了改变,从Ⅰ型转变成Ⅱ型,结晶度降低。此结果与FT-IR分析结果相符。
2.6SEM分析
OB、ILR和CRM的SEM图如图6所示。由图6可知,原料竹粉呈纤维状,表面致密、光滑。经离子液体处理后,竹粉不再保持纤维状,紧密的结构趋于无序,表面产生沟壑,颗粒边缘变得粗糙模糊。这是由于EmimOAc能够润胀植物细胞壁中的纤维素,同时去除了充当微细纤维间“填充剂”和“黏合剂”的木素,微细纤维变得松散,纤维表面的微细纤维暴露出来。干燥后的富含纤维素物质呈片状,毛竹纤维变化显著,纤维融合成相对一致的表面粗糙的膜状结构。
3 结 语
研究了竹粉在离子液体EmimOAc中的溶解和提取情况以及离子液体处理后毛竹微观结构的变化。结果表明,油浴110℃加热16 h后仅有24%的竹粉溶解于离子液体中,而微波辐射60 min后竹粉完全溶解,这表明微波辐射能有效促进竹粉在离子液体中的溶解。离子液体能去除竹粉中的木素,同时破坏纤维素的氢键,改变纤维素的晶型,离子液体处理后竹粉纤维素结晶度有所下降。本研究结果对离子液体的利用和深入开发毛竹生物质资源具有一定意义。今后应对离子液体的回收纯化以及再生物质的利用做进一步研究。
参 考 文 献
[1] Moniruzzaman M, Ono T. Ionic liquid assisted enzymatic delignification of wood biomass: a new “green” and efficient approach for isolating of cellulose fibers[J]. Biochemical Engineering Journal, 2012, 60: 156.
[2] Kumar P, Barrett D M, Delwiche M J, et al. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production[J]. Industrial & Engineering Chemistry Research, 2009, 48(8): 3713.
[3] Kilpeläinen I, Xie H, King A, et al. Dissolution of wood in ionic liquids[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 9142.
[4] Swatloski R P, Spear S K, Holbrey J D, et al. Dissolution of cellose with ionic liquids[J]. Journal of the American Chemical Society, 2002, 124(18): 4974.
[5] Fukumoto K, Yoshizawa M, Ohno H. Room temperature ionic liquids from 20 natural amino acids[J]. Journal of the American Chemical Society, 2005, 127(8): 2398.
[6] Fukaya Y, Sugimoto A, Ohno H. Superior solubility of polysaccharides in low viscosity, polar and halogen-free 1,3-dialkylimidazolium formates[J]. Biomacromolecules, 2006, 7(12): 3295.
[7] Fukaya Y, Hayashi K, Wada M, et al. Cellulose dissolution with polar ionic liquids under mild conditions: required factors for anions[J]. Green Chemistry, 2008, 10(1): 44.
[8] Lynam J G, Toufiq Reza M, Vasquez V R, et al. Pretreatment of rice hulls by ionic liquid dissolution[J]. Bioresource Technology, 2012, 114: 629.
[9] Sobhy A, Chaouki J. Microwave-assisted biorefinery[J]. Chemical Engineering Transactions, 2010, 19: 25.
[10] Liu R L, Zhang J, Mou Z L, et al. Microwave-assisted one-step extraction-derivatization for rapid analysis of fatty acids profile in herbal medicine by gas chromatography-mass spectrometry[J]. Analyst, 2012, 137(21): 5135.
[11] Wang H, Maxim M L, Gurau G, et al. Microwave-assisted dissolu-
tion and delignification of wood in 1-ethyl-3-methylimidazolium acetate[J]. Bioresource Technology, 2013, 136: 739.
[12] Sun N, Rahman M, Qin Y, et al. Complete dissolution and partial delignification of wood in the ionic liquid 1-ethyl-3-methylimidazolium acetate[J]. Green Chemistry, 2009, 11(5): 646.
[13] Zavrel M, Bross D, Funke M, et al. High-throughput screening for ionic liquids dissolving (ligno-) cellulose[J]. Bioresource Technology, 2009, 100(9): 2580.
[14] Zhang H, Wu J, Zhang J, et al. 1-allyl-3-methylimidazolium chloride room temperature ionic liquid: a new and powerful nonderivatizing solvent for cellulose[J]. Macromolecules, 2005, 38(20): 8272.
[15] Fort D A, Remsing R C, Swatloski R P, et al. Can ionic liquids dissolve wood? Processing and analysis of lignocellulosic materials with 1-n-butyl-3-methylimidazolium chloride[J]. Green Chemistry, 2007, 9(1): 63.
[16] Lan W, Liu C F, Yue F X, et al. Ultrasound-assisted dissolution of cellulose in ionic liquid[J]. Carbohydrate Polymers, 2011, 86(2): 672.
[17] Nelson M L, O’Connor R T. Relation of certain infrared bands to cellulose crystallinity and crystal lattice type. Part II. A new infrared ratio for estimation of crystallinity in celluloses I and II[J]. Journal of Applied Polymer Science, 1964, 8(3): 1325.
