部分菊属植物及其近缘种的胚拯救与杂种鉴定1)
2014-07-27陈雪鹃
陈雪鹃
(北京林业大学,北京,100083)
孙 明 菅 琳 李贤利 张启翔
(花卉种质创新与分子育种北京市重点实验室(北京林业大学)) (国家花卉工程技术研究中心(北京林业大学))
部分菊属植物及其近缘种的胚拯救与杂种鉴定1)
陈雪鹃
(北京林业大学,北京,100083)
孙 明 菅 琳 李贤利 张启翔
(花卉种质创新与分子育种北京市重点实验室(北京林业大学)) (国家花卉工程技术研究中心(北京林业大学))
为了提高菊花远缘杂交育种效率,对3个常规杂交育种方法难以获得杂种后代的组合:甘菊ב蝶影’、小红菊×甘菊以及矶菊×太行菊进行幼胚拯救,并对获得的杂种进行了AFLP分子早期鉴定和形态学鉴定。结果表明,3个常规有性杂交难以或仅能获得较少杂种的杂交组合,通过幼胚拯救均可获得杂种后代,极大地提高了育种效率。较适宜的幼胚拯救时期为授粉后16~24 d;较适宜的培养基为MS+BA1.5 mg·L-1+NAA2.0 mg·L-1;AFLP及形态学鉴定证实了杂种的真实性。
菊属;近缘种;胚拯救;AFLP;杂种鉴定
Journal of Northeast Forestry University.-2014,42(7).-74~79,86
We studied embryo rescue and hybrid identification of three cross combinations (Chrysanthemumlavandulifolium×C.morifolium‘Die Ying’,C.chanetii×C.lavandulifolium,Ajaniapacifica×Opisthopappustaihangensis) to select the interspecies hybrid between chrysanthemum efficiently. The offspring of these three combinations could only be obtained by embryo rescue rather than conventional cross breeding. The best time for embryo rescue was 16-24 days after pollination. MS medium supplemented with BA 1.5 mg/L and NAA 2.0 mg/L was the optimal medium for germination and growth. AFLP and morphological analysis proved the reliability of the hybrids.
KeywordsChrysanthemum; Related species; Embryo rescue; AFLP; Hybrids identification
菊花(Chrysanthemummorifolium)是中国传统名花,也是世界四大切花之一。菊花原产中国,在中国有3 000多年的栽培历史[1]。因其在百花纷纷枯萎的秋冬季节傲霜开放,而被赋予丰富高洁的花文化,代表着不畏寒霜的气节。同时,由于其繁茂美丽的花朵,多变奇异的花形,以及较强的适应性和广泛的用途(可食、可酿、可饮、可药),菊花在世界园艺观赏花卉中占有极其重要的地位。多个国家都开展了菊花的新品种选育工作,我国有超过4 000个菊花品种,而全球的品种总数超过了2万以上[2]。
菊花栽培品种的优良性状虽然很多,但是在抗逆、抗病虫害等抗性方面还存在不足,限制了其产量和品质的提高及其应用地域范围的拓展[3-4]。近年来,国内外菊花新品种选育工作中,多利用具有优良抗性的菊属野生种及其近缘属种与栽培菊花进行杂交育种来进行菊花品种的抗性改良。而在此过程中存在的远缘杂交障碍,则严重地阻碍了育种进程。利用胚拯救技术,可以有效地克服远缘杂交过程中受精后障碍的问题,更加高效地获取远缘杂交后代,缩短育种周期[5]。通过此方法,研究人员已成功获得了栽培菊花与菊花脑、异色菊、细裂亚菊等部分野生种的远缘杂交后代[6-8]。而本试验在大量菊属野生种种间杂交、与近缘野生种杂交、与地被菊栽培品种的杂交育种试验基础上,选取常规杂交育种难以获得杂交后代的3个杂交组合,利用幼胚拯救技术获取杂交后代,并对获得的后代进行AFLP早期鉴定及相关的形态学鉴定,以期为将更多优良野生资源引入菊花种质资源库、提高菊花新品种选育效率奠定基础。
1 材料与方法
1.1 材料
在前期大量的地被菊杂交育种试验中,选取使用常规杂交育种手段不易或仅能获取少量杂交后代的杂交组合,利用荧光显微镜观察其花粉在柱头上的萌发过程,挑选出3个有部分花粉能正常萌发伸长至子房的杂交组合作为本试验的供试材料,分别是甘菊(Chrysanthemumlavandulifolium)ב蝶影’(C.morifolium‘Die Ying’)(杂交亲和指数5.5)、小红菊(C.chanetii)×甘菊(杂交亲和指数1.9)、矶菊(Ajaniapacifica)×太行菊(Opisthopappustaihangensis)(杂交亲和指数0.2)。其中,亲本甘菊和小红菊为华北地区常见野生种,具有较强抗性,甘菊的花量极大,而小红菊的花朵观赏性较强;矶菊的叶片深绿,背面密被白色短绒毛,叶缘有白边,是近年来江浙一带园林中常用的观叶植物;太行菊为我国特有种,植株低矮紧凑,花朵洁白美丽,整株具有芳香,且具有较强的抗旱性。所选的亲本野生种都拥有园林观赏花卉所需要的优良特性,具有抗性育种潜力。所有材料均由国家花卉工程技术研究中心(北京林业大学)小汤山菊花种质资源圃提供。
1.2 远缘杂交
试验于2009年10月—2011年5月进行。在亲本进入盛花期时挑选生长健壮、无病虫害的植株作为试验材料。将3个组合的母本人工去雄并套袋进行隔离,在舌状花微开时对父本进行套袋,待其盛开时于晴朗无风天的09:00—12:00采集花粉,并于09:00—15:00进行授粉,同一花序初次授粉2 d后重复授粉1次。
1.3 子房培养
由于菊花幼胚较小,不易取出且取出时易受伤害,因而在菊花中常采用子房培养代替胚培养[5-6,9]。
1.3.1 基因型及授粉后不同接种时期对子房培养的影响
分别取3个杂交组合授粉后4、8、12、16、20、24 d的花序,每次各处理3~5朵。取边缘舌状花的子房(矶菊花序边缘无舌状花或极少,取管状花子房)以75%酒精表面消毒30 s后用0.1%升汞处理5 min,无菌水冲洗5~6次后将子房接入MS+BA2.0 mg·L-1+NAA2.0 mg·L-1培养基[6],每瓶接种10个,每处理重复5瓶,观察胚萌发情况并统计萌发率和出苗率。出愈率=(总愈伤组织块数/接种子房数)×100%;成苗率=(幼苗数/接种子房数)×100%。
1.3.2 不同激素配比培养基的筛选
根据1.3.1试验结果,选择3个组合的最佳接种时期进行子房培养,将子房接种到不同激素配比的培养基内,4种培养基组成成分分别为A:MS+BA1.5 mg·L-1+NAA1.5 mg·L-1;B:MS+BA1.5 mg·L-1+NAA2.0 mg·L-1;C:MS+BA2.0 mg·L-1+NAA1.5 mg·L-1;D:MS+BA2.0 mg·L-1+NAA2.0 mg·L-1。每瓶接种10个,每处理重复5瓶。子房接种产生的愈伤组织或是直接萌发的幼苗转入继代培养基,每月继代1次,待长至3~4 cm转入生根培养基生根,继代培养基和生根培养基参照李辛雷等[6]的设置。培养条件为温度(25±1)℃,每日光照12~14 h,光照度1 700~2 000 lx。获得的小苗先于温室栽植炼苗,后定植于大田。
1.4 杂交后代鉴定
AFLP鉴定:取杂交组合中亲本和后代不同植株上新鲜的幼嫩叶片,液氮混合磨样,采用Tiangen[天根生化科技(北京)有限公司]植物基因组DNA提取试剂盒提取样品DNA。AFLP反应体系、使用仪器和条件设置均与Chen et al.[10]相同,杂种鉴定依据孙明[11]的方法。试验所用接头、引物、Taq DNA聚合酶、DNA Marker、dNTP、Smart ladder、Gel Red、琼脂糖等药品及试剂均购自北京拜尔迪生物技术有限公司。通过聚丙烯酰胺凝胶电泳检测挑选出多态性高的引物组合,在选定组合的Mse I引物的5’端添加荧光修饰(5’-FAM蓝色,5’-HEX绿色),再次进行选择性扩增,生成的荧光PCR产物采用ABI 3730 DNA自动测序仪(北京擎科新业生物技术有限公司)进行检测,利用软件GeneMarkerV1.65获取条带信息并进行统计分析。
形态学鉴定:将获得的杂种小苗于温室内炼苗后定植于大田,于秋季盛花期对杂种后代遗传性状进行观察和统计,性状登记均按莫官站等[12]进行,花色标准参照英国皇家园艺学会色谱。
2 结果与分析
2.1 基因型及授粉后不同接种时期对子房培养的影响
选取授粉后不同时间(days after pollination,DAP)的子房进行接种培养(表1,图1),结果发现:从亲本基因型来看,3个组合中,二倍体野生种甘菊和地被菊品种‘蝶影’杂交的平均出愈率和成苗率都最高,分别为14.3%和4.7%;六倍体野生种小红菊和甘菊杂交组合居中,分别为8.0%和1.7%;而亚菊属矶菊×太行菊最低,只有6.3%和1.0%。不同基因型的3个杂交组合出愈率和成苗率差距较大,这一结论与已有研究结果[6]一致。本试验的3个组合出愈率和成苗率大小与有性杂交试验时的亲和指数高低成正相关,表明二者可能均主要受杂交亲本的亲缘关系远近不同影响。
从授粉后不同接种时期看,3个组合在DAP4、8 d时进行子房培养,均没有得到愈伤组织和幼苗;在12 d时培养均没有获得小苗,只有2个组合有4.0%的出愈率。甘菊ב蝶影’杂交,授粉后16 d时出愈率最高,为42.0%,成苗率最高为DAP 20 d时的10%;杂交组合小红菊×甘菊在DAP 20 d时既有最高出愈率(26.0%),也有最高成苗率(8.0%);以矶菊为母本和野生二倍体太行菊杂交,DAP 24 d时有最高出愈率(18.0%)和最高成苗率(4%)。从平均出愈率和成苗率看,DAP 20 d时有最高的平均出愈率和成苗率,分别为22.0%和6.7%。从结果可见,3个杂交组合的最佳子房培养时期略有不同,组合甘菊ב蝶影’为DAP 16~20 d,组合小红菊×甘菊为DAP 20 d,而矶菊×太行菊的最佳培养时期则在DAP 24 d左右。

表1 基因型及授粉后不同接种时间对子房培养的影响
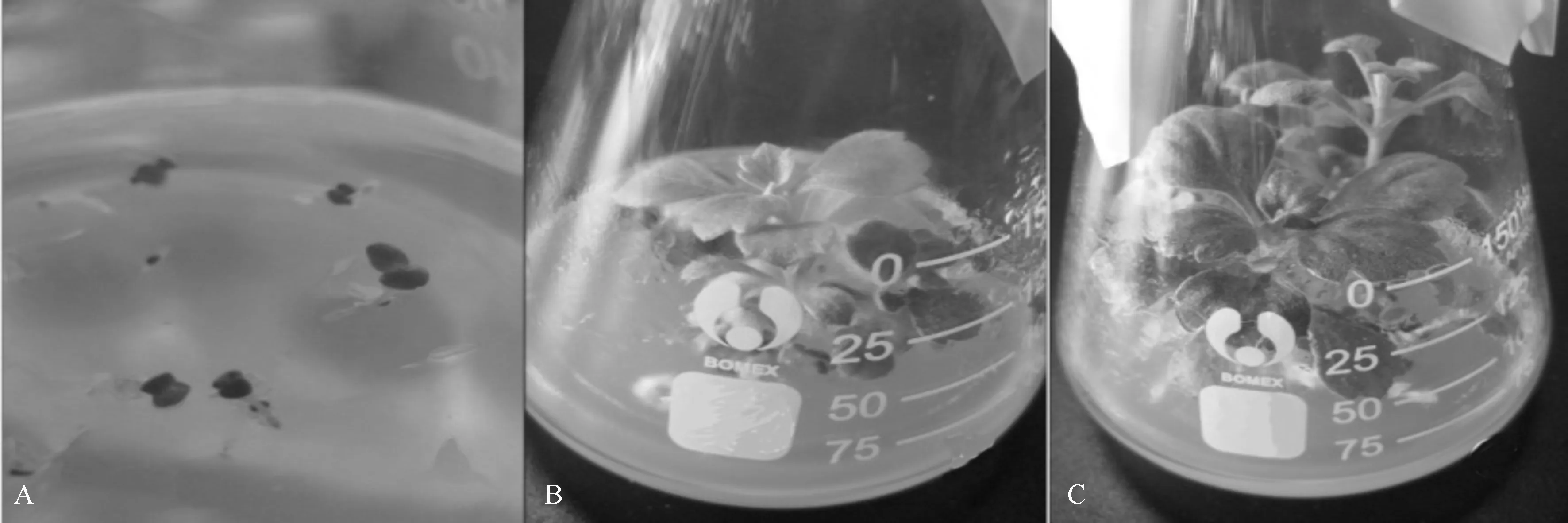
A.胚萌发;B.生根培养;C.继代培养。
2.2 不同激素配比培养基对子房培养的影响
选取3个杂交组合授粉后的最佳培养时期进行子房培养,接种到4种不同激素配比的培养基上(表2),结果表明:除杂交组合矶菊×太行菊在A中无法直接得到小苗外,其余组合均可在4种培养基中获得愈伤组织和小苗。在培养基B中,3个组合的出愈率和成苗率都最高,平均出愈率(26.7%)是培养基A的3.7倍,平均成苗率(12.7%)是培养基A的4.7倍。3个杂交组合在培养基C中的出愈率、成苗率差距均不大。甘菊ב蝶影’在培养基B中的出愈率、成苗率均最高,分别达34.0%、18.0%;杂交组合小红菊×甘菊和矶菊×太行菊在培养基A中出愈率最低,为6.0%。由试验结果可知,对供试的3个杂交组合来说,培养基MS+BA1.5 mg·L-1+NAA2.0 mg·L-1培养效果较好。

表2 不同激素配比培养基对子房培养的影响
注:A~D培养基成分见1.3.2;DAP.授粉后不同时间。
2.3 AFLP的多态性及杂种鉴定
2.3.1 AFLP的多态性分析
在子房培养获得的杂种小苗中,杂交组合甘菊ב蝶影’和小红菊×甘菊的子代各随机挑选10株,矶菊×太行菊的子代随机挑选5株进行AFLP鉴定。首先,用6组不同的DNA样品从79对EcoR I和MseI选择性引物组合中筛选出10个带型清晰且多态性高的引物对(图2中引物组合5)。用这10对引物对3个杂交组合的亲本和随机挑选的杂种后代共31组DNA进行选择性扩增(表3)。由结果可见,筛选出的10对引物组合均获得了清晰可辨且多态性较高的条带结果,不同的引物组合PCR扩增谱带的多少均不相同。引物组合E-AGG/M-CAG扩增的条带最多(1 258条),扩增条带最少的引物是E-TTA/M-CTG(692条)。引物组合E-ACA/M-CAG扩增的条带多态性最高,为89.64%;E-TTC/M-CAG扩增的条带多态性最低,为61.84%。10对引物总共扩增出条带9 908条(70-600 bp之间),其中多态性条带为7 036条,占71.01%,说明所选引物组合的扩增效果较好。

M.DL2000;引物组合1~5.6个样品的5个EcoR I/MseI引物对扩增条带。
图2 引物筛选的聚丙烯酰胺凝胶电泳图
2.3.2 杂种的AFLP鉴定
AFLP标记技术具有较高的稳定性和可靠性,因其DNA使用量较少,能够在早期对杂种幼苗进行鉴定,不影响植株的生长发育,已经被广泛应用于杂种鉴定工作中[12-14]。从本试验的10对引物扩增结果分析(表4)来看,杂种的扩增条带主要有以下4种类型:杂种与父本共有特异条带(MS)、杂种与母本共有特异条带(FS)、杂种与双亲共有条带(BS)以及杂种特有条带(H)。这些结果表明,供试杂交后代为亲本杂种无疑,既具有亲本的特征,同时也因为重组出现了新的特点。从子代与亲本共有的条带数来看,甘菊ב蝶影’的杂种与双亲共有条带最多(平均每个子代与亲本共有96.7条);小红菊×甘菊居中(51.9条);矶菊×太行菊最少,只有29.0条。而与之成反比的是杂种自身特有的条带数量,由大到小的排序是矶菊×太行菊、小红菊×甘菊、甘菊ב蝶影’。这一变化趋势表明,杂交亲本的亲缘关系越远,则杂种与父母共有的条带数越少,杂种更倾向于具有更多的特异条带。

表3 杂交亲本及杂种后代10对AFLP引物的多态性分析
根据子代中出现父、母本特异条带的多少,子代可划分为偏母本型(子代出现母本特异条带数多于父本特异条带数)和偏父本型(子代出现父本特异条带数多于母本特异条带数),本试验中绝大部分杂种都是偏母本型,只有小部分的子代为偏父本型,这一结论与已有的相关研究一致[11,15]。
2.4 杂种形态学鉴定
经过对定植于大田的亲本及杂种后代植株进行观赏性状的观察和记录,结果(表5;图3)表明,除组合小红菊×甘菊的后代在冠幅上出现了明显的超亲现象外,杂种的株高、冠幅、舌状花数量、筒状花数量和花径大部分介于两个亲本之间,大部分父本特有而母本没有的特征在子代有所体现。花色上,杂种相较于亲本出现了更多的花色,表明杂交使得子代花色出现广泛的分离。同时,3个杂交组合的主要观赏性状都表现出明显的偏母性遗传特点,即子代的主要观赏性状更加倾向于母本。
3 结论与讨论
近年来,国内外的菊花育种工作中,除了传统的自然杂交、人工杂交和芽变选种外,多倍体育种、辐射诱变育种和基因工程等方法也被广泛应用。其中,杂交育种方式仍然是定向培育菊花新品种最普遍和最有效的方法[16]。菊花品种目前存在的问题是普遍抗逆性较差,而中国拥有大量具有优异抗性的菊花野生资源,因而,如何将野生资源的优良抗性基因导入菊花品种将是抗性育种中极为关键的环节。在此过程中,有部分菊属植物和其近缘属种亲和性较好,能够直接通过有性杂交获得杂种后代[17-18];借助蒙导授粉、短截花柱、多倍体育种等方式也可以在一定程度上克服杂交障碍获得杂种[11,19];而一些亲缘关系较远的属种杂交时则只能通过胚拯救的方式获得杂种[20]。由此可见,亲本基因型的差异对能否有效取得杂种具有决定性的作用。因而,在进行菊花育种工作时,选配亲缘关系较近的亲本将极大地缩短育种进程;而需要用亲缘关系较远的亲本进行杂交育种时,采用胚拯救的方法可以更有效地获得远缘杂交后代。

表4 杂交亲本及杂种后代的AFLP指纹条带分析
注:1-1~1-10.甘菊ב蝶影’的杂交后代;2-1~2-10.小红菊×甘菊的杂交后代;3-1~3-5.矶菊×太行菊的杂交后代。

表5 杂交亲本及杂种后代的主要观赏性状分析
注:表中数据为平均值±标准差。
孙春青等[21-22]以甘菊和野路菊为父本,栽培菊花品种‘金陵黄玉’和‘奥运天使’为母本进行种间远缘杂交,发现受精后胚大量败育是其杂交失败的主要原因,障碍主要发生在球型胚至心型胚之间。李辛雷等[6]利用异色菊与栽培菊花品种进行的试验中得出授粉后13~18 d为子房培养的最佳时期。本试验中,3个杂交组合的最优胚培养时期从DAP 16~24 d各不相同,表明不同杂交组合获得的杂种胚其发育速度是有区别的。胚培养中,在适宜的胚龄进行胚培养才能有效的获得杂种后代,过早难以培养成功,过晚则胚败育[23]。因而在对不同基因型亲本的杂交胚进行胚拯救时,结合细胞学研究确定杂种胚的发育阶段将有助于提高胚培养的效率。

1-1.♀甘菊;1-2.♂‘蝶影’;1-3.甘菊ב蝶影’杂种;2-1.♀小红菊;2-2.♂甘菊;2-3.小红菊×甘菊杂种;3-1.♀矶菊;3-2.♂太行菊;3-3.矶菊×太行菊杂种。
图3 杂交亲本及杂种形态
Serge[24]提出,低温处理可以促进胚培养时幼胚的萌发,而宋维秀[25]、熊友华[26]等的研究也证实,经过低温处理的幼胚萌发率有显著提高。菊花中目前还没有相关报道,这一规律在菊花的幼胚拯救中是否适用有待进一步研究。
已有的研究中,鉴定菊花杂交后代最常用的方法是形态学鉴定。但是由于多年大量的杂交育种工作,栽培菊花品种的基因高度杂合,在进行杂交育种的过程中,杂交后代的观赏性状会出现广泛的分离,单纯从形态学上有时很难确定杂种的真实性。近年来,用形态学结合细胞学、RAPD分子标记等方法来鉴定菊花杂种真实性[27]弥补了这一缺陷。本试验中应用AFLP分子标记结合形态学鉴定,同样有效地证实了杂种的真实性。同时,由于AFLP标记方法具有丰富的多态性,还可以对材料的亲缘关系进行有效的分析[10],对将来的杂交育种亲本选择具有指导意义。
[1] 刘燕.园林花卉学[M].北京:中国林业出版社,2003:163-164.
[2] 陈俊愉.中国花卉品种分类学[M].北京:中国林业出版社,2001:218-219.
[3] 蒋细旺,包满珠,薛东,等.我国菊花病害种类及危害特征[J].甘肃农业大学学报,2002,37(2):185-189.
[4] 蒋细旺,包满珠,薛东,等.我国菊花虫害种类、直观特征及危害[J].湖北农业科学,2002(6):74-76.
[5] 李辛雷,陈发棣.菊属种间杂交胚拯救过程成苗途径的初步研究[J].植物学通报,2004,21(3):337-341.
[6] 李辛雷,陈发棣.菊花二倍体野生种与栽培种间杂种的幼胚拯救[J].林业科学,2006,42(11):42-46.
[7] Deng Yanming, Chen Sumei, Chen Fadi, et al. The embryo rescue derived intergeneric hybrid between chrysanthemum andAjaniaprzewalskiishows enhanced cold tolerance[J]. Plant cell Rep,2011,30(12):2177-2186.
[8] Zhu Wenying, Jiang Jiafu, Chen Sumei, et al. Intergeneric hybrid betweenChrysanthemum×morifoliumandArtemisiajaponicaachieved via embryo rescue shows salt tolerance[J]. Euphytica,2013,191(1):109-119.
[9] Watanabe K. Successful ovary culture and production of F1hybrids and androgenic haploids in Japanese Chrysanthemum species[J]. Journal of Heredity,1977,68(5):317-320.
[10] Chen Xuejuan, Sun Ming, Liang Jianguo, et al. Genetic diversity of species of Chrysanthemum and related genera and groundcover cultivars assessed by amplified fragment length polymorphic markers[J]. HortScience,2013,48(5):539-546.
[11] 孙明.地被菊及近缘种亲缘关系分析和新品种选育[D].北京:北京林业大学,2007.
[12] 莫官站,张启翔,孙明,等.地被菊杂种1代若干性状的遗传与变异分析[J].安徽农业科学,2010,38(15):7814-7817.
[13] 杨朝东,张俊卫,熊彩凤,等.AFLP技术对梅花杂交种的快速鉴定[J].北京林业大学学报,2004,26(S1):45-47.
[14] 赵天田,沈红香,姚允聪,等.苹果属观赏海棠实生单株亲本的AFLP鉴定[J].园艺学报,2010,37(1):121-128.
[15] 吴静,成仿云,张栋.‘正午’牡丹的杂交利用及部分杂种AFLP鉴定[J].西北植物学报,2013,33(8):1551-1557.
[16] 李辛雷,陈发棣.菊花种质资源与遗传改良研究进展[J].植物学通报,2004,21(4):392-401.[17] Abd EI-Twab M H, Kondo K, Hong D. Isolation of a particular chromosome ofAjaniaremotipinnain a chromosome complement of an artificial F1hybrid ofDendranthemalavandulifolia×Ajaniaremotipinnaby use of genomic in situ hybridization[J]. Chromosome Science,1999,3(1):21-28.
[18] Abd EI-Twab M H, Kondo K. Identification of nucleolar organizing regions and parental chromosomes in F1hybrid ofDendranthemajaponicaandTanacetumvulgaresimultaneously by fluorescence in situ hybridization and fluorescence genomic in situ hybridization[J]. Chromosome Science,1999,3(2):59-62.
[19] 莫官站.甘菊多倍体育种与优良地被菊的选育[D].北京:北京林业大学,2010.
[20] Abd EI-Twab M H, Kondo K. Genome territories ofDendranthemahoraimontanain mitotic nuclei of F1hybrid betweenD.horaimontanaandTanacetumparthenium[J]. Chromosome Science,2001,5(2):63-71.
[21] 孙春青,陈发棣,房伟民,等.甘菊与栽培菊“金陵黄玉”种间杂交失败原因的研究[J].园艺学报,2009,36(9):1333-1338.
[22] 孙春青,陈发棣,房伟民,等.栽培菊花“奥运天使”与野路菊杂交生殖障碍的细胞学机理[J].中国农业科学,2009,42(6):2085-2091.
[23] 陈香波,曹孜义.离体葡萄未成熟胚成苗途径研究[J].果树学报,2000,17(4):261-264.
[24] Serge G. Embryo rescue inRosahybrida[J]. Euphytica,1994,72(3):205-212.
[25] 宋维秀,宋西德,周锋利,等.柴松胚培养诱导芽形成的初步研究[J].西北林学院学报,2008,23(3):114-116.
[26] 熊友华,庄雪影,刘念.姜花属种间杂交胚拯救研究[J].广西植物,2011,31(4):541-544.
[27] 赵宏波,陈发棣,郭维明,等.菊属与亚菊属属间杂种的鉴定及其分类学意义[J].植物分类学报,2007,45(5):661-669.
Embryo Rescue and Hybrids Identification among Species and Cultivars ofChrysanthemumand Its Related Genera/
Chen Xuejuan(Beijing Forestry University, Beijing 10083, P. R. China); Sun Ming, Jian Lin, Li Xianli(Beijing Key Laboratory of Ornamental Plants Germplasm Innovation & Molecular Breeding, Beijing Forestry University); Zhang Qixiang(National Engineering Research Center for Floriculture, Beijing Forestry University)//
陈雪鹃,女,1984年10月生,北京林业大学园林学院,博士研究生。
张启翔,国家花卉工程技术研究中心(北京林业大学)、花卉种质创新与分子育种北京市重点实验室(北京林业大学)、北京林业大学园林学院,教授。E-mail: zqxbjfu@126.com。
2014年1月24日。
S682.1+1; Q943.1
1) “十二五”科技支撑计划(2012BAD01B07、2013BAD01B07)、北京市共建项目专项(2013BJFU)。
责任编辑:任 俐。
