花椒生物碱提取工艺及抗氧化、抑制酪氨酸酶活性研究
2014-07-25赵春萌马建苹
王 雅,赵春萌,谢 婕,赵 萍,马建苹,郭 涛
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
花椒为芸香科植物,全世界约有250种[1],我国约有45种[2],可用作调味品,其果实、根、茎和叶均可入药,有祛风活络、散瘀止痛、解毒消肿、抗菌消炎之功效[3-4]。生物碱是指天然的含氮有机化合物,但不包括开链的简单脂肪胺。目前,花椒中发现的生物碱有茵芋碱、香草柠、青花椒碱等。花椒生物碱具有多种生理功能如抑菌、抗肿瘤、抑制血小板凝集等[5]。
DPPH可以较好的评价物质的抗氧化能力[6]。酪氨酸酶作为黑色素形成过程的关键酶,抑制它的活性可以抑制黑色素的形成[7],抑制其活性可评估皮肤美白剂效果[8]。王如平等[9]对花椒中总生物碱提取条件进行过研究,然而其并未对其抗氧化活性进行测定。而其对酪氨酸酶的抑制作用未见报道。本文探讨了花椒生物碱的提取工艺及其抗氧化、酪氨酸酶抑制活性,以期为花椒的进一步开发提供进一步的理论基础。
1 材料与方法
1.1 材料与仪器
花椒 2012年10月采自甘肃甘谷县,经鉴定为秦椒(Zanthoxylum bungeanum);1,1-二苯基-2-三硝基苦肼(DPPH)、蘑菇酪氨酸酶、L-酪氨酸、L-3,4-二羟基苯丙氨酸(L-DOPA) Sigma-Aldrich公司;茵芋碱标准品 阿生纳。
Cary 50紫外可见分光光度计 美国瓦里安公司;PHS-3D pH计 上海精密仪器制造有限公司;JY92-Ⅱ数控超声波粉碎机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 茵芋碱标准曲线绘制 生物碱含量测定采用酸性染料比色法[9]。称取5mg茵芋碱于25mL容量瓶中,加入无水乙醇,超声溶解定容,得到0.2mg/mL标准溶液。分别吸取1、2、3、4、5mL标准溶液,置于20mL比色管中,加无水乙醇补至5mL,依次加入溴甲酚绿2mL和10mL氯仿溶液,用醋酸-醋酸钠缓冲液调pH到4.5,振摇2min后,倒入分液漏斗中静置1h后,取氯仿层,扫描最大吸收波长,以未加茵芋碱的氯仿萃取液为随行空白。在此波长下测吸光度,以茵芋碱浓度为横坐标,吸光度为纵坐标,得标准曲线方程y=3.9374x+0.0031,R2=0.9975。
1.2.2 花椒生物碱的提取及含量测定 花椒粉碎过40目筛,称取一定量的粉末,以一定浓度的乙醇作溶剂,在pH为3的条件下超声辅助提取后,将其上清液按照1.2.1的方法测定吸光度,并据标准曲线计算生物碱含量,每个实验重复3次。生物碱提取率=生物碱含量/花椒粉末质量。
1.2.3 单因素实验 分别研究乙醇浓度(体积分数)、料液比、超声时间及超声功率对花椒生物碱提取效果的影响。以料液比1∶20g/mL,超声功率200W,提取时间10min,研究乙醇浓度60%、70%、80%、90%、100%对花椒生物碱提取率的影响。以所得出的适宜的乙醇浓度,超声功率200W,提取时间10min,考察料液比1∶14、1∶16、1∶18、1∶20g/mL对花椒生物碱提取率的影响。以所得出的适宜的料液比及乙醇浓度,超声功率200W,研究不同提取时间5、10、15、20min对生物碱提取率的影响。固定以上单因素实验所得适宜的料液比,乙醇浓度,超声时间,考察超声功率100、200、300、400W对生物碱提取率的影响。
1.2.4 响应曲面实验设计 采用统计分析软件Design Expert 8.0.6进行4因素3水平的响应面分析实验。以花椒生物碱提取率作为响应值,根据单因素实验结果,选择实验因素及水平,见表1。

表1 响应面实验设计因素与水平设计表Table 1 Factors and levels of response surface analysis
1.2.5 花椒生物碱制备 将1.2.4响应曲面实验所得的最优提取工艺条件下提取的生物碱粗提物,进行纯化处理[10],以测定其抗氧化及酪氨酸酶抑制活性。将提取液进行减压浓缩,至粘稠。加入2%的盐酸水溶解,过滤。取酸水层用25%的浓氨水调节pH至9~10,并用氯仿萃取。将萃取液进行减压浓缩,得花椒总生物碱,备用。
1.2.6 DPPH自由基清除能力的测定 测定方法参考Aruomaoi[11]和Sánchez-Moreno C[12]并略有改进。将DPPH配制成浓度为0.025mg/mL的溶液。精确吸取DPPH溶液2mL,与2mL80%乙醇溶液混合,以80%乙醇为对照,测定溶液在517nm处的吸光度值(A0);精确移取不同浓度的样液2mL,分别与DPPH溶液2mL混合,摇匀后放置30min。以80%乙醇为对照,测定上述溶液在517nm处的吸光度值(Ai);精确吸取上述不同浓度的样液2mL,分别与2mL 80%乙醇混合均匀,以80%乙醇为对照,测定各溶液在517nm处的吸光度值(Aj)。
计算其清除率(SR),得到清除率在一定浓度范围的回归方程,通过线性方程计算IC50,即DPPH自由基清除率为50%时所对应的样液浓度。IC50值越小,样品清除自由基能力越强,抗氧化活性越强。

1.2.7 酪氨酸酶抑制活性的测定 酪氨酸酶活性测定参考N Baurin[13]的方法并稍作修改。将100μL的0.5mmol/L的L-DOPA溶液,100μL的10mmol/的L-酪氨酸,3500μL的50mmol/L磷酸盐缓冲液(pH6.8)以及200μL试样混合。然后,加入50μL的蘑菇酪氨酸酶(1600U/mL)。37℃保温10min后,由于形成多巴色素,使得在475nm时有最大吸收,从而可使用分光光度计来监测。酪氨酸活性抑制百分数可用如下公式计算:
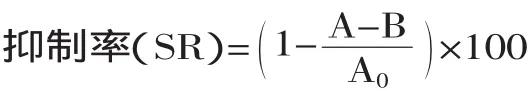
式中,A为试样在475nm的吸光值;B为试样,不加酶在475nm下的吸光值;A0为空白对照在475nm的吸光值。
1.2.8 数据处理 响应面设计及数据处理均采用统计分析软件Design Expert 8.0.6。
2 结果与讨论
2.1 单因素实验结果
2.1.1 乙醇浓度对生物碱提取率的影响 由图1可知,生物碱的提取率随乙醇浓度的升高而增大。乙醇浓度为80%时提取率最高,当乙醇浓度继续上升时生物碱提取率开始有所下降。有资料显示,乙醇与水以一定比例混合可增加生物碱的溶解度,当乙醇浓度过高时,提取液中水分含量就会相对下降,从而导致花椒中的生物碱不能充分的溶解在提取液中,最终导致生物碱提取率有所下降。因此,最优乙醇浓度条件选择80%。
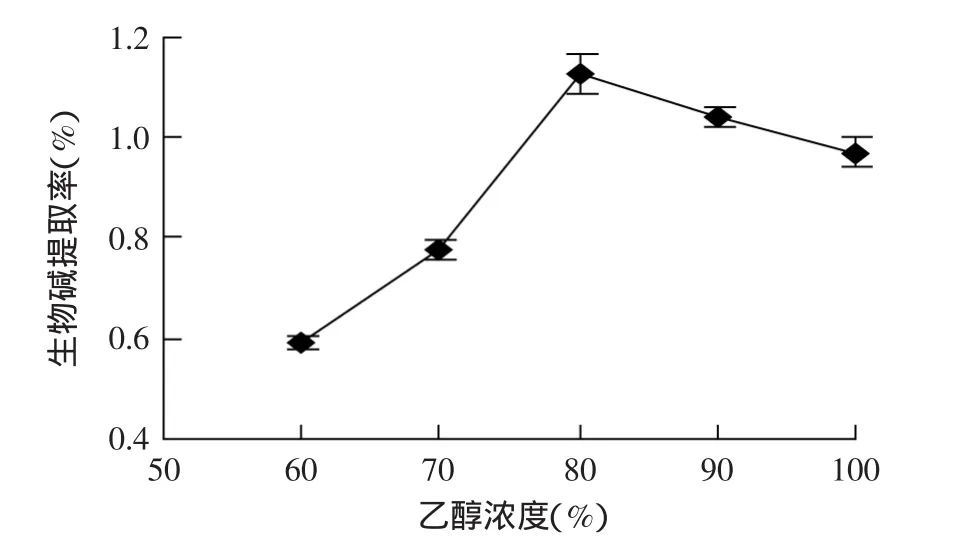
图1 乙醇浓度对生物碱提取率的影响Fig.1 The effect of the ethanol concentration on the yield of alkaloid
2.1.2 料液比对生物碱提取率的影响 由图2可知,在一定范围内,生物碱提取率随料液比的增大而增大。当料液比为1∶20g/mL时提取率最高。花椒生物碱提取属于固液萃取,浓度差是该过程的推动力[14]。溶剂用量越大,生物碱在物料和溶剂之间的浓度差越大,对提高传质速率和降低残渣中的生物碱含量越有利,但溶剂用量过大,造成溶剂回收困难。由图4可以看出,当料液比大于1∶16g/mL时,花椒生物碱提取率基本不变,达到最大提取率,故确定最佳料液比为1∶16g/mL。

图2 料液比对生物碱提取率的影响Fig.2 The effect of the liquid ratio on the yield of alkaloid
2.1.3 超声时间对生物碱提取率的影响 由图3可知,在一定范围内,生物碱的提取率随超声时间的增加而增大。超声时间为10min时提取率最高,当超声时间继续增加时生物碱提取率开始有所下降。这可能是因为在提取的超声波振荡过程中,提取液中会进入大量空气,导致与氧气充分接触生物碱结构被破坏,从而使提取率有所下降。
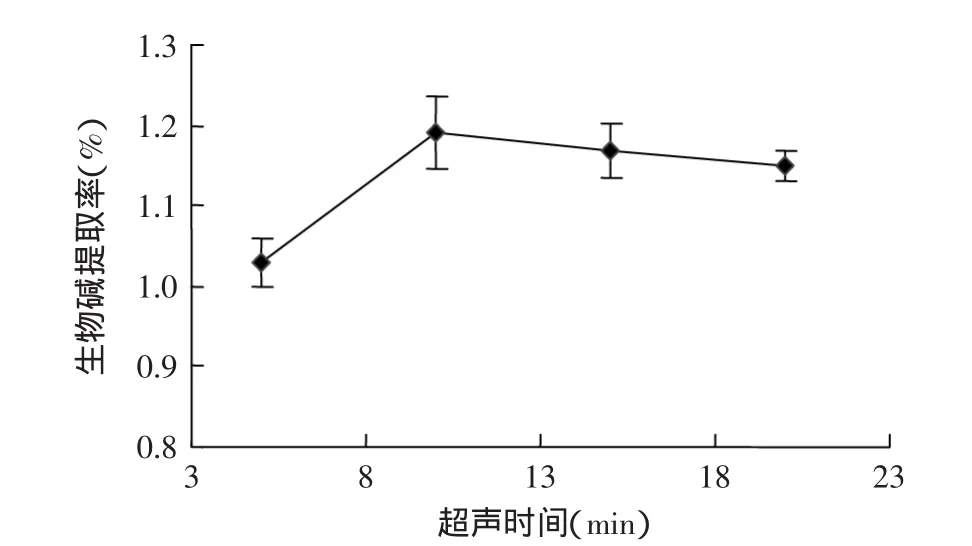
图3 超声时间对生物碱提取率的影响Fig.3 The effect of the ultrasound time on the yield of alkaloid
2.1.4 超声功率对生物碱提取率的影响 由图4可知,超声功率为200W时提取率最高,当超声功率继续上升时生物碱的提取率下降。超声功率过低会造成生物碱提取不完全从而降低提取工艺的效率。若超声功率过高,生物碱结构被破坏,降低其含量。因此,最佳超声功率为200W。
2.2 响应面实验结果
响应面实验设计方案及结果见表2。

图4 超声功率对生物碱提取率的影响Fig.4 The effects of the ultrasonic power on the yield of alkaloid
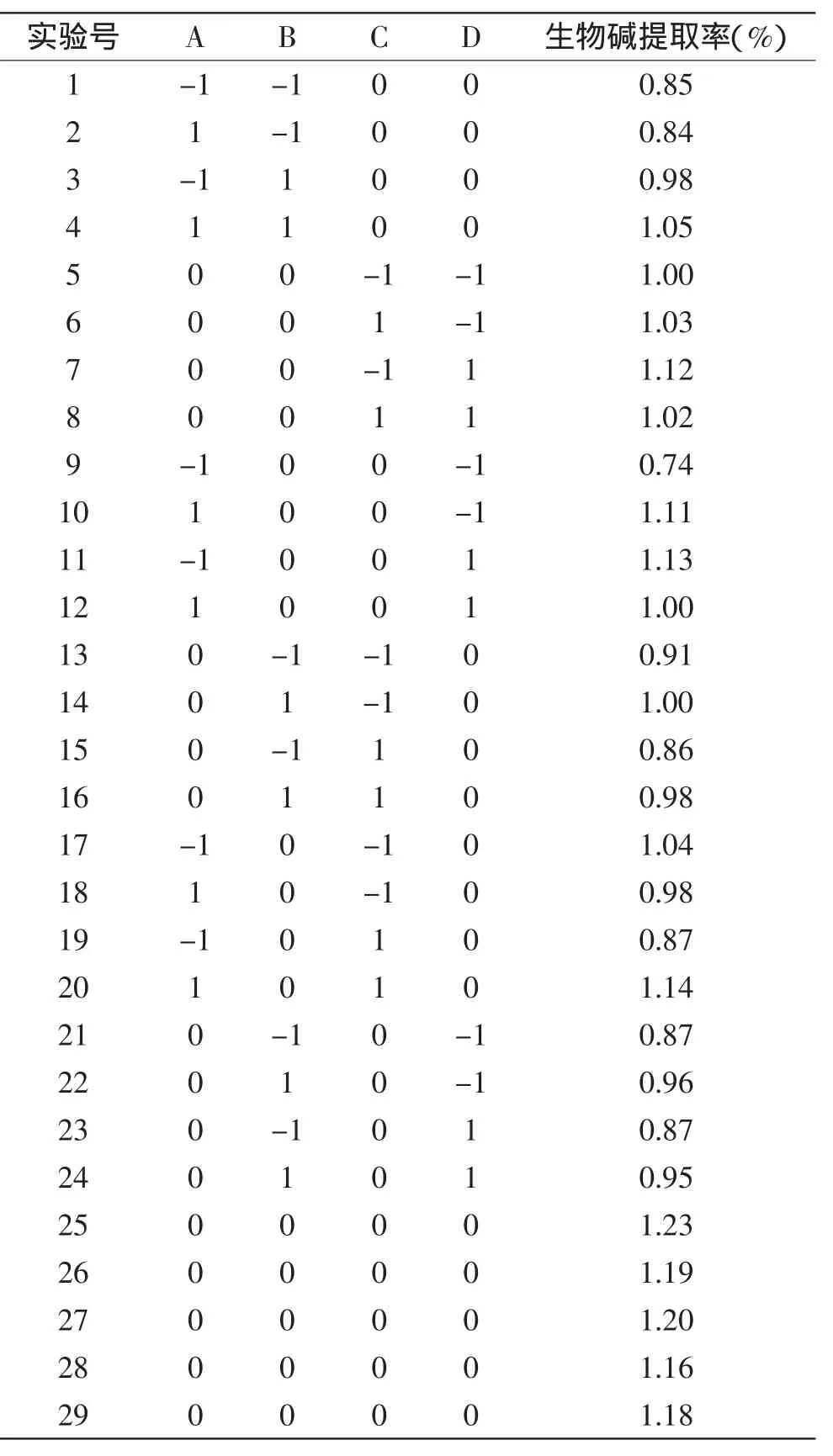
表2 响应面实验设计方案及结果Table 2 The design and results of the response surface design
运用Design Expert 8.0.6数据分析软件对实验数据进行处理,拟合后得到的超声功率(A)、超声时间(B)、料液比(C)、乙醇浓度(D)的二次多项式回归模型为:花椒生物碱提取率Y(%)=-13.43+0.0074A+0.14B+0.62C+0.20D+0.000040AB+0.00041AC-0.00013AD+0.00075BC-0.000050BD-0.0016CD-0.000010A2-0.0071B2-0.018C2-0.00067D2。对该回归模型进行方差分析,结果如表3所示。

表3 回归模型的方差分析结果Table 3 The results of variance analysis of regression model
该回归模型其回归系数R2=0.9436,R2Adj=0.8873,表明此模型能较好地反映花椒生物碱提取率与超声功率、超声时间、料液比、乙醇浓度的关系,可见这种实验方法是可靠的。
由结果得知,AB对响应值花椒生物碱提取率影响极显著,CD对响应值花椒生物碱提取率的影响显著。经F检验显示总模型方程显著(p<0.0001)。
根据表3中F值的大小可以判断各因素对花椒生物碱提取率影响的强弱。F值越大,影响作用越强。因此各因素对花椒生物碱提取影响程度由大到小依次为:超声时间(B)>超声功率(A)>乙醇浓度(D)>料液比(C)。
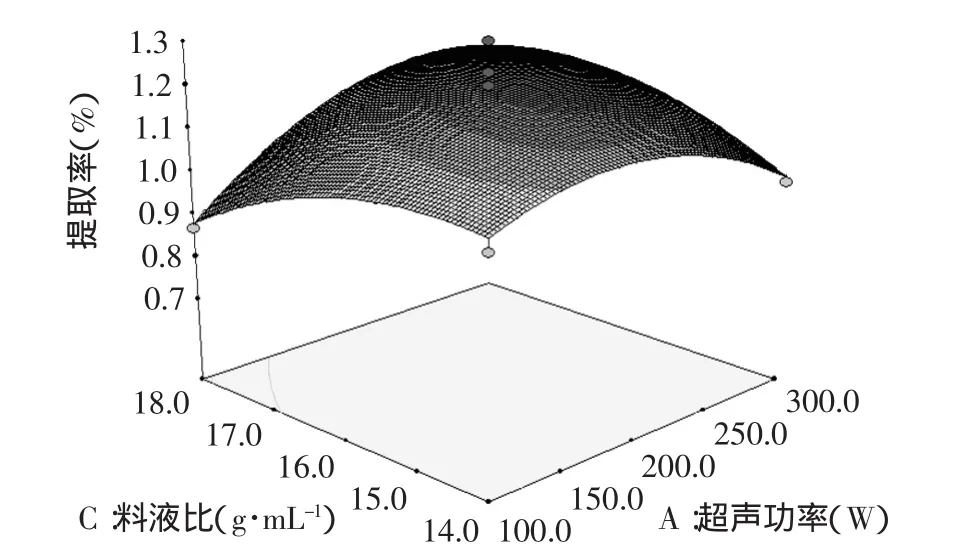
图5 超声功率(A)与料液比(C)交互作用对生物碱提取率影响的响应面图Fig.5 Response surface of mutual-action for ultrasonic power and liquid ratio on the yield of alkaloid
超声功率(A)与料液比(C)因素间交互作用的响应面图见图5。如图5所示,在较小的范围内随着超声功率的增大,响应值增大较明显。但是料液比的增大对响应值的影响较弱,因此超声功率是主要影响因素。从响应面图中还可以得出,随着超声功率和料液比的增大,响应值增大,当响应值增大到极值后,随着各因素值的增大,响应值逐渐减小。该模型有稳定点,且稳定点是最大值。
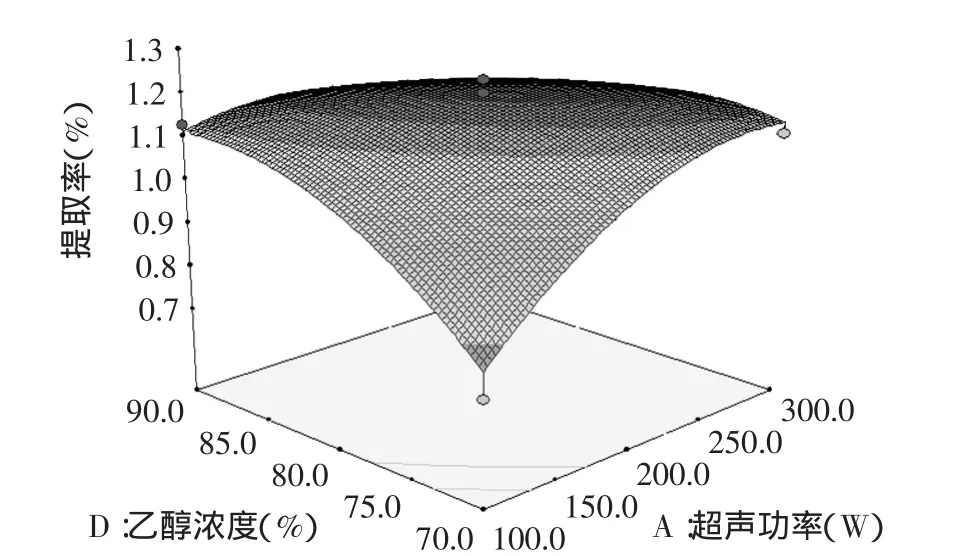
图6 超声功率(A)与乙醇浓度(D)的交互作用对花椒生物碱提取率影响的响应面图Fig.6 Response surface of mutual-action for ultrasonic power and the ethanol concentration on the yield of alkaloid
超声功率(A)与乙醇浓度(D)的响应面图见图6。如图6所示,在起始的范围内,随超声功率的增大,响应值增大明显;随着超声功率继续增加,响应值增大不明显。随乙醇浓度的增大,响应值增大明显。
通过软件Design-Expert求解回归方程,得到花椒生物碱最佳提取工艺条件为超声功率233.47W,超声时间10.96min,料液比1∶16.26g/mL,乙醇浓度79.19%,花椒生物碱提取率可达到1.20%。
2.3 模型验证
为了检验响应面法所得结果的可靠性,同时考虑到实际操作和实验仪器的局限性,修正后的最佳工艺条件如下:超声功率233W,超声时间11min,料液比1∶16g/mL,乙醇浓度79%。在此条件下进行了3次重复验证实验,花椒生物碱的平均提取率为1.19%,与理论值吻合较好,表明实验设计和响应面法优化得到的提取工艺参数准确可靠,具有实用价值。
2.4 生物碱的抗氧化活性结果

表4 花椒生物碱与VC对DPPH自由基的清除能力比较Table 4 The comparison of the alkaloid and VCon DPPH scavenging activities
由图7可知,花椒生物碱对DPPH自由基有明显的清除能力,且在一定浓度范围内呈现剂量依赖关系。由表4中花椒生物碱的IC50值大于VC的IC50。说明花椒生物碱对DPPH自由基清除的能力相对弱于VC。
2.5 生物碱对酪氨酸酶的抑制效果
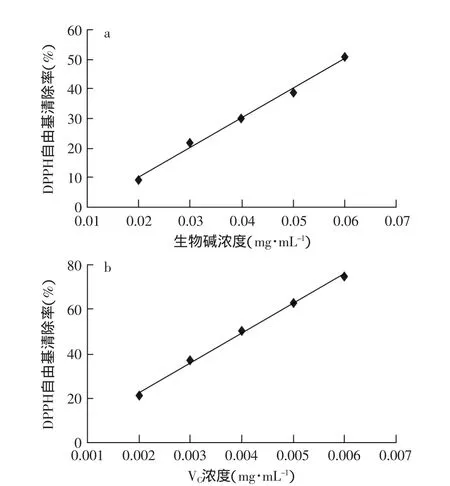
图7 花椒生物碱及VC对DPPH·的清除能力Fig.7 The DPPH·scavenging activities of alkaloid and VC

图8 花椒生物碱及VC对酪氨酸酶的抑制活性Fig.8 The tyrosianse inhibition activities of alkaloid and VC

表5 花椒生物碱及VC对酪氨酸酶的抑制活性比较Table 5 The comparison of the alkaloid and VCon tyrosinase inhibition activities
如图8所示,花椒生物碱有一定的抑制酪氨酸酶活性的能力,且在实验浓度范围内,花椒生物碱和阳性对照VC随浓度的增大,其对酪氨酸酶活性的抑制效果不断增加。由表5可知,花椒生物碱抑制酪氨酸酶活性的IC50值大于VC的IC50值,说明花椒生物碱抑制酪氨酸酶活性的能力弱于VC。
3 结论
本实验通过单因素实验及响应面优化,确定了超声波辅助提取花椒生物碱的最佳提取工艺条件,即超声功率233W,超声时间11min,料液比1∶16g/mL,乙醇浓度79%,此时花椒生物碱提取率可达到1.19%。在各影响因素中,超声时间对生物碱提取率影响最大,而料液比的影响最小。对最优提取条件下提取的花椒生物碱进行抗氧化和抑制酪氨酸酶的活性研究表明:花椒生物碱有一定的清除DPPH自由基及抑制酪氨酸酶活性的能力,但此两种活性均弱于VC。
[1]吴亮亮,石雪萍,张卫明.花椒总黄酮提取技术研究及黄酮成分分析[J].食品研究与开发,2011,32(2):16-20.
[2]石雪萍,张卫明.花椒属植物生物碱研究进展[J].中国野生植物资源,2010,29(4):312-317.
[3]全国中草药汇编编写组.全国中草药汇编(下册)[M].北京:人民卫生出版社,1978.
[4]石雪萍,张卫明,张鸣镝,等.花椒总生物碱镇痛、抗炎、止痒作用研究[J].中国野生植物资源,2011,30(1):46-49.
[5]赵秀玲.花椒的化学成分、药理作用及其资源开发的研究进展[J].中国调味品,2012,37(3):1-5.
[6]赵二劳,范建凤,张海容.用清除DPPH自由基法评价啤酒抗氧化能力[J].酿酒科技,2006,11:30-34.
[7]Motamed Elsayed Mahmoud,Abd El-Latif Hesham,Yasser Abdel-Galil Ahmed,et al.Inhibition of melanogenesis by the extractfrom Agaricusblazeiwithoutaffecting iNOS gene expression[J].World Journal of Microbiology and Biotechnology,2010,26(11):2029-2035.
[8]Chien CC,Tsai ML,Chen CC,et al.Effects on tyrosinase activity by the extracts of Ganoderma lucidum and related mushrooms[J].Mycopathologia,2008,166(2):117-120.
[9]王如平,石雪萍,张卫明,等.花椒总生物碱提取条件研究[J].食品科学,2008,29(10):273.
[10]童德文,赵宝玉,廉士刚,等.甘肃棘豆化学成分研究[J].中兽医医药杂志,2004(5):13-16.
[11]Aruomaoi.Nutrition and health aspects of free radical sand antioxidants[J].Food Chem Toxicol,1994,32(7):671-683.
[12]Sánchez-Moreno C,Saura-Calixto F,Larrauri JA.Procedure to measure the antiradical efficiency of polyphenols[J].Journal Sciences Food Agriculture,1998,76(2):270-276.
[13]N Baurin,E Arnoult,T Scior,et al.Preliminary screening of some tropical plants for anti-tyrosinase activity[J].J Ethnopharmacol,2002,82(2):155-158.
[14]王宇,巨勇,王钊.花椒属植物中生物活性成分研究近况[J].中草药,2002,33(7):666-670.
