常压室温等离子体快速诱变选育丙酮酸高产菌株
2014-07-25司晓光王小霞郑春阳
司晓光,郭 刚,王小霞,郑春阳,高 强,*
(1.工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457;2.天津强微特生物科技有限公司,天津 300384)
丙酮酸是一种重要的有机酸,广泛应用于化工、制药、农用化学品和营养保健品等领域,近年来全球市场需求量不断增长[1-2]。丙酮酸的工业生产方法主要有化学合成法、酶转化法和微生物发酵法。化学合成法是利用化学方法在液相或气相反应条件下中将酒石酸或乳酸氧化为丙酮酸脂[3],进一步水解为丙酮酸,但该方法成本较高且污染严重。酶转化法利用微生物细胞中的酶系将乳酸脱氢氧化成丙酮酸[4],但该方法成本高,无法形成工业性生产。微生物发酵法生产丙酮酸具有效率高、污染小、原料葡萄糖成本低等优点,是一条极具发展前景的工业化生产丙酮酸的方法。但微生物产能低、可利用碳源种类有限等问题成为微生物发酵生产丙酮酸的瓶颈。为此筛选增殖速度快、丙酮酸产量高和可利用碳源广泛的菌株成为了迫在眉睫的问题,国内外研究人员不断从自然界中筛选优良菌株、优化培养基来提高产量,或者尝试利用紫外线、化学诱变剂等方法诱变获取高产菌株,虽然取得一些成效但还无法满足市场的需求,因此需要寻找更有效的丙酮酸高产菌株选育方法显得尤为重要[5]。
目前,我国在丙酮酸的发酵生产方面的研究处于国际先进水平。李寅等筛选到一株以葡萄糖为底物生产丙酮酸的光滑球拟酵母WSH-IP12,发酵55h,丙酮酸含量达到57.3g/L[6];张澎湃通过诱变筛选得到一株高产丙酮酸的突变株TK418,经条件优化后丙酮酸产量较出发菌株提高了35.60%[7];胡晓冰等研究了磷对丙酮酸发酵的影响[8];赵博、王钦宏等对产丙酮酸的光滑球拟酵母菌3672进行高温定向优化,丙酮酸含量达到28g/L,发酵时间有36h变为24h,发酵温度由30℃提高到40℃[9]。
常压室温等离子(ARTP)诱变系统是近年来发展起来的微生物基因组快速诱变方法。ARTP诱变系统是利用等离子体中的活性粒子作用于微生物,使微生物细胞壁和细胞膜的结构及通透性改变,并引起基因损伤,进而使微生物基因序列及其代谢网络显著变化,最终导致微生物产生突变[10-11]。ARTP具有射流温度低、产生的等离子体均匀、无需真空装置、操作简单、成本低、与生物大分子和细胞作用明显等优点[12],已成为快速突变微生物基因组的有效方法。研究表明,ARTP诱变育种技术可以快速地诱变细菌、微藻、真菌、酵母等微生物[13],突变率高,并易获得遗传稳定性良好的突变株[14]。本研究利用新型常压室温等离子体(ARTP)诱变产丙酮酸的光滑球拟酵母(Torulopsis glabrata)Tp19,建立了应用CaCO3筛选平板透明圈与菌落直径比与100孔板法快速简便筛选突变株的方法,并通过摇瓶发酵确定了突变菌株的遗传稳定性,以期获得遗传稳定性良好的丙酮酸高产突变菌株。
1 材料与方法
1.1 材料与仪器
光滑球拟酵母(Torulopsis glabrata)Tp19(NA-+Bio-+TPP-+Pdx-) 天津科技大学生化工程研究室保藏;葡萄糖、蛋白胨、KH2PO4、MgSO4、(NH4)2SO4、MgSO4、烟酸、盐酸硫胺素、生物素、盐酸吡哆醇 分析纯;丙酮酸 色谱纯。
ARTP-II诱变系统 北京思清源生物科技有限公司;高效液相色谱仪Agilent 1200 美国安捷伦科技公司;紫外可见分光光度计TU-1810 北京普析通用仪器有限责任公司;Bioscreener全自动生长曲线分析仪FP-1100-C Oy Growth Curves Ab Ltd.;恒温摇床HYG 上海欣蕊自动化设备有限公司;SBA-40E生物传感仪 山东省科学院生物研究所。
1.2 培养基及培养方法
1.2.1 培养基
1.2.1.1 CaCO3筛选培养基 葡萄糖40g,蛋白胨10g,KH2PO41g,MgSO4·7H2O 0.5g,烟酸8mg,盐酸硫铵素20μg,盐酸吡哆醇0.5mg,生物素10μg,琼脂20g,CaCO35g,蒸馏水定容至1L。
1.2.1.2 种子培养基 葡萄糖30g,蛋白胨10g,玉米浆5mL,KH2PO41g,MgSO4·7H2O 0.5g,蒸馏水定容至1L。
1.2.1.3 发酵培养基[15]葡萄糖80g,硫酸铵8g,KH2PO41g,MgSO4·7H2O 0.5g,烟酸8mg,盐酸硫胺素20μg,生物素10μg,盐酸吡哆醇0.5mg,CaCO330g(摇瓶12h添加),金属离子母液5mL,蒸馏水定容至1L,pH5.6。
1.2.2 培养方法[15]
1.2.2.1 种子培养 从斜面培养基挑取1环活化好的菌种接种到含有50mL种子培养基的500mL三角瓶中,30℃、200r/min摇床振荡培养20h。
1.2.2.2 发酵培养 以5%接种量接入含有50mL发酵培养基的500mL三角瓶中,30℃、200r/min摇床发酵培养36h。
1.2.2.3 100孔板种子/发酵培养 取40μL种子液加入含有360μL种子培养基/发酵培养基,置于Bioscreener全自动生长曲线分析仪中培养,培养条件见表1。

表1 Bioscreener操作条件Table 1 Operating conditions using Bioscreener
1.3 诱变与突变株选育
1.3.1 菌体前培养 取上述活化的种子液,以5%的接种量按上述培养方法培养8~9h,使细胞处于对数繁殖期。
1.3.2 菌悬液制备 取1mL上述培养液5000r/min室温下离心5min,收集菌体,分别用1mL生理盐水洗2次,然后将菌体重新悬浮于适量的无菌水中,制成细胞浓度为1×107cfu/mL的菌悬液。
1.3.3 ARTP诱变 取上述菌悬液10μL涂布于不锈钢载片表面,晾干后移至ARTP-II诱变系统中诱变。诱变条件[16]见表2。

表2 ARTP诱变条件Table 2 Operating conditions using ARTP
将用ARTP处理后的载片置于含1mL生理盐水的2mL离心管振荡洗脱1min,涂布种子培养基平板(种子培养基加2%琼脂)活菌计数。
1.3.4 突变株初筛 取诱变液稀释涂布CaCO3筛选培养基平板,30℃培养36h,挑选R值(R值:透明圈直径/菌落直径)较大的单菌落接种到100孔板,30℃培养24h测定丙酮酸产量。
1.3.5 突变株复筛 将初筛产酸量较高的突变株摇瓶发酵36h,测定发酵液残糖、丙酮酸和α-酮戊二酸的含量。
1.4 分析方法
1.4.1 菌体浓度测定 稀释发酵液,测定660nm处吸光度值。
1.4.2 致死率计算 致死率(%)=100×(对照组活菌数-诱变组活菌数)/对照组活菌数
1.4.3 葡萄糖测定 用配有葡萄糖氧化酶膜的SBA-40E生物传感仪检测。
1.4.4 丙酮酸与α-酮戊二酸测定 高效液相色谱(HPLC)法,色谱柱Agilent ZORBAX SB-C18(4.6×250mm,5μm);流动相0.1%H3PO4溶液;流速1.0mL/min;检测波长210nm。
2 结果与讨论
2.1 ARTP诱变致死曲线的测定
常压室温等离子体产生的活性粒子能够破坏细胞结构,也能够穿过细胞壁到达细胞内打断基因、蛋白质分子等,从而导致大部分微生物死亡[17]。但少数经过ARTP照射过的微生物会通过本身的自动修复系统修复存活,并在这一过程中产生基因突变,因此选择合适的ARTP诱变条件能够实现微生物的快速诱变育种。
出发菌株菌悬液经不同的常压室温等离子束照射时间处理后,生理盐水洗脱并稀释涂布,进行平板计数。不经过照射处理的对照组菌悬液以同样的方法进行平板计数,计算得到每个照射时间下的致死率(图1)。
由图1可知,常压室温等离子体与光滑球拟酵母Tp19菌株的致死率之间存在着明显的剂量效应关系。ARTP处理80s时致死率达到90%以上;处理160s时致死率达到100%。由现代育种理论可知,当微生物菌种的致死率在90%~95%范围时,正突变率最高,因此选择80s为ARTP最佳诱变处理时间,此时致死率为91.7%。

图1 不同ARTP照射时间下的致死率曲线Fig.1 Influence of exposure time on the fatality rate
2.2 突变株初筛及复筛
2.2.1 突变株初筛 诱变80s的处理液稀释后涂布于CaCO3筛选平板,挑选出22株R值较大的单菌落,接种于100孔板并置于Bioscreener全自动生长曲线分析仪中培养20h,取40μL培养液接种于含有360μL发酵液的100孔板中,三组平行发酵测定24h丙酮酸和α-酮戊二酸含量,结果如图2所示。
从图2可以看出,CaCO3平板初筛得到突变株的丙酮酸产量与出发菌株TP19相比,只有8株菌增加,而其余14株菌降低。这一方面表明了CaCO3平板只能作为对产丙酮酸菌株的初筛,并不能作为精确衡量菌株产丙酮酸能力大小的依据;另一方面也说明对丙酮酸产量进行定量测定,即对突变株复筛是必要的。

图2 突变株和出发菌株100孔板24h发酵时丙酮酸和α-酮戊二酸产量Fig.2 The pyruvate and α-ketoglutaric acid production of the mutants and the original strain in 100-well plate at 24h cultivation
2.2.2 突变株复筛 经过以上高通量筛选获得8株突变株进行复筛,结果如图3。从图中可以看出有5个突变株(A109,A214,A302,A311,A605)的丙酮酸产量高于出发菌株Tp19,同时突变株的α-酮戊二酸产量低于出发菌株。这说明丙酮酸产量的提高是由于丙酮酸进入三羧酸循环的代谢流降低。作为糖酵解途径的最终产物,丙酮酸又是三羧酸循环的代谢起点,处于代谢途径中的关键代谢支点。因此,在保证细胞正常代谢的前提下尽可能减少丙酮酸的降解和转化也是提高丙酮酸产量的有效方法。与此同时,在丙酮酸分离提取阶段应尽可能降低非目标产物的含量以提高丙酮酸提取效率,因此较低的α-酮戊二酸可以降低提取成本,提高经济效益[18]。

图3 突变株和出发菌株摇瓶发酵36h的丙酮酸和α-酮戊二酸产量Fig.3 The pyruvate and α-ketoglutaric acid production of the mutants and the original strain at 36h shaking flask cultivation
2.3 突变株遗传稳定性
诱变选育的突变体在传代中可能会出现表型延迟现象,这样就会导致筛选的高产菌株经过传代后很快出现生产性状“衰退”即丙酮酸产量下降。因此,对筛选到得3株高产突变株A214,A302与A311连续转接7代进行遗传稳定性传代验证,结果见图4。
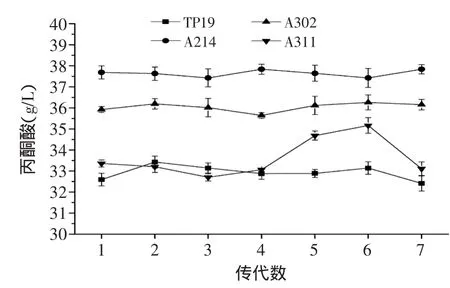
图4 突变株的遗传稳定性检测Fig.4 Genetic stability of mutant strains
工业生产中的优良的菌株不仅要有较高的目的产物生成率和原料利用率,而且还应满足生产性能稳定的要求,即相同的生产条件下菌株性能保持不变。由图4可以看出,突变株A214产丙酮酸的遗传性能稳定,发酵36h的丙酮酸产量保持在(37.43±0.16)g/L,比出发菌株(32.92±0.34)g/L提高了13.69%。表明该突变株产丙酮酸性能稳定,既可以满足工业生产的要求,也可以作为后续实验的出发菌株。突变株A302虽然遗传性能稳定,但是丙酮酸的产量较A214低,而A311的丙酮酸产量起伏较大,不适合工业化应用。
3 结论
本研究表明,ARTP诱变育种方法能够有效的诱变光滑球拟酵母(T.glabrata)Tp19菌株,而100孔平板培养可快速筛选产丙酮酸的突变株。通过摇瓶复筛和遗传稳定性检测,筛选出了一株丙酮酸的突变株A214,该突变株发酵36h的丙酮酸产量达到37.43g/L,比出发菌株提高了13.69%。说明ARTP诱变系统可以引起光滑球拟酵母Tp19的基因突变,突变株A214丙酮酸产量提高的原因尚不清楚,有待进一步研究。本文的实验结果是在摇瓶条件下得到的,由于摇瓶培养过程中营养、溶氧和pH等条件不能调控,接下来需要通过发酵罐放大培养对突变菌株生产丙酮酸的过程和发酵特性进行分析,并进一步优化其发酵条件,为中试和大规模生产提供基础。
[1]杨悦.工业发酵法生产丙酮酸[J].发酵科技通讯,2009,38(4):20-22.
[2]Biwer A P,Zuber P T,Zelic B,et al.Modeling and analysis of a new process for pyruvate production[J].Ind Eng Chem Res,2005,44(9):3124-3133.
[3]刘彩霞,杜海燕,孙家跃.丙酮酸及系列产品的检测与应用[J].生命科学仪器,2006,6(4):9-12.
[4]谷劲松,曲音波.丙酮酸的酶法转化及乳酸氧化酶的研究进展[J].微生物通报,2003,30(1):86-90.
[5]Li Y,Chen J,Lun S Y.Biotechnological production of pyruvic acid[J].Appl Microbiol Biotechnol,2001,57(4):451-459.
[6]李寅,陈坚,梁大芳,等.营养条件对光滑球拟酵母发酵生产丙酮酸的影响[J].生物工程学报,2000,16(2):225-228.
[7]张澎湃.丙酮酸高产菌株的选育及其发酵条件研究[D].河南:河南大学,2007.
[8]胡晓冰,林标声.磷对丙酮酸发酵生产影响作用研究[J].河南师范大学学报,2011,39(1):134-136.
[9]赵博,王钦宏,蔡静平.光滑球拟酵母适应进化改善丙酮酸生产[J].中国酿造,2012,31(4):125-129.
[10]Park J,Henins I,Herrmann H W,et al.An atmospheric pressure plasma source[J].Appl Phys Lett,2000,76(3):288-290.
[11]Wang H B,Sun W T,Li H P,et al.Discharge characteristics of atmospheric pressure radio-frequency glow discharges with argon/nitrogen[J].Appl Phys Lett,2006,89(16):161504.
[12]Li H P,Li G,Sun W T.Radio-frequency,atmosphericpressure glow discharges:producing methods,characteristics and applications in bio-medical fields[M].COMPLEX SYSTEMS:5th International Workshop on Complex Systems,AIP Conference Proceedings,2008,982:584-591.
[13]Wang L Y,Huang Z L,Li G,et al.Novel mutation breeding method forStreptomyces avermitilisusing an atmospheric pressure glow discharge plasma[J].J Appl Microbiol,2010,108(3):851-858.
[14]Li G,Li H P,Wang L Y,et al.Genetic effects of radiofrequency,atmospheric pressure glow discharges with helium[J].Appl Phys Lett,2008,92(72):221504.
[15]张健,高年发.利用响应面法优化丙酮酸发酵培养基[J].食品与发酵工业,2006,32(8):52-55.
[16]Enache I,Naude N,Cambronne J P,et al.Electrical model of the atmospheric pressure glow discharge(APGD)in helium[J].Eur Phys J Appl Phys,2006,33(1):15-21.
[17]Morfill G E,Kong M G,Zimmermann J L.Focus on plasma medicine[J].New J Phys,2009,11(11):115011.
[18]赵南,刘义雄,阚好新,等.发酵法生产丙酮酸钠提取工艺的研究[J].江西农业学报,2010,22(3):161-162.
