双水相纯化淀粉糖化酶的影响因素研究
2014-07-25霍丹群汪治宏郭明遗宋春霞肖亚若沈才洪侯长军
霍丹群,汪治宏,郭明遗,宋春霞,肖亚若,沈才洪,周 军,曾 娜,侯长军
(1.重庆大学生物工程学院,重庆 400044;2.国家固态酿造工程技术研究中心,泸州老窖股份有限公司,四川泸州 646000)
葡糖糖淀粉酶是我国最大、最重要的酶制剂产品之一[1]。产葡糖淀粉酶的菌株多有报道,如红曲霉[2]、黑曲霉[3]、米根霉[4]等。从菌株的发酵液中分离酶液的方法主要有盐析法,等电点沉淀法和有机溶剂沉淀法。但是这些方法在分离过程中容易发生蛋白质变性,导致蛋白分离提取的收率和效率相对较低[5]。
双水相萃取技术克服了以上缺点[6],双水相的形成是一种聚合物与一种盐在适当的浓度下混合于水就形成“互不亲和”的双水相体系,提取酶是根据蛋白质的盐溶及静电作用等因素分离出目标蛋白酶。PEG是一类具有良好亲水性和生物兼容性的高分子聚合物,广泛用于生物领域[7]。PEG的双水相体系萃取技术也逐渐被人们重视和使用[6,8-10]。分离物质在双水相体系中液-液相平衡模型理论时有报道。Khadijeh Khederlou等考察了头孢氨苄在PEG4000和PEG10000与K2HPO4、柠檬酸钠的双水相中的分配额度[11]。Shahla Shahriari等研究了β-淀粉酶和淀粉转葡糖苷酶在PEG/磷酸盐中的分配性能,并对数据进行拟合,发现其分配形为与Flory-Huggins晶格模型相符[12]。Mona Mirsiaghi等研究了L-精氨酸盐在PEG双水相体系的分配性能,结果表明,盐的浓度影响较大,温度次之[13]。用PEG提取淀粉糖化酶的方法也相继被探索[14]。
但是对于不同菌株的发酵酶液进行不同条件的探索的区分力度不够。本实验通过构建不同分子量的PEG与不同的盐形成的双水相系统,用于分离、提纯四种不同菌体的淀粉糖化酶发酵液。不同的菌体发酵液中淀粉糖化酶和杂蛋白的含量均不同,所以有针对性的构建适用于不同体系的双水相系统具有十分重要的理论意义和实际应用价值。
1 材料与方法
1.1 材料与仪器
米根霉、根霉、酒精酵母和酯化酵母 由泸州酿酒研究所提供;标准淀粉糖化酶(活力十万个单位)、聚乙二醇(分子量分别是600、800、1000、2000) 分析纯,阿拉丁;硫酸铵、硫酸镁、磷酸氢二钠 国产分析纯;本次实验所用水 为去离子水。
UV-1100型紫外分光光度计 上海美谱达仪器有限公司;AllegraX-22R型冷冻离心机 美国Beckman Coulter公司;HHS型水浴锅 上海圣欣科学仪器有限公司;FD-2型冷冻干燥机 北京博医康实验仪器有限公司。
1.2 培养基配方
斜面培养基(g/L):马铃薯汁200g,葡萄糖20.0g,KH2PO43.0g,MgSO4·7H2O 1.5g,琼脂20.0g,pH6.00;种子培养基(g/L):马铃薯汁200g,葡萄糖20.0g,KH2PO43.0g,MgSO4·7H2O 1.5g,pH6.00,摇床培养,转速200r/min;发酵培养基(g/L):蛋白胨60.0g,橄榄油20.0g,麦芽糖10.0g,MgSO4·7H2O 0.5g,K2HPO42.0g,pH6.00,摇床培养,转速200r/min。以上培养基均在121℃下灭菌21min。
1.3 实验方法
1.3.1 纯化工艺流程制作PEG1000/(NH4)2SO4相图→培养四种不同的菌株→分别提取粗酶液→配制双水相系统→将酶液与双水相系统混合→漩涡振荡→静置分层→4℃冷冻离心,转速1000r/min,时间2min→静置分层→吸取上下层液体测定酶活值和蛋白质含量→计算分配系数→获得目标酶液。
1.3.2 葡萄糖淀粉酶粗酶液的提取 低温保存的菌株经过平板活化后,接入液体种子培养基培养。按5%的接种量,将种子培养基接入发酵培养基,发酵不同时间后得到葡萄糖淀粉酶的发酵液[15]。将获得的粗酶液用8层纱布过滤,除去大部分的菌丝体。滤液于4℃冷冻离心,转速2000r/min,离心5min,分离上清液4℃贮存备用。提取粗酶液后,为避免污染应尽快进行下一步实验,同时在操作过程中应该避免一些抑制酶活的金属如Fe2+、Cu2+的加入[16]。
1.3.3 葡萄糖淀粉酶活性的测定方法 采用3,5-二硝基水杨酸(DNS)法[17]稍作改进,具体操作如下:称取可溶性淀粉20g缓慢加入100mL沸水中,搅拌至液体澄清透明。待溶液冷却后,用容量瓶定容至100mL。向50mL的比色管中加入25mL的可溶性淀粉溶液,调节pH至4.6,40℃水浴5min。加入1mL活力单位分别为4、8、12、16、20、24U/mL的标准葡萄糖淀粉酶于比色管中。40℃水浴60min后加入200μL浓度为200g/L的NaOH溶液终止反应,并立即冷却。取冷却后的溶液1mL置于另一比色管中,加入2mL的DNS溶液,沸水浴2min后冷却,然后用蒸馏水于定容至25mL,在540nm处测定吸光值,用蒸馏水代替酶液为空白样。
葡萄糖淀粉酶的活力单位:1mL酶液在40℃,pH4.6条件下,1h水解可溶性淀粉产生1mg葡萄糖的酶量为1个酶活力单位(U),以 U/mL表示。
1.3.4 蛋白质含量的测量 采用考马斯亮蓝法测量蛋白质含量[18-20],7支试管中,分别精确吸取0.1mg/mL的牛血清蛋白原液0.20、0.40、0.60、0.80、1.00、1.20、1.40mL,用蒸馏水稀释至2.0mL,然后分别加入5.00mL的考马斯亮蓝溶液,混合均匀,在595nm波长处比色测定,用2.0mL的蒸馏水代替蛋白溶液为空白样。
1.3.5 PEG1000/(NH4)2SO4相图的制作[21-23]称取2.0g PEG1000于50mL的离心管,加入6.0g的去离子水溶解PEG,加入适量硫酸铵,漩涡振荡,使溶液由澄清变为浑浊,出现明显分层现象。记录加入硫酸铵的量,加入1~2g的水,使溶液由浑浊变为澄清,记录加入水的重量。再次加入0.3~0.5g的硫酸铵,使溶液由澄清变为浑浊,重复上诉步骤,记录每次加入硫酸铵和水的质量,根据硫酸铵和PEG的质量分数绘制相图。
1.3.6 双水相萃取方法 用1.3.3和1.3.4的方法测定四种粗酶液的比酶活值和蛋白质含量。在15mL的离心管中配制双水相体系,添加分子量为600、800、1000、2000的PEG为1.8g使PEG的浓度达到15%[24]。加入1.0~2.5g的NaH2PO4、(NH4)2SO4、MgSO4、pH均调节为4.6,准确吸取2mL四种发酵酶液置于15mL的离心管中。漩涡振荡,静置分层。4℃冷冻离心,转速1000r/min,离心2min,离心液静置一段时间直到分层明显。用移液器分别吸取上下层液体各1mL稀释两到三倍后测定葡萄糖淀粉酶的酶活和蛋白质含量。计算分配系数K=下相比酶活/上相比酶活。
2 结果与讨论
2.1 标准曲线的绘制
用紫外分光光度计测540nm处吸光度,绘制酶活-吸光度标准曲线,以酶活为横坐标,吸光度为纵坐标作标准曲线,得到线性方程为y=22.253x+1.6868(R2=0.9990),如图1所示。
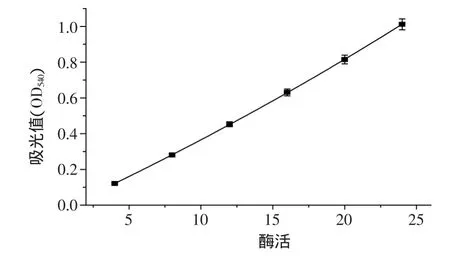
图1 淀粉糖化酶标准曲线Fig.1 Standard curve of glucose amylase
紫外分光光度计在595nm处测吸光度,绘制蛋白质-吸光度的标准曲线,以蛋白质为横坐标,吸光度为纵坐标制作标准曲线,得到线性方程y=0.3158x+0.004(R2=0.9968)。如图2所示。
2.2 PEG1000/硫酸铵相图
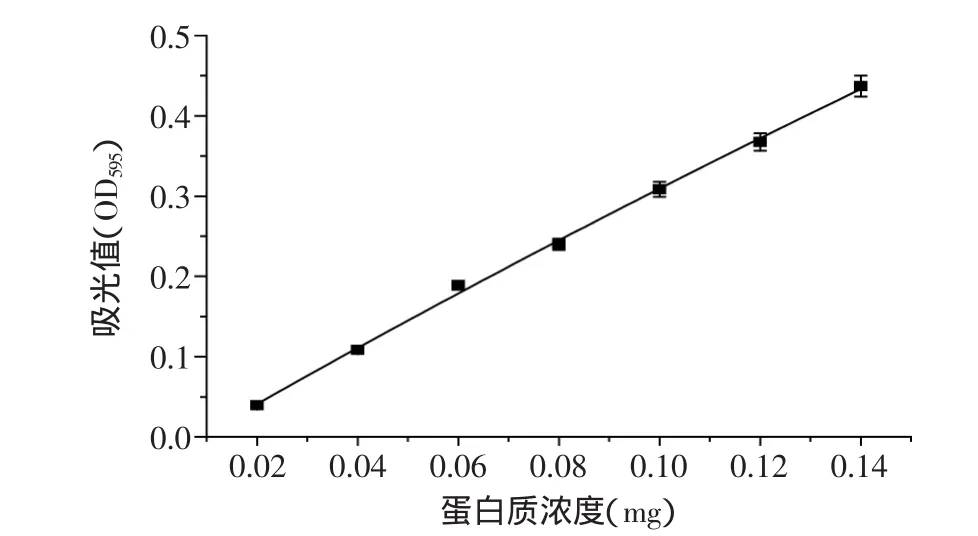
图2 蛋白质标准曲线Fig.2 Standard curve of protein
以PEG的百分比为横坐标,以硫酸铵的百分比为纵坐标,制出相图如图3所示。相图的曲线能用幂函数较好的拟合y=45.224x-0.472,R2为0.9910。
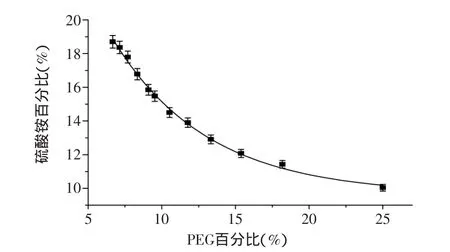
图3 硫酸铵与PEG1000的相图Fig.3 The phase diagram of PEG and(NH4)2SO4
2.3 粗酶液的酶活及蛋白质含量
米根霉、根霉、酒精酵母、酯化酵母粗酶液的酶活和蛋白质测量结果如表1所示。从表1中可以得出,米根霉的蛋白质含量最高,酯化酵母的比酶活最高。说明酯化酵母的淀粉糖化酶粗酶液中所含的杂蛋白相对较少,而米根霉的中杂蛋白相比其他三组偏多。取α=0.05,做显著性分析,得到酶活、蛋白质含量、比酶活的显著性结果见表2~表4。其中p值均小于0.01,且F均比crit大,可以判断四种发酵液的各参数存在显著性差异。

表1 粗酶液的酶活和蛋白质测量结果Table 1 The enzyme activity and protein of crude enzyme
2.4 不同分子量的PEG和盐对分离系数的影响
针对四种不同的葡萄糖淀粉酶发酵液做四种分子量的PEG和三种盐的单因素实验,得到它们对分离系数的影响见图4。PEG为15%,盐的添加量为刚好达到分层的克数,添加过多会破坏蛋白质表面的水化层,而且会扰乱双水相系统,改变各相中成相物质的组成[25]不同盐的添加量有差异,硫酸铵的添加量在1.3~1.8g之间,硫酸镁2.0~2.6g,磷酸二氢钠达到2.7g以上。硫酸铵对根霉的分配系数为0.083,效果较好。硫酸铵和硫酸镁对酒精酵母和酯化酵母的分离效果接近。硫酸镁对米根霉的分离效果明显,分配系数较优都小于0.25,而对酒精酵母均大于0.3。PEG1000对四种酶液的分配系数都小于其他三组,说明PEG1000的分离效果最好。PEG1000对米根霉的分离系数最小达到0.082。

表2 酶活的显著性分析Table 2 Significant analysis of enzyme activity

表3 蛋白质含量的显著性分析Table 3 Significant analysis of protein

表4 比酶活的显著性分析Table 4 Significant analysis of enzyme activity
2.5 不同分子量的PEG和盐对酶活稳定性的影响
分别计算各组上相和下相的比酶活,得到PEG和盐对比酶活的影响如图5。图5中可以明显看出,米根霉和根霉的上下相的比酶活差距很大,而酒精酵母和酯化酵母则相对较小。说明米根霉和根霉的分离效果优于酒精酵母和酯化酵母。米根霉的比酶活最高达到147.16U/mg,根霉的为187.54U/mg,酒精酵母和酯化酵母分别是133.25、247.5U/mg。虽然米根霉和根霉的分离效果优于酵母,但是酯化酵母的粗酶液中的比酶活已经在150U/mg以上,所以即使在分离效果一般的情况下,酯化酵母的比酶活仍然高出其他的酶液。
2.6 蛋白质回收率对比
测量出酶液和纯化之后的蛋白质含量,得到蛋白质回收率如图6。从图6可以看出,米根霉和根霉的蛋白质含量均在0.28mg/mL以上,而酒精酵母和酯化酵母的蛋白质含量平均在0.10mg/mL左右,米根霉、根霉和酒精酵母的蛋白质回收率在70%~87%之间,而酯化酵母则在88%~96%。说明米根霉,根霉,酒精酵母中杂蛋白去除量较多,酯化酵母较少。即杂蛋白含量较少的回收率较高。
2.7 纯化倍数
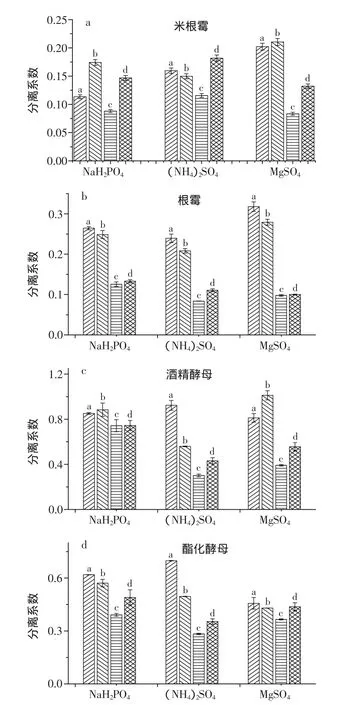
图4 不同分子量的PEG和盐对分离系数的影响Fig.4 The influence of different molecular weight of PEG and salts on the separation factor
测量粗酶液的比酶活和纯化之后的上相比酶活得到纯化倍数如图7所示。PEG600和磷酸二氢钠对酶液的纯化效果相对较差。米根霉的纯化倍数最高为3.35,盐为硫酸镁,PEG分子量为1000。根霉在硫酸铵为添加盐的条件下PEG2000的纯化倍数大于PEG1000的纯化倍数0.4,而PEG2000的分离系数比PEG1000的分离系数仅仅大0.03。为了使酶的纯度提高,所以根霉的最佳PEG的分子量选定为2000。通过以上实验,得到不同酶液的最优提取参数如表5所示。
3 结论

图5 不同分子量的PEG和盐对比酶活的影响Fig.5 The influence of different molecular weight of PEG and salts on the specific activities
通过对米根霉、根霉、酒精酵母和酯化酵母的葡萄糖淀粉酶发酵液的单因素实验,得到米根霉的PEG分子量为1000,添加盐为MgSO422.86%;根霉为PEG2000,盐为(NH4)2SO414.37%;酒精酵母和酯化酵母的PEG均为1000,盐为(NH4)2SO415.73%和(NH4)2SO413.33%。本方法对四种酶液的葡萄糖淀粉酶萃取条件进行优化,获得的最优工艺参数,能有效的减少工艺操作的工作量,为进一步从有针对性的粗酶液中分离纯化葡萄糖淀粉酶奠定基础。
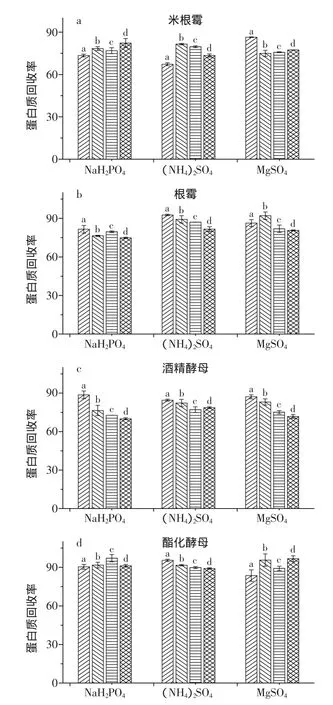
图6 蛋白质回收率Fig.6 Recovery of protein

图7 纯化倍数Fig.7 Purification fold

表5 各酶最优工艺参数Table 5 The optimal process parameters
[1]李彧娜,石贵阳,王武,等.Rhizopus microsporus var.chinensis生淀粉糖化酶的分离纯化及酶学性质[J].应用与环境生物学报,2010(5):714-718.
[2]薛英丽.红曲霉多糖降解酶的研究[D].雅安:四川农业大学,2011.
[3]张文丽,于寒松,朴春红,等.一株高产糖化酶生产菌的筛选与鉴定[J].生物技术通报,2013(7):131-135.
[4]王新惠,李再新,刘达玉,等.米根霉糖化酶酶促反应条件的研究[J].食品科技,2008(5):26-29.
[5]田明玉.双水相萃取白蛋白和酶的初步研究[D].大连:大连理工大学,2009.
[6]齐玉.双水相萃取技术分离提取谷氨酸脱羧酶的研究[D].哈尔滨:东北农业大学,2013.
[7]French A C,Thompson A L,Davis B G.High-purity discrete PEG-oligomer crystals allow structural insight[J].Angewandte Chemie International Edition,2009,48(7):1248-1252.
[8]Chethana S,Nayak C A,Raghavarao K S M S.Aqueous two phase extraction for purification and concentration of betalains[J].Journal of Food Engineering,2007,81(4):679-687.
[9]Yang L,Huo D,Hou C,et al.Purification of plant-esterase in PEG1000/NaH2PO4aqueous two-phase system by a two-step extraction[J].Process Biochemistry,2010,45(10):1664-1671.
[10]Rosso B U,Lima C d A,Porto T S,et al.Partitioning and extraction of collagenase from Penicillium aurantiogriseum in poly(ethylene glycol)/phosphate aqueous two-phase system[J].Fluid Phase Equilibria,2012,335:20-25.
[11]Khadijeh Khederlou,Gholam,Vahid,et al.Measurement and modeling process partitioning of cephalexin antibiotic in aqueous two-phase system containing Poly4000,10000 and K2HPO4,Na3Citrate[J].J Chem Eng,2009,54(8):2239-2244.
[12]Shahla Shahriari,Moanouchehr Vossoughi,Vahid T,et al.Experimental study and mathematical modeling of partitioning of β-amylase and amyloglucosidase in PEG salt aqueous twophase systems[J].J Chem Eng,2010,55(11):4968-4975.
[13]Mona M,Gholamreza P,Manouchehr V,et al.Partitioning of l-lysine monohydrochloride in aqueous two-phase systems of poly and dipotassium hydrogen phosphate or trisodium citrate 5-hydrate[J].J Chem Eng,2010,55(9):3005-3009.
[14]Porfiri M C,Pico G,Romanini D,et al.Aspergillus oryzae alpha-amylase partition in potassium phosphate-polyethylene glycol aqueous two-phase systems[J].International Journal of Biological Macromolecules,2011,49(1):7-13.
[15]汪彬彬,车振明.Plackett-Burman和Box-Benhnken Design实验设计法优化华根霉产糖化酶发酵培养基的研究[J].食品科技,2011(5):41-45.
[16]贺莹.黑曲霉产糖化酶发酵工艺优化及酶学特性研究[D].太原:山西大学,2011.
[17]PolakovicˇM , Bryjak J.Modelling ofpotato starch saccharification by anAspergillusnigerglucoamylase[J].Biochemical Engineering Journal,2004,18(1):57-63.
[18]Bradford M M.Rapid and sensitive method for quantitation of microgram quantities of protein utilizing principle of proteindye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[19]曹稳根,焦庆才,刘茜,等.考马斯亮蓝显色剂变色反应机理的研究[J].化学学报,2002(9):1656-1661,1538.
[20]Silverio S C,Moreira S,Milagres A M,et al.Interference of some aqueous two-phase system phase-forming components in protein determination by the Bradford method[J].Analytical biochemistry,2012,421(2):719-24.
[21]Rahimpour F,PirdashtiM.The effectofguanidine hydrochloride on phase diagram of PEG-phosphate aqueous two-phase system[J].In Proceedings of World Academy of Science,Engineering and Technology,2007(23):124-128.
[22]吕挺.丙烯酰胺在聚乙二醇水溶液中的双水相聚合成滴机理[D].杭州:浙江大学,2010.
[23]张喜峰,马吉福,苏风贤,等.双水相体系萃取分离葡萄酒下脚料中葡萄皮蛋白质[J].食品工业科技,2013,34(1):263-267,272.
[24]杨秋慧子,孙亚莉,张喜峰.双水相体系萃取分离熊猫豆蛋白质[J].食品工业科技,2013,34(9):250-253.
[25]周红航,王维香.聚乙二醇/硫酸铵双水相体系萃取猪胰蛋白酶[J].化工进展,2009(2):305-308,315.
