雷帕霉素对视网膜缺血-再灌注损伤的保护作用△
2014-07-25赵昆黄敏丽王淼刘欣
赵昆 黄敏丽 王淼 刘欣
雷帕霉素对视网膜缺血-再灌注损伤的保护作用△
赵昆 黄敏丽 王淼 刘欣
雷帕霉素;Wistar大鼠; 缺氧诱导因子1α;视网膜缺血-再灌注损伤;细胞凋亡
目的探讨雷帕霉素对视网膜缺血-再灌注损伤(retinal ischemia-reperfusion iniury,RIRI)的保护作用和机制。方法75只SPF级健康雄性Wistar大鼠随机分为3组:空白对照组、实验对照组、实验组,每组25只。实验对照组和实验组行前房灌注建立RIRI模型。实验组在前房灌注前2 h 按2 mg·kg-1剂量腹腔注射雷帕霉素,实验对照组大鼠腹腔注射等量的生理盐水和DMSO。分别在再灌注后0 h、6 h、12 h、24 h、48 h取3组视网膜标本,HE染色法观察视网膜神经节细胞(retinal ganglion cells,RGC)形态及测量视网膜内层厚度;TUNEL法检测视网膜组织中凋亡细胞的表达;Real-time PCR检测缺氧诱导因子1 α(hypoxia-inducible factor 1 α,HIF-1 α)mRNA 在视网膜组织的表达水平。结果再灌注后0 h,实验组视网膜内层厚度为(137.55±7.76)μm,视网膜水肿较实验对照组轻,实验对照组视网膜内层厚度为(162.26±6.41)μm,且实验组RGC空泡化现象较少;再灌注6 h以后实验组视网膜内层厚度均较实验对照组厚(均为P<0.05)。实验组再灌注后12 h、24 h、48 h 的细胞凋亡情况明显低于实验对照组(均为P<0.05)。再灌注后0 h、6 h、12 h、24 h、48 h实验组视网膜组织中HIF-1α mRNA表达水平较实验对照组降低(均为P<0.05)。结论雷帕霉素对RIRI具有保护作用,HIF-1α表达水平的下调可能与该作用有关。
[眼科新进展,2014,34(5):409-413]
视网膜缺血-再灌注损伤(retinal ischemia-reperfusion injury,RIRI)是指视网膜组织缺血、缺氧后恢复血液循环所致的损伤,如视网膜中央动脉阻塞、糖尿病视网膜病变、早产儿视网膜病变等均可导致视网膜血管的阻塞,视网膜缺血和循环障碍均可以导致视网膜的严重损伤[1]。因此积极探索其发病机理、寻找有效的治疗方法防止视网膜缺血再灌注所导致的视神经损害具有重要意义。缺氧诱导因子1α(hypoxia-inducible factor 1 α,HIF-1α)是缺氧条件下广泛存在于哺乳动物和人体内的一种转录因子,能与靶基因结合并通过转录和转录后调控产生相应的生物学效应,使机体在缺氧时产生适应性反应,是哺乳动物和人在缺氧条件下维持氧稳态的关键性物质。大量的研究表明,HIF-1在RIRI中占有重要作用[2]。雷帕霉素是一种新型大环内酯类免疫抑制药物,在中枢神经系统疾病方面可抑制脑细胞凋亡并促进神经细胞的存活,具有明显的神经保护作用[3]。本实验旨在采用雷帕霉素作为保护剂,通过观察RIRI后视网膜组织形态、检测细胞凋亡、HIF-1α mRNA表达情况,探讨其可能的保护作用及机理,为临床应用提供一定的实验依据。
1 材料与方法
1.1材料
1.1.1动物模型及分组广西医科大学动物中心提供的SPF级健康成年雄性Wistar大鼠75只,体质量200~250 g。随机分为空白对照组、实验对照组和实验组,每组25只大鼠。实验组在前房灌注前2 h腹腔注射雷帕霉素(2 mg·kg-1),实验对照组给予等量DMSO和生理盐水腹腔注射。实验组及实验对照组根据缺血后再灌注时间的不同,又分为再灌注后0 h、6 h、12 h、24 h、48 h 5个时间点。
1.1.2主要试剂及仪器雷帕霉素(美国Gene Operation公司),TUNEL试剂盒(德国Roche公司),DAB显色试剂盒(北京中衫金桥生物技术开发有限公司),光学显微镜(Olympus公司),病理图像分析系统(德国LEICA公司)。
1.2方法
1.2.1RIRI模型的建立按3 mL·kg-1的剂量将100 g·L-1水合氯醛腹腔注射对大鼠进行全身麻醉,使用盐酸丁卡因滴眼液对角膜行表面麻醉,复方托吡卡胺滴眼液滴眼散瞳。输液器连接4.5 号针头行右眼前房穿刺,注意不要伤及虹膜和晶状体,生理盐水瓶连接输液器,瓶内液面高度调整在150 cm,检查穿刺口无漏水,此时眼压达到110 mmHg(1 kPa= 7.5 mmHg)左右,可观察到眼底血管断流、视网膜苍白。持续60 min后缓慢降低输液瓶的高度,可见视网膜变红,拔出穿刺针头[4]。
1.2.2标本采集和处理分别于再灌注后0 h、6 h、12 h、24 h、48 h采用腹腔注射过量麻醉处死大鼠,迅速摘除眼球。每组5个时间点各5只眼球以40 g·L-1中性多聚甲醛固定24 h后,酒精梯度脱水,二甲苯透明,石蜡包埋。将包埋好的眼球标本前端以角膜中央定位,后端以视神经根定位,前后方位视网膜全层连续切片,切片厚度4 μm。HE染色,倒置显微镜下观察并拍照。
1.2.3大鼠视网膜内层厚度的测量每只眼球取3张切片进行分析,视网膜内层厚度(指视网膜内界膜到外网状层内缘的距离)为距视盘边缘200 μm处100 μm长度内随机取4点的平均厚度。应用美国Image Pro plus 6.0专业图像分析软件系统进行测定。
1.2.4原位凋亡(TUNEL法)的检测常规二甲苯脱蜡;梯度酒精脱水;体积分数3%H2O2室温封闭10 min;蛋白酶K消化10 min,TUNEL反应液(TdT反应液+标记液)50 μL湿盒37℃孵育60 min,转化剂-POD混合液50 μL湿盒37 ℃孵育30 min,DAB显色,苏木素复染,体积分数1%盐酸酒精分化,烘干,封片。普通光学显微镜下随机选取5个高倍视野(×400),计算视网膜神经节细胞(retinal ganglion cells,RGC)层及内核层凋亡细胞的光密度值(凋亡细胞呈棕黄色),即光密度值=总光密度值/总面积。
1.2.5Real-timePCR检测视网膜中HIF-1αmRNA表达将每组5个时间点5只眼球视网膜取下,置于装有Trizol试剂的EP管中。用超声波粉碎视网膜组织,提取视网膜中的总RNA,用紫外分光光度计测量其浓度及纯度。取2 μg mRNA逆转录为cDNA,再行扩增。Real time PCR反应在LightCycler480Ⅱ系统中进行,反应条件:95 ℃预变性10 min;然后进行40个循环反应(95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸20 s)。HIF-1α mRNA表达量的多少通过与内参β-actin比较来反映。β-actin 上游引物:5’-GTACAACCTTCTTGCAGCTCCTC-3’,下游引物:5’-ACCCATACCCACCATCACACC-3’,扩增片段为199 bp;HIF-1α上游引物:5’-CCAGATTCAAGATCAGCCAGCA-3’,下游引物:5’GCTGTCCACATCAAAGCAGTACTCA3’,扩增片段为100 bp。
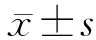
2 结果
2.1大鼠视网膜组织学改变空白对照组大鼠视网膜层次清晰,各层细胞排列整齐密集,结构完整。 实验对照组:缺血再灌注后0 h,视网膜组织水肿,其中神经纤维层与内网状层明显水肿、厚度显著增加,RGC可见空泡、变性;再灌注后6 h视网膜各层明显疏松,排列紊乱,RGC数目减少;再灌注后12 h视网膜水肿已显著减轻,神经纤维层扁平,内核层厚度变薄,RGC排列较稀疏;再灌注后24 h视网膜水肿基本消失,主要表现为RGC数目减少,细胞变性,神经纤维层明显变薄,内核层排列紊乱、轻度变薄,外核层没有明显的变化;再灌后48 h,视网膜内层变薄,可见RGC有较多的缺失。实验组再灌注后0 h视网膜水肿较实验对照组轻,视网膜内层厚度小于实验对照组;再灌后6 h、12 h、24 h、48 h实验组视网膜内层厚度均超过实验对照组,RGC排列较规整(图1)。
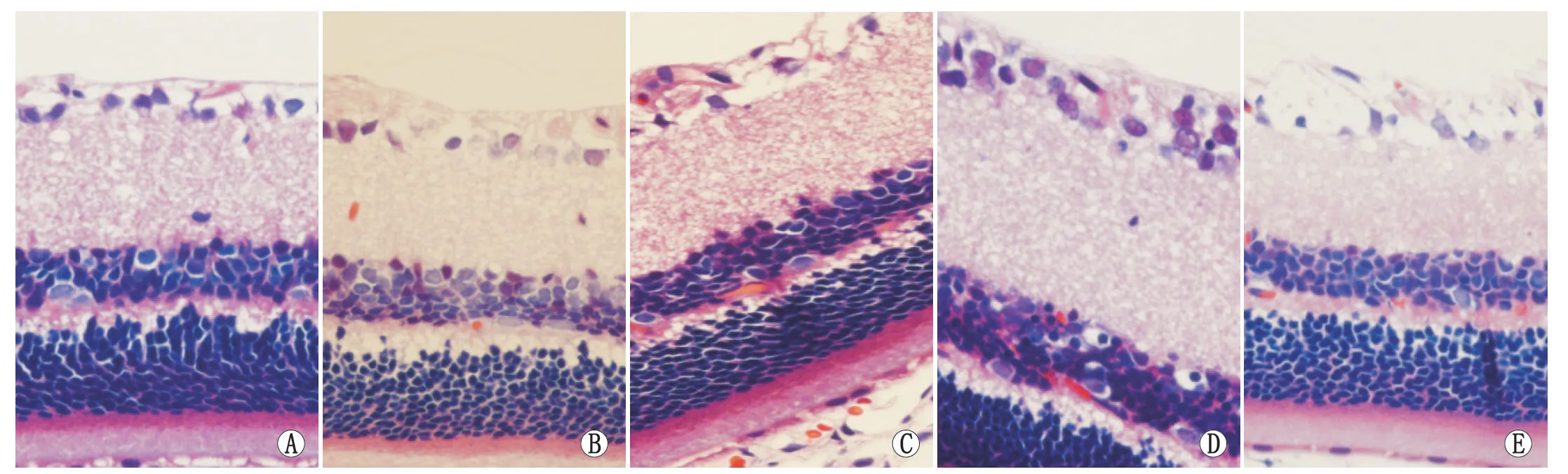
Figure 1 Retinal HE staining (×400).A:Experimental control group at 12 hours after reperfusion;B:Experimental group at 12 hours after reperfusion;C:Experimental control group at 24 hours after reperfusion;D:Experimental group at 24 hours after reperfusion;E:Blank control group 视网膜HE染色结果(×400)。A:再灌注后12 h实验对照组;B:再灌注后12 h实验组;C:再灌注后24 h实验对照组;D:再灌注后24 h实验组;E:空白对照组
2.2大鼠视网膜内层厚度的比较空白对照组大鼠视网膜内层厚度为(104.00±2.78)μm,实验对照组与实验组大鼠再灌后不同时间视网膜内层厚度的比较见表 1,由表1可见:再灌后不同时间实验对照组与实验组大鼠视网膜内层厚度比较,差异均有统计学意义(均为P<0.05)。
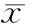
表1 实验组与实验对照组视网膜内层厚度比较Table 1 Comparison of inner retinal layer thickness between experimental group and experimental control group(±s,n=5,l/μm)
2.3TUNEL检测凋亡细胞的表达情况空白对照组TUNEL染色未见明显阳性细胞,再灌注后0 h实验对照组与实验组视网膜凋亡细胞表达比较,差异无统计学意义(P>0.05)。实验对照组再灌注后6 h可见视网膜中出现细胞凋亡,大多位于神经节细胞层;12 h后凋亡细胞阳性表达明显增多;24 h后凋亡细胞阳性表达达顶峰,多见于神经节细胞层和内核层;48 h后凋亡细胞阳性染色开始减少,主要见于RGC层。实验组凋亡改变出现同实验对照组有相似的趋势,再灌注12 h、24 h、48 h凋亡细胞阳性表达明显少于实验对照组,差异均有统计学意义(均为P<0.05;见表2、图2 )。
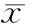
表2 实验组与实验对照组视网膜细胞凋亡比较Table 2 Comparison of positive expression of RGC apoptosis between experimental group and experimental control group(±s,n=5)
2.4Real-timePCR测定视网膜中HIF-1αmRNA的表达在RIRI后,HIF-1α mRNA表达迅速增加,在再灌注后12 h达到高峰,一直持续到再灌注后48 h表达量仍较高。与实验对照组相比,提前给予雷帕霉素(2 mg·kg-1)能够明显抑制HIF-1α mRNA的表达,2组再灌注后0 h、6 h、12 h、24 h及48 h比较,差异均有统计学意义(均为P<0.05,见表3)。
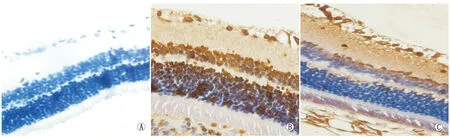
Figure 2 Retinal TUNEL staining at 24 hours after reperfusion (×400).A:Blank control group;B:Experimental control group at 24 hours after reperfusion;C:Experimental group at 24 hours after reperfusion 大鼠再灌注后24 h视网膜TUNEL染色图像(×400)。A:空白对照组;B:实验对照组再灌注后24 h;C:实验组再灌注后24 h
表3 视网膜缺血再灌注后不同时间HIF-1α mRNA表达变化Table 3 Comparison of HIF-1α mRNA expression at different time points after reperfusion between experimental group and experimental control group(±s,n=5)
3 讨论
RIRI可引起自由基、刺激性氨基酸毒性、细胞内钙超载等[5],导致RGC及内核层细胞的凋亡。已有研究观察到升高眼压可引起大鼠RIRI模型中超微形态学变化,表明RGC层和内核层中存在细胞凋亡[6]。本实验中我们应用TUNEL法观察RIRI细胞凋亡发生的情况,再灌注后6 h可见视网膜中出现细胞凋亡,大多位于RGC层;再灌注后12 h视网膜细胞凋亡开始增多,24 h后凋亡细胞阳性表达达顶峰,多见于RGC层和内核层;48 h后凋亡细胞阳性染色开始减少,主要见于RGC层;这与其他学者的研究结果相似[7]。因此,抑制RGC的凋亡、促进RGC的存活是RIRI发生后要解决的关键问题。本实验也表明,RIRI后大鼠RGC大量丢失。
HIF-1是低氧条件下广泛存在于哺乳动物和人体内的转录因子,HIF-1由 HIF-1α和HIF-1β两亚单位组成,HIF-1的调节受到多种因素的影响,HIF-1的稳定和活性主要是由 HIF-1α决定的,且HIF-1α是专一受氧调节的亚基,调控着下游众多基因,其靶基因主要包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、红细胞生成素(erythropoietin,EPO)、糖酵解酶、环氧合酶(cyclooxygenasa,COX),影响细胞凋亡因子p53等的转录和表达[8],HIF-1调控的基因以不同的方式参与细胞对缺氧的适应过程,从而增加了细胞在缺氧环境下的生存能力。视网膜细胞代谢的最大特点是耗氧量大,对缺氧特别敏感,在正常氧条件下,HIF-1α在视网膜中表达极低。Kaur等[9]观察发现大鼠视网膜缺氧之后,视网膜神经胶质细胞中HIF-1α mRNA表达增加。此外,HIF-1还参与热休克蛋白的表达调节,研究发现缺氧可明显增加大鼠视网膜神经中细胞HIF-1蛋白的表达[10],并调控其下游基因p53的表达,缺氧是p53最强的生理性诱导剂,在缺氧情况下,去磷酸化的HIF-1α通过与p53结合介导缺氧情况下p53依赖的凋亡。HIF-1和p53在缺氧诱导性的迟发性神经元死亡中起着关键作用,两者共同控制着缺氧诱导性神经元死亡[11],HIF-1α在缺血性视网膜病变中对视网膜神经细胞可能起着相似的作用。袁海虹等[12]在大鼠RIRI模型研究中采用免疫组织化学及RT-PCR发现,HIF-1α的表达增加与损伤后的视网膜细胞凋亡率呈正相关,推测其表达可能与视网膜细胞的凋亡有密切关系。最近新的研究证明,以HIF-1α作为靶点治疗缺氧性视网膜疾病取得了相应的成果[13]。本实验通过建立RIRI的模型初步证明,雷帕霉素发挥抗凋亡作用是通过减少HIF-1α表达来完成的。
雷帕霉素是20世纪70年代初由加拿大Ayerst研究所从放线菌培养液中分离出来的大环内酯类抗生素。雷帕霉素有特异性抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的作用[14]。mTOR是一种重要的信号转导分子,参与多种生理及病理过程,其通过调控多种靶向分子达到促进蛋白质合成的作用,主要靶向点在翻译及转录这两个关键环节,以实现对细胞生长、增殖及分化、凋亡的调控[15-18]。mTOR 下游靶点p70S6K 及4E-BP1 均与蛋白合成速率密切相关,提示mTOR 可能影响应激下的蛋白合成。由于神经修复过程中神经细胞存活与正常蛋白合成速率有关,mTOR可感受细胞外应激,从而通过补偿减少的蛋白合成来参与神经修复机制。由于mTOR自噬的负性调控,抑制mTOR信号通路后会导致自噬性细胞死亡[19]。Srinivas等[20]假设自噬是由AMPK及mTOR的活化调节的,并且是依赖于HIF-1α的方式,并提供了实验证据。雷帕霉素可以抑制细胞周期蛋白依赖性激酶的活化和抑制细胞周期进展,使细胞停止增殖并最终凋亡。Zhao等[21]研究表明,通过减弱mTOR介导的应激性视网膜色素细胞功能缺失,雷帕霉素提高和促进了视网膜退行性疾病模型中光感受器数量及功能。Chen等[3]通过建立大鼠脑缺氧缺血模型,证实腹腔注射雷帕霉素可以阻断mTOR信号通路,调节HIF-1α和VEGF表达来抑制神经细胞凋亡。mTOR信号通路可能通过影响HIF-1α的表达,进而调节细胞的凋亡及细胞自噬等生物过程。
本实验选择雷帕霉素作用于RIRI模型,HE染色法观察RGC形态,TUENL法检测细胞凋亡情况及PCR法测定HIF-1α mRNA的表达,依此来研究雷帕霉素对RIRI后RGC存活的影响,并初步探讨产生这一作用的机制。本实验HE染色结果显示,实验对照组RIRI后0 h即可见视网膜组织水肿、疏松,24 h时可见视网膜有明显的病理改变。而实验组中再灌注后0 h视网膜水肿明显减轻,TUNEL阳性细胞明显减少。另外,从Real time-PCR检测结果中可见,RIRI后大鼠HIF-1α mRNA表达增加,雷帕霉素能够通过抑制HIF-1α mRNA的表达而促进RGC的存活。
综上所述,雷帕霉素对RIRI具有保护作用,可能与其下调HIF-1α mRNA表达及抗凋亡作用相关。但因RIRI后细胞凋亡反应机制复杂,而雷帕霉素能通过多条途径抑制视网膜细胞的凋亡,其具体机制有待进一步探讨。
1 Perlman JI,McCole SM,Pulluru P,Chang CJ,Lam TT,Tso MO.Disturbances in the distribution of neurotransmitters in the rat retina after ischemia[J].CurrEyeRes,1996,15(6):589-596.
2 Lukiw WJ,Ottlecz A,Lambrou G,Grueninger M,Finley J,Thompson HW,etal.Coordinate activation of HIF-1 and NF-κB DNA binding and COX-2 and VEGF expression in retinal cells by hypoxia[J].InvestOphthalmolVisSci2003,44(10):4163-4170.
3 Chen H,Xiong T,Qu Y,Zhao F,Ferriero D,Mu D.mTOR activates hypoxia-inducible factor-1α and inhibits neuronal apoptosis in the developing rat brain during the early phase after hypoxia-ischemia[J].NeuroscienceLetters,2012,507(2):118-123.
4 代艳,陈晓明,陈小虎.雌激素对鼠视网膜缺血再灌注所致视网膜损伤的保护作用[J].中华眼底病杂志,2005,21(3):177-179.
5 Toriu N,Akaike A,Yasuyoshi H,Zhang S,Kashii S,Honda Y,etal.Lomerizine,a Ca2+channel blocker,reduces glutamate-induced neurotoxicity and ischemia/reperfusion damage in rat retina[J].ExpEyeRes,2000,70(4):475-484.
6 Buchi ER.Cell death in the rat retina after a pressure-induced ischaemia-reperfusion insult:an electron microscopic study.I.Ganglion cell layer and inner nuclear layer[J].ExpEyeRes,1992,55(4):605-613.
7 李艳,李贵仁,康凤英.缺血再灌注大鼠视网膜诱导型一氧化氮合酶与细胞凋亡的研究[J].眼科新进展,2005,25(6):452-454.
8 Greijer A,Van der Wall E.The role of hypoxia inducible factor 1(HIF-1)in hypoxia induced apoptosis[J].JClinPathol,2004,57(10):1009-1014.
9 Kaur C,Sivakumar V,Foulds WS.Early response of neurons and glial cells to hypoxia in the retina[J].InvestOphthalmolVisSci,2006,47(3):1126-1141.
10 张薇,李若溪,许建华,刘哲丽.低氧条件下大鼠视网膜 HIF-1α 及 P53 的表达及相关分析[J].国际眼科杂志,2006,6(4):795-797.
11 Halterman MW,Miller CC,Federoff HJ.Hypoxia-inducible factor-1alpha mediates hypoxia-induced delayed neuronal death that involves p53[J].JNeurosci,1999,19(16):6818-6824.
12 袁海虹,周薇,包辉英,谭攀攀,祝肇荣,吴国忠.缺血再灌注损伤后大鼠视网膜细胞凋亡与低氧诱导因子 1α 表达的关系[J].上海交通大学学报:医学版,2012,31(12):1697-1701.
13 Xin X,Rodrigues M,Umapathi M,Kashiwabuchi F,Ma T,Babapoor-Farrokhran S,etal.Hypoxic retinal Müller cells promote vascular permeability by HIF-1-dependent up-regulation of angiopoietin-like 4[J].ProcNatlAcadSciUSA,2013,110(36):3425-3434.
14 Yang Q,Guan KL.Expanding mTOR signaling[J].CellRes,2007,17(8):666-681.
15 Sarbassov DD,Guertin DA,Ali SM,Sabatini DM.Phosphorylation and regulation of Akt/PKB by the rictor-mTOR complex[J].Science,2005,307(5712):1098-1101.
16 Guertin DA,Sabatini DM.An expanding role for mTOR in cancer[J].TrendsMolMed,2005,11(8):353-361.
17 牛慧彦,王鑫,张萌,王佳贺,何平.雷帕霉素联合多西紫杉醇对肺癌细胞增殖和凋亡的影响[J].新乡医学院学报,2012,29(1):23-25.
18 竺红宇,李军川,陈廷煊,邹兰英,王晓艳,赵会传,等.胃肠间质瘤危险性分级与哺乳动物雷帕霉素靶蛋白和磷酸化哺乳动物雷帕霉素靶蛋白表达的关系[J].新乡医学院学报,2013,30(2):98-100.
19 Jung CH,Jun CB,Ro SH,Kim YM,Otto NM,Cao J,etal.ULK-Atg13-FIP200 complexes mediate mTOR signaling to the autophagy machinery[J].MolBiolCell,2009,20(7):1992-2003.
20 Srinivas V,Bohensky J,Shapiro IM.Autophagy:a new phase in the maturation of growth plate chondrocytes is regulated by HIF,mTOR and AMP kinase[J].CellsTissuesOrgans,2008,189(1-4):88-92.
21 Zhao C,Yasumura D,Li X,Matthes M,Lloyd M,Nielsen G,etal.mTOR-mediated dedifferentiation of the retinal pigment epithelium initiates photoreceptor degeneration in mice[J].JClinInvest,2011,121(1):369-383.
date:Jan 16,2014
Natural Science Foundation of Guangxi(No:2010GXNSFA013140)From theDepartmentofOphthalmology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,GuangxiZhuangAutonomousRegion,China
Protective effects of raamycin on retinal ischemia-reperfusion injury of rats
ZHAO Kun,HUANG Min-Li,WANG Miao,LIU Xin
rapamycin;wistar rat;hypoxia-inducible factor 1α;retinal ischemia-reperfusion injury;cell apoptosis
Objective To study the protective effects and its mechanism of rapamycin (RAPA) on retinal ischemia-reperfusion injury (RIRI) of rat.Methods Seventy-five SPF healthy male rats were random divided into three groups:blank control group,experimental control group and experimental group,25 rats in each group.RIRI models were induced in experimental control group and experimental group by increasing intraocular pressure via an intracameral catheter.The rats in experimental group underwent the intraperitoneal injection with PAPA (2 mg·kg-1) 2 hours before retinal ischemia,and the experimental control group with normal sodium and DMSO.The retinal specimens of three groups were taken at 0 hour,6 hours,12 hours,24 hours and 48 hours after reperfusion.The morphology of retinal ganglion cells (RGC) and inner retinal layer thickness were observed or measured by HE staining,TUNEL technique was used to examine the apoptosis of RGC,and the level of hypoxia-inducible factor 1α mRNA in retinal tissue was analyzed by real-time PCR assay.Results At 0 hour after reperfusion,the inner retinal layer thickness in experimental group and experimental control group were (137.55±7.76)μm and (162.26±6.41)μm,the retinal edema in experimental group was less than that in experimental control group,and the vacuolar phenomenon of RGC was also less.At 6 hours later after reperfusion,the inner retinal layer thickness of experimental group were greater than that of experimental control group (allP<0.05).At 12 hours,24 hours and 48 hours after reperfusion,the apoptotic cells in experimental group were obvious less than those in experimental control group (allP<0.05).The expressions of hypoxia-inducible factor 1α mRNA at 0 hour,6 hours,12 hours,24 hours and 48 hours after reperfusion in experimental group were obvious lower than those in experimental control group (allP<0.05).Conclusion RAPA can protect the retina against RIRI,and the down-regulation of hypoxia-inducible factor 1α may be involved in the mechanism of the protection.
赵昆,男,1987年8月出生,在读硕士研究生。研究方向:玻璃体视网膜疾病及复杂性眼外伤。联系电话:18776169642;E-mail:zhaokun870624@126.com
AboutZHAOKun:Male,born in August,1987.Postgraduate student.Research direction:Vitreoretinal diseases and ocular trauma.Tel:18776169642;E-mail:zhaokun870624@126.com
2014-01-16
广西自然科学基金资助(编号:2010GXNSFA013140)
530021 广西壮族自治区南宁市,广西医科大学第一附属医院眼科
黄敏丽, E-mail:nnhml@163.com
赵昆,黄敏丽,王淼,刘欣.雷帕霉素对视网膜缺血-再灌注损伤的保护作用[J].眼科新进展,2014,34(5):409-413.
��
10.13389/j.cnki.rao.2014.0113
修回日期:2014-02-20
本文编辑:方红玲
Accepteddate:Feb 20,2014
Responsibleauthor:HUANG Min-Li,E-mail:nnhml@163.com
[RecAdvOphthalmol,2014,34(5):409-413]
