软骨细胞膜片修复山羊气管的实验研究
2014-07-25陶然刘浥陈洁何爱娟周广东曹谊林
陶然 刘浥 陈洁 何爱娟 周广东 曹谊林
2008年,Macchiarini等[1]采用“异体脱细胞气管+自体骨髓间充质干细胞”构建了首例人组织工程气管,并成功完成了人体移植,证实了组织工程方法构建人体气道移植物的可行性。但该方法远期效果并不理想[2]。研究发现,人脱细胞气管在PBS里连续浸泡1年后其力学性能明显下降[3]。因此,“异体脱细胞气管+自体骨髓间充质干细胞”并非最理想的方法,还有很多困难需要克服。
本实验室在前期研究中用“PGA支架+自体软骨细胞”构建的组织工程气管修复了兔长段气管缺损,并实现了实验动物的长期存活[4]。但是传统的“支架材料+自体软骨细胞”的模式因支架材料免疫排斥等在大动物模型上(山羊)无法成功,而无支架软骨细胞膜片却能在大动物体内形成健康成熟的软骨组织[5]。由于气道与外界连通,内壁有病原微生物附着,并在内外气压不断变化下始终处于活动状态。虽然软骨组织对血供的要求较低,异位游离移植容易存活[6]。为了探索软骨细胞膜片构建软骨组织修复大动物气管缺损的可行方式,我们设计了本实验。
1 材料与方法
1.1 实验动物及试剂
6只山羊(上海甲干生物科技有限公司),平均体质量20.0±3 Kg。膜片体外培养6周后,将4张膜片重叠植入相应动物左侧腹部皮下。膜片在体内培养8周后,将形成的组织取出,其中3例包裹在与实验动物气管直径一致的硅胶管上,植入实验动物颈部气管旁肌肉中进行血管化及塑形(带蒂移植组,PT组);另外3例在腹部皮下培养16周后直接用于修复气道缺损(游离移植组,DT组)。每组实验动物均切除3个完整的气管环。依照实验动物保护指南,所有动物都获得了人道主义对待。
胰蛋白酶(美国Hyclone公司);Ⅱ型胶原酶(美国Worthington公司);高糖DMEM(美国Gibco公司);胎牛血清(美国Hyclone公司)。
1.2 原代细胞分离及扩增
原代细胞的获取方法同前期实验[5]。每只山羊取约2.0 cm×2.0 cm大小的耳廓软骨,将软骨块剪碎,用0.25%胰蛋白酶震荡消化30 min,加入0.15%Ⅱ型胶原酶,震荡消化10~12 h。获得的消化液用100 μm细胞滤网过滤后离心,去上清,沉淀的细胞用高糖DMEM重悬,混悬液按1×104cells/cm2的浓度接种在100 mm培养皿上。在37℃、5%CO2、饱和湿度条件下,用含10%胎牛血清、2 ng/mL碱性成纤维细胞生长因子、1%青霉素及链霉素的DMEM培养基培养扩增,待软骨细胞生长至70%~80%融合时进行传代。
1.3 细胞膜片制备
在传代过程中,留取一皿第2代细胞继续培养,直至制备细胞膜片。将软骨细胞培养至第4代,消化,离心,重悬,以8×105cells/cm2浓度接种于之前留取的第2代细胞上,以软骨组织培养液培养,隔天换液。体外培养6周时可以于培养皿中揭起直径100 mm的软骨细胞膜片。每只实验动物制作4张同样大小的细胞膜片备用。
1.4 细胞膜片体内培养
麻醉实验动物、备皮,取右侧卧位,暴露左侧腹部,在左侧腹部作一约8 cm切口,进入皮下浅筋膜层,剥离皮下组织,术中妥善止血,保持术野干净,形成能容纳直径100 mm细胞膜片的袋状空腔。将体外培养6周的4张细胞膜片从培养皿上剥离,PBS洗净,叠加在一起植入袋状空腔中,无出血后分层缝合切口,术区用腹带加压包扎,7 d后拆除腹带。
1.5 皮下形成组织颈部血管化及再塑形
对于带蒂移植组,膜片在皮下培养8周后,将形成的组织取出,包裹在和羊气管大小相近的硅胶管外,一同植入颈部气管旁肌肉中,使其血管化和再塑形。对于游离移植组,膜片继续在皮下培养至16周。
1.6 气管缺损造模及气道修复重建
对于带蒂移植组,待软骨片在颈部埋植8周后,将实验动物全麻,仰卧位,行气管插管术。直视下沿颈正中线切开皮肤,分离皮下组织直至暴露气管。在气管旁探查,暴露并游离组织工程软骨,保留部分肌肉蒂。移除硅胶管,检查组织工程软骨管的强度和弹性。切除3个完整的气管软骨环,但是保留其后壁的平滑肌,然后用组织工程软骨修复缺损。术后在修复段近心端吻合口下方2.5 cm处置入T型气道支撑管,使T型管长端越过上端吻合口,以辅助吻合口渡过愈合期。
对于游离移植组,将体内培养16周的软骨样组织取出,同样在保留气管后壁平滑肌的基础上切除3个完整的气管软骨环,然后用该软骨样组织游离移植修复缺损气道,并置入T型管。
1.7 术后观察及评估
术后评估实验动物的整体健康状况,重点关注气道分泌物的量和颜色,以及实验动物的呼吸状况。如分泌物过多,或出现阻塞气道的情况,可用吸痰管吸除分泌物,通畅气道。在气道重建术后14周拔出T型管。如拔管后实验动物出现无法纠正的呼吸困难,按照善待实验动物的规定,对其进行安乐死。
2 结果
体外培养6周后,从培养皿上能揭起完整的膜片,组织学染色可确定为较成熟的软骨组织(图1)。
将4张膜片叠加在一起植入动物腹部皮下。皮下培养8周后,6只实验动物体内构建的组织大体观察和组织学观察都显示明显的软骨组织特征,且构建的软骨样组织具有较好的弹性和韧性,能固定在硅胶管上(图2)。
带蒂移植组软骨样组织埋植在颈旁肌肉内8周后,和周围的肌肉组织长在一起,形成了带肌肉蒂的组织工程软骨管。组织学发现该组织具有典型的软骨特征,并和周围的肌肉组织建立了血供。抽出硅胶管,软骨管依然能保持通畅的管腔。切除3个完整的气管软骨环,用带肌肉蒂的组织工程软骨管修复气管缺损。对于游离移植组,将腹部取出的软骨片直接缝合在缺损段气道上,缺损同样为3个完整的气管软骨环(图3)。
带蒂移植组在气道有T型管支撑的情况下能长时间存活(14周),但在拔出T型管2周内均因严重的呼吸困难而死亡。呼吸困难的主要原因是气道塌陷和内壁纤维结缔组织增生。取材观察发现,带蒂移植组气管修复段后壁明显塌陷,塌陷处为颈部再血管化前,硅胶管上未被软骨样组织完全包裹的部位,而修复段纵切面内壁有严重的纤维结缔组织增生,这是引起实验动物出现呼吸困难的2个主要原因。虽然实验动物没能在拔出T型管后长期存活,但是我们发现修复段组织外壁为连续成熟的软骨组织,且此处未发生明显的塌陷,说明了气道外壁的软骨组织对维持气道力学强度的重要性(图4)。
虽然同样在气管修复术后置入了T型管,但游离移植组术后存活时间均小于2周,死亡原因主要是修复段组织坏死引起严重的局部感染,并有2例在修复段出现了气管瘘。大体观和组织学发现,该组修复段均为坏死组织或纤维结缔样组织,并伴有大量的炎症细胞浸润,仅能在局部观察到小范围散在的软骨样组织(图4)。

图1 体外培养的无支架软骨细胞膜片及其组织学观察(标尺:100 μm)Fig.1Gross and histological observation of chondrocytes cell-sheet(Bar:100 μm)

图2 膜片体内培养8周的大体观及组织学观察(标尺:100 μm)Fig.2Gross view and histological observation of cell sheets after cultured in superficial fascia layer for 8 weeks in vivo(Bar:100 μm)

图3 带蒂修复组和游离移植组气管缺损修复Fig.3Trachea reconstruction in both PT group and DT group
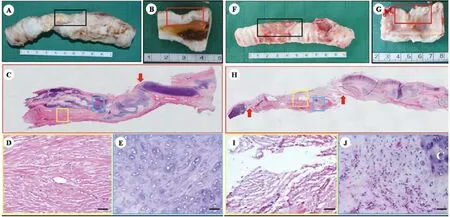
图4 带蒂修复组和游离移植修复组取材大体观及组织学观察(标尺:100 μm)Fig.4Gross and histological observation of reconstructed segments of each group(Bar:100 μm)
3 讨论
长段气管缺损一直是修复难点。当气管缺损长度大于6 cm或多于4~5个气管环的时候,就需要借助移植物来完成修复。目前临床上尚无修复效果稳定可靠的移植物,而以自体细胞为种子细胞来源,采用组织工程学方法构建的软骨组织具有排异反应小,能模拟气道解剖学结构,实现气道生理功能等优点。本实验中所有膜片植入动物皮下后均形成了成熟的软骨样组织,说明无支架软骨细胞膜片技术是一种稳定可靠的成软骨方法,且软骨样组织在血供充足的条件下能满足气道修复的力学要求。
本实验中,将腹部皮下形成的软骨样组织移植到颈旁肌肉后,软骨组织并未出现缺血性坏死,其软骨特征也没发生明显变化,这是因为软骨组织与其他正常组织相比对血供营养的要求较低,所以游离移植的软骨组织在和周围组织建立血供的过程中不容易发生缺血性坏死[6]。但是,由于气道是开放环境,其内壁有大量的病原微生物存在,且软骨组织血供尚未完全建立,不具备足够的抗病原微生物能力。如果将组织工程软骨直接用于游离移植修复气道缺损,可能在血供缺乏和病原微生物的双重作用下发生坏死。游离移植组的结果证实了我们的推测。游离移植组修复段组织中仅能见到少量散在的软骨组织,其余大部分为伴有大量炎症细胞浸润的坏死组织和纤维结缔组织。而带蒂移植组腹部皮下形成的组织工程软骨游离移植到颈部后,并未发生缺血性坏死,组织学特征也未发生明显变化。当抽出硅胶支撑管后,整个软骨管保持了相当好的弹性和支撑力,能维持管腔通畅。但是,实验初期我们遗漏了一个重要细节,在气道修复手术时我们发现,带蒂移植组第一只接受修复手术的动物,构建的软骨管较其气道直径短约21%(此时羊气道直径约为14 mm,软骨管直径约为11 mm)。这是因为在组织工程软骨管颈部再血管化时,实验动物尚处于发育期,虽然当时构建的软骨管和气道直径一致,但到8周后行气管修复手术时软骨管就相对偏细了。在后面的实验中我们及时修正了这个问题,构建的软骨管充分考虑了实验动物的气道发育问题。
术后带蒂移植组能带T管长期生存(14周),但是一旦拔出T型管,实验动物在2周内会出现逐渐加重的呼吸困难,并死亡(或被迫实行安乐死)。从修复段气道取材大体结果来看,修复段后壁出现了严重的塌陷。此部位是颈部再血管化时硅胶管未被软骨包裹的部位,而有软骨包裹的部位(修复段前壁)却保持了完好的弧形外表面。病理结果也显示,修复段前壁有连续的软骨样组织,而后壁均为纤维结缔组织。这也证实了软骨化的外壁对维持气道力学性能的重要性[7]。此外,修复段气管大体观和组织学均显示管腔内纤维结缔组织增生十分严重。研究认为,气道内壁纤维结缔组织增生和气道上皮未覆盖或上皮功能减退有很强的相关性[8-10]。气道上皮的存在不仅可以降低细菌、真菌污染的概率,同时还能抑制纤维结缔组织增生[7]。而且仅有软骨外壁而无上皮化的内壁,这样的结构也并不符合气道的解剖学特点和生理学特性。所以,要成功修复长段气管缺损,实现大型实验动物长期存活,如何构建完整的软骨外壁以及内壁提前(或尽快)上皮化将成为该方法最终能否成功的关键。目前,用组织工程技术构建了可以用来直接覆盖气道移植物内腔的组织工程上皮取得了不错的效果[10-11],提示可在修复手术前先实现软骨管内壁上皮化,以有利于术后修复段气管快速恢复功能,避免内壁纤维结缔组织增生。另外,也有在气管移植中把受体患者自体口腔黏膜上皮缝合在移植气管内表面代替气道上皮[6]。口腔黏膜上皮不仅能临时替代气道上皮,而且口腔黏膜成纤维细胞能显著促进气道上皮细胞的再生[8],最后,这些非柱状上皮的腔内覆盖物在移植后会逐渐被受体气管纤毛柱状上皮所取代[12]。
综上所述,我们认为①细胞膜片技术是一种稳定可靠的组织工程软骨构建技术;②组织工程管状软骨的力学特性完全能满足气道修复的需要;③游离移植的软骨组织在气道的复杂环境中难以存活;④带蒂移植修复是保证组织工程软骨存活的关键因素。后续研究中,在构建软骨管时,我们将保持其外壁的完整性,这需要进一步增大构建软骨的尺寸;另外,应提前(或尽快)实现软骨管内壁上皮化,这是避免内壁结缔组织增生,维持管腔通畅的重要方法。
[1]Macchiarini P,Jungebluth P,Go T,et al.Clinical transplantation of a tissue-engineered airway[J].Lancet,2008,372(9655):2023-2030.
[2]Vogel G.Trachea transplants test the limits[J].Science,2013,340(6130):266-268.
[3]Baiguera S,Del Gaudio C,Jaus MO,et al.Long-term changes to invitropreservedbioengineeredhumantracheaandtheir implications for decellularized tissues[J].Biomaterials,2012,33(14):3662-3672.
[4]Luo X,Liu Y,Zhang Z,et al.Long-term functional reconstruction of segmental tracheal defect by pedicled tissue-engineered trachea in rabbits[J].Biomaterials.2013;34(13):3336-3344.
[5]陶然,刘浥,殷宗琦,等.利用软骨细胞膜片技术在山羊皮下构建软骨样组织的研究[J].组织工程与重建外科,2013,9(2):61-65.
[6]Delaere P,Vranckx J,Verleden G,et al.Tracheal allotransplantation after withdrawal of immunosuppres sive therapy[J].N Engl J Med,2010,362(2):138-145.
[7]Go T,Jungebluth P,Baiguero S,et al.Both epithelial cells and mesenchymal stem cell-derived chondrocytes contribute to the survival of tissue-engineered airway transplants in pigs[J].J Thorac Cardiovasc Surg,2010,139(2):437-443.
[8]Kobayashi K,Suzuki T,Nomoto Y,et al.Potential of heterotopic fibroblasts as autologous transplanted cells for tracheal epithelial regeneration[J].Tissue Eng,2007,13(9):2175-2184.
[9]Vrana NE,Lavalle P,Dokmeci MR,et al.Engineering functional epithelium for regenerative medicine and in vitro organ models:a review[J].Tissue Eng Part B Rev,2013,19(6):529-543.
[10]Zani BG,Kojima K,Vacanti CA,et al.Tissue-engineered endothelial and epithelial implants differentially and synergistically regulate airway repair.Proceedings of the national[J].Proc Natl Acad Sci USA,2008,105(19):7046-7051.
[11]Kanzaki M,Yamato M,Hatakeyama H,et al.Tissue engineered epithelial cell sheets for the creation of a bioartificial trachea[J].Tissue Eng,2006,12(5):1275-1283.
[12]Spaggiari L,Calabrese LS,D'Aiuto M,et al.Successful subtotal tracheal replacement(using a skin/omental graft)for dehiscence after a resection for thyroid cancer[J].J Thorac Cardiovasc Surg,2005,129(6):1455-1456.
