中华鳖嗜水气单胞菌微球缓释疫苗的研制及免疫效果
2014-07-24刘亚东李彬高利伟管越强
刘亚东,李彬,高利伟,管越强
(河北大学 生命科学学院,河北 保定 071002)
嗜水气单胞菌(Aeromonas hydrophila,Ah)是一种人畜共患的病原菌[1].自中华鳖Pelodiscus sinensis病灶部位分离出来的致病性Ah能引起多种疾病,如红脖子、红底板、出血性败血症、疖疮穿孔病和腐皮病等,是最常见且危害最严重的一种中华鳖病原菌,也是制约养殖业发展的主要原因之一[2-6].在中华鳖Ah病防治过程中,最有效的途径之一是疫苗免疫.研究结果显示,对中华鳖进行Ah灭活疫苗注射免疫后,再用同源菌攻毒,保护率为80%[7].利用提纯的致病性Ah外毒素灭活后免疫大白兔,制备免疫血清免疫中华鳖,攻毒后免疫保护率大于75%[8].采用Ah和温和气单胞菌Aeromonas sobria 制成化学成分疫苗,注射免疫的中华鳖攻毒后保护率达到了87.5%[9].
注射法是中华鳖等水产动物免疫防治中最常用的一种方式,但实际操作中工作量较大,往往对养殖动物造成应激反应,且不适于幼龄阶段,而其他免疫方法如口服灭活疫苗或浸浴的免疫效果又不尽人意.一些具有良好的生物相容性和生物可降解性的高分子聚合物材料[10],作为载体包裹疫苗制成缓释微球疫苗进行口服免疫是提高免疫效果的途径之一,该方法已开始用于人类和其他动物疾病的治疗和预防工作中[11-13].在中华鳖疾病防治过程中,利用温和气单胞菌制成的微球缓释疫苗免疫中华鳖后,免疫效果明显高于灭活菌液注射组[14].如前所述,Ah是中华鳖养殖中最常见、危害最严重的一种病原菌,但迄今尚未见到其缓释疫苗应用于中华鳖免疫防治的研究报道.本实验将灭活Ah制成微球缓释疫苗,采用灌胃法对中华鳖进行口服免疫防治,同时与注射法比较,对其免疫应答进行了研究,并进行攻毒实验研究其免疫保护率,旨在探索中华鳖Ah病的免疫防治新途径,为中华鳖细菌性疾病防治研究提供参考.
1 材料与方法
1.1 灭活菌液的制备
自河北省阜平县中华鳖养殖水体取水样,氨苄青霉素麦康凯琼脂基础培养基分离Ah,液体培养基培养24h,经菌落、菌体形态鉴定、生理生化特征分析及16SrDNA 分析等将其鉴定为Ah.采用倍比稀释法测定菌悬液中的细菌质量浓度.扩大培养后的原菌液用体积分数0.2%甲醛灭活,将灭活的菌液涂于琼脂基础培养基,37 ℃培养24h,观察是否有菌落生成,以判断菌体灭活效果.
1.2 缓释微球的制备、包封及体外释放情况的测定
1.2.1 复乳化-溶剂挥发法制备缓释微球疫苗
精确称取1.2g聚乳酸-羟基乙酸共聚物(PLGA)加入到10mL二氯甲烷中使其完全溶解,然后再缓慢滴加灭活原菌液2mL,超声波乳化1min,以便菌液与PLGA 充分混合,将乳化液加入到体积分数为2%的聚乙烯醇(PVA)溶液中,不断高速搅拌2min,转至低速慢搅6h直至二氯甲烷完全挥发,用蒸馏水洗3次,真空冷冻干燥[15]后即可得到制备好的缓释微球.
1.2.2 缓释微球包封情况的测定
首先将灭活菌液稀释至1×106/mL,再依次进行10倍梯度稀释直至1×102/mL,得到6种不同浓度的菌液,1 200r/min离心10min,取沉淀用蒸馏水溶解分散,采用722分光光度计(上海凌光技术有限公司)测定400nm 波长处的OD 值,根据所测OD 值绘制标准曲线,得出不同浓度菌液的细菌数与OD 值之间的线性关系即线性回归方程.同时,将制备好的微球溶于CH2Cl2离心,沉淀用蒸馏水溶解后测OD 值.根据上述的线性回归方程计算菌浓度.
1.2.3 缓释微球体外释放
称取20份0.1g的微球,分别悬浮于蒸馏水中.为了检测缓释微球在体外的释放情况,每隔2d随机抽取其中1份微球悬浮液,干燥称重,计算出干燥后的微球质量与原微球质量之比,得到在不同时间缓释微球的体外释放比例.
1.3 血液免疫指标测定
1.3.1 实验准备
自保定徐水茂田中华鳖养殖场购得中华鳖,体质量为150~200g,驯养7d.选择体表无明显症状、活力强的个体96只随机分成4组,1个对照组和3个实验组,每组共24只,对照组、实验组Ⅰ、实验组Ⅱ采用灌胃方式给予微球疫苗,每只中华鳖给予的剂量依次为0,0.05,0.1g,实验组Ⅲ采用后肢注射方式每只鳖给予灭活的原菌液0.1mL.在免疫后的0,7,14,21,30,40d,每组随机挑取中华鳖4只,断颈采血,利用肝素抗凝,用以检测血清抗体效价、白细胞吞噬率和白细胞吞噬指数及淋巴细胞转化率.
1.3.2 血清抗体效价的测定(平板凝集法)
利用制备的抗凝血静置直至血细胞与血清分离,取血清进行2倍系列稀释.分别取不同稀释倍数的血清50μL滴于洁净载玻片上,再在血清附近加入Ah凝集抗原,用消毒牙签轻轻搅动使二者混合均匀,30 ℃孵育3min,光学显微镜下观察并记录免疫效果.
1.3.3 白细胞吞噬率和白细胞吞噬指数测定
分别取150μL抗凝血和150μL灭活的金黄色葡萄球菌液加入到1.5mL 离心管中,混匀,37 ℃温育30min(每隔10min轻摇1次),然后取混合液涂片,置吉姆萨染液中30min,蒸馏水洗涤后,在100×油镜下随机挑取100个中性粒细胞,记录吞噬细菌的细胞个数及吞噬的细菌数目.计算出吞噬细菌的细胞个数与细胞总数的百分比及吞噬的细菌总数与细胞总数的百分比即为吞噬率及吞噬指数[16].
1.3.4 淋巴细胞转化率的测定
在试管中将灭菌的质量质量浓度为30g/L的明胶溶液与抗凝血以体积比1:3混合,37℃水浴(试管30°倾斜放置)至大部分红细胞下沉时,取上清液1 500r/min 离心10~15 min,沉淀用培养液稀释分装于1.5mL Eppendorf管中,每管分装1mL作为培养用.1次实验分装2管,其中1管加植物血凝素(PHA-P),终浓度为50U/mL,另管作对照.置于37 ℃温箱培养72h(每天旋转摇匀2次).取出后1 000r/min离心10min,沉淀用毛细滴管吹打分散均匀,涂片,置吉姆萨染液中染色30min,蒸馏水洗涤后,在100×油镜下随机挑取200个细胞进行观察.淋巴细胞转化率的公式如下[16]:
淋巴细胞转化率=(200个淋巴细胞中转化的淋巴细胞数/200个淋巴细胞)×100%.
1.4 攻毒实验
1.4.1 菌种毒力与攻毒剂量的确定
将Ah接种于AHM 固定培养基中培养24h,挑取单菌落接种于10mL TSB 液体培养基中,在恒温振荡器中28 ℃条件下振荡培养过夜,次日取菌液按1:50体积比接种到20mL新鲜的TSB培养基中,振荡培养20h,灭菌的生理盐水洗2次后再用生理盐水悬浮菌体至1.35×1010/mL,肌肉注射中华鳖,注射剂量为0.1mL/只,观察并记录中华鳖的发病和死亡情况.当菌种可以用作攻毒实验时,对菌体悬浮液以10的倍数进行倍比稀释接种中华鳖,记录中华鳖的死亡数量,能致接种的中华鳖全部死亡的最小浓度即为最小致死浓度,此浓度可作为攻毒剂量.
1.4.2 疫苗对中华鳖攻毒的免疫保护作用
取经过驯养7d体质量为150 ~200g健康中华鳖60只,平均分成3组,每组20只.第1组每只注射浓度为1.35×108/mL 的菌悬液0.1 mL,第2 组采用灌胃方式每只给予缓释微球疫苗0.1g,同时以每只0.1mL生理盐水作为对照组,21d后采用1.4.1中的最小致死浓度对中华鳖进行攻毒实验,观察并记录中华鳖的死亡和存活数量,计算免疫组存活率与对照组死亡率之比,得出不同免疫方式的免疫保护率.
1.5 数据分析
采用IBM SPSS Statistics 19.0统计软件中的单因素方差分析(One-Way ANOVA)对数据进行显著性检验.首先进行齐性分析,再采用LSD 进行多重比较.当P<0.05被认为差异显著.
2 结果与分析
2.1 微球疫苗的制备、包封及体外释放情况
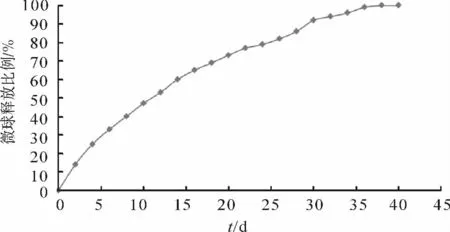
图1 微球的体外释放曲线Fig.1 Curve of microspheres in vitro release
培养所得菌液含细菌1.35×1011/mL,用体积分数为0.2%的甲醛28 ℃灭活48h,接种于AHM 固体培养基,28 ℃培养24h后没有观察到菌落生成.
制备的微球疫苗呈规则球形,表面完整,流动性好,粒径大小均一,且粒径小于50μm.根据菌液浓度与OD 值做标准曲线并得到线性回归方程y=3×10-12x+0.000 4,根据回归方程计算出微球含灭活菌约为6.75×1010/g.
通过对制备的缓释微球疫苗体外释放速度检测微球的包封效果,实验结果显示:微球的释放持续时间共接近40d,快速释放发生在前14d,释放比例达到了60%,随后微球的释放速度缓慢下降(图1).
2.2 中华鳖口服缓释疫苗及注射疫苗后的免疫应答反应
凝集实验结果显示,实验起始时各组的中华鳖血清抗体效价都比较低,且各组之间的差异不显著(P>0.05).随着免疫时间的延长,口服免疫微球疫苗的实验组Ⅰ、实验组Ⅱ和注射灭活菌组(实验组Ⅲ)中华鳖的血清抗体效价均呈上升趋势,并且从第7d 开始,各实验组的抗体效价显著高于对照组(P<0.05),实验组Ⅲ在第21d时血清效价达到最高点,实验组Ⅰ(给予0.05g微球疫苗组)与实验组Ⅱ(给予0.1g微球疫苗组)在第30d达到最高点.实验前30d实验组Ⅱ与实验组Ⅲ相比,中华鳖的血清抗体效价之间的差异不显著(P>0.05),当免疫持续到第40d时,实验组Ⅱ中华鳖的血清抗体效价显著高于实验组Ⅲ(P<0.05)(图2).血清抗体效价结果表明,注射组与口服微球组均可显著提高血清效价,其中口服0.1g缓释疫苗组与注射组相比,持续时间较长,在40d时效价高于注射组.
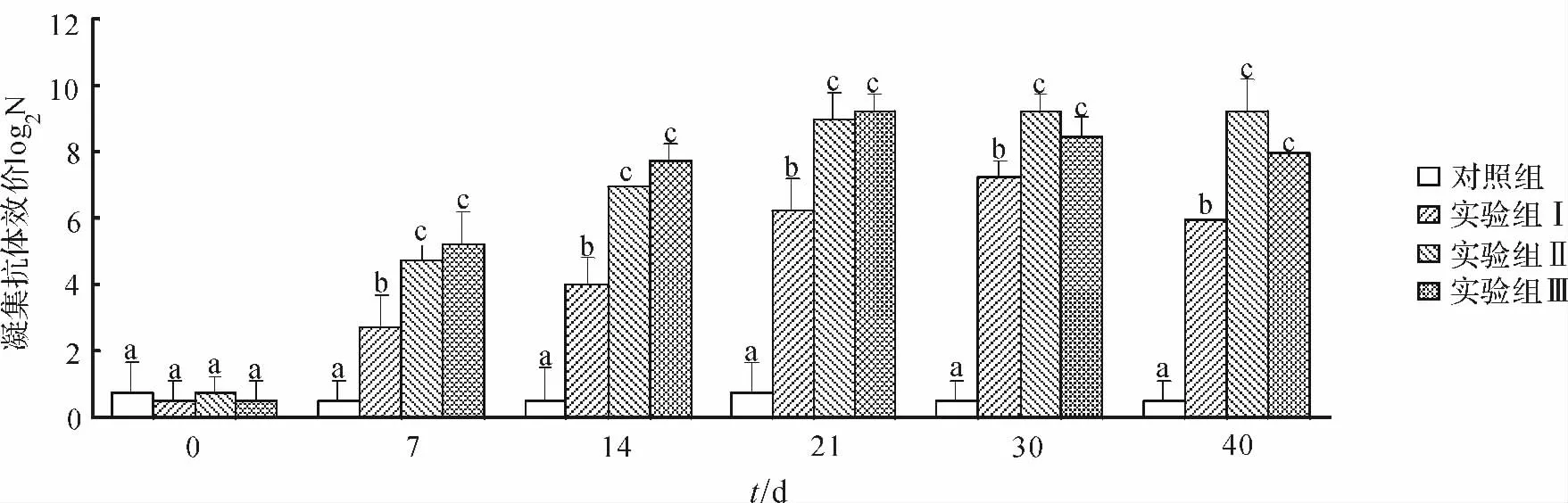
图2 注射免疫和口服微球缓释疫苗后中华鳖的血清抗体效价Fig.2 Serum antibody titer of Pelodiscus sinensis after immunization by injection or oral administration
白细胞吞噬率如图3所示,实验起始时中华鳖白细胞吞噬率各组之间的差异不显著(P>0.05).随着免疫时间的延长,口服缓释疫苗的2个组(实验组Ⅰ和实验组Ⅱ)和注射灭活菌的组(实验组Ⅲ)中华鳖的白细胞吞噬率均呈上升趋势,注射灭活菌的实验组在第21d达到最高点,口服0.05g缓释疫苗组(实验组Ⅰ)与口服0.1g缓释疫苗组(实验组Ⅱ)在第30d达到最高点.免疫开始第7d时,口服0.1g缓释疫苗组和注射灭活菌组中华鳖白细胞吞噬率明显高于对照组(P<0.05),但这2个实验组之间没有显著差异(P>0.05).免疫开始第14d时,3个实验组的白细胞吞噬率都明显高于对照组(P<0.05),且注射灭活菌组明显高于2个口服缓释疫苗组(P<0.05).当免疫第21,30,40d时,3个实验组白细胞吞噬率均显著高于对照组(P<0.05),注射灭活菌组与口服0.1g缓释疫苗组无显著差异(P>0.05),但到第30d和40d时,口服0.1g缓释疫苗组的白细胞吞噬率都略高于注射组.结果表明,注射组与口服微球组均可造成白细胞吞噬率显著上升,其中口服0.1g缓释疫苗组与注射组效果相当,但从40d 的免疫应答效果看,口服0.1g缓释疫苗组好于注射组.

图3 注射免疫和口服微球缓释疫苗后中华鳖的白细胞吞噬率Fig.3 Leucocyte phagocytic rate of Pelodiscus sinensis after immunization by injection or oral administration
白细胞吞噬指数结果如图4所示,在实验周期(40d)内,口服0.05g缓释疫苗组(实验组Ⅰ)和口服0.1g缓释疫苗组(实验组Ⅱ)中华鳖的白细胞吞噬指数随着免疫时间的延长呈上升趋势,在第30d达到最高点;注射组在前21d,白细胞吞噬指数呈上升趋势,在第21d达到最高点,第30d和第40d逐渐下降.免疫第0d和第7d时,白细胞吞噬指数各组之间相比,差异不显著(P>0.05).免疫14d时取材发现,口服0.1g缓释疫苗组和注射灭活菌组中华鳖白细胞吞噬率明显高于对照组(P<0.05),但这2个实验组之间没有显著差异(P>0.05).免疫第21d时,注射组的白细胞吞噬指数明显高于2个口服缓释疫苗组,但在第30d和第40d时,口服0.1g缓释疫苗组的白细胞吞噬指数已明显高于注射组(P<0.05).结果表明,注射组与口服微球组均可造成白细胞吞噬指数显著上升,实验结束时(40d)口服0.1g组效果最好,口服0.05g组和注射组效果相当.

图4 注射免疫和口服微球缓释疫苗后中华鳖的白细胞吞噬指数Fig.4 Leucocyte phagocytic index of Pelodiscus sinensis after immunization by injection or oral administration
淋巴细胞转化率结果如图5所示,实验起始时,各个实验组之间以及实验组和对照组之间中华鳖淋巴细胞转化率没有显著差异(P>0.05).随着免疫时间的延长,对照组的淋巴细胞转化率没有明显变化,3 个实验组无论是口服不同剂量微球组还是注射组,淋巴细胞转化率均呈上升趋势,并且都在第30d时达到最高点.免疫第7d时,口服0.05g缓释疫苗组(实验组Ⅰ)与对照组没有显著差异(P>0.05),口服0.1g缓释疫苗组(实验组Ⅱ)和注射组(实验组Ⅲ)与对照组相比差异显著(P<0.05),但这2个实验组之间没有显著差异(P>0.05).免疫第14d和21d时,3个实验组的淋巴细胞转化率均显著高于对照组(P<0.05),口服0.1g缓释疫苗组和注射组之间无显著差异(P>0.05).免疫第30d时,口服0.1g缓释疫苗组和注射组淋巴细胞转化率虽然均明显高于对照组(P<0.05),但这2个实验组之间仍然没有显著差异(P>0.05).免疫第40d时,3个实验组中华鳖的淋巴细胞转化率均明显高于对照组(P<0.05),且口服0.1g缓释疫苗组显著高于注射组(P<0.05).结果表明,注射组与口服微球组后淋巴细胞转化率显著升高,14,21,30d时口服0.1g组和注射组相当,显著高于对照组和口服0.05g组,40d口服0.1g组效果最好.
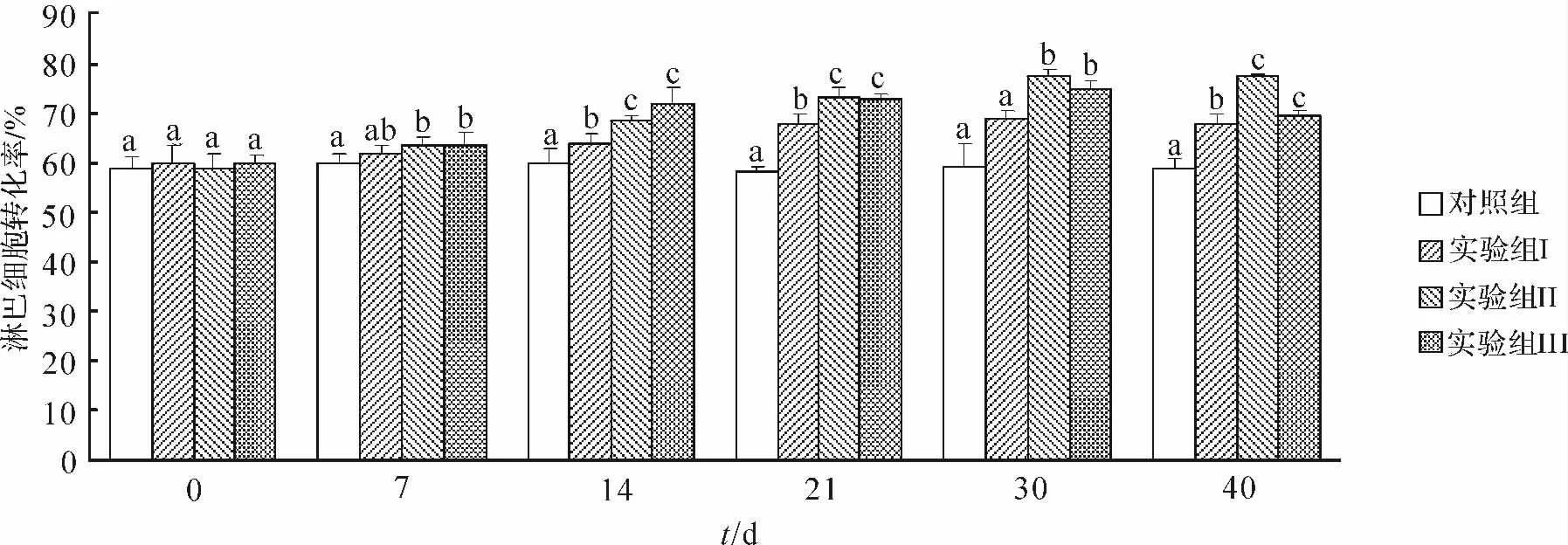
图5 注射免疫和口服微球缓释疫苗后中华鳖的淋巴细胞转化率Fig.5 Lymphocyte transformation rate of Pelodiscus sinensis after immunization by injection or oral administration
2.3 攻毒后的免疫保护率
中华鳖采用不同免疫方式免疫21d后,用毒力菌株对中华鳖进行攻毒,攻毒剂量为1.35×107/只,检测不同免疫方式对中华鳖的免疫保护率,结果显示,无论是口服0.1g缓释疫苗组还是注射灭活菌疫苗组,攻毒后死亡率仅有15%,而对照组死亡率为100%,推算出注射疫苗组和缓释疫苗组免疫保护率均为85%(表1).结果表明2种免疫方式均起到了良好的保护效果.
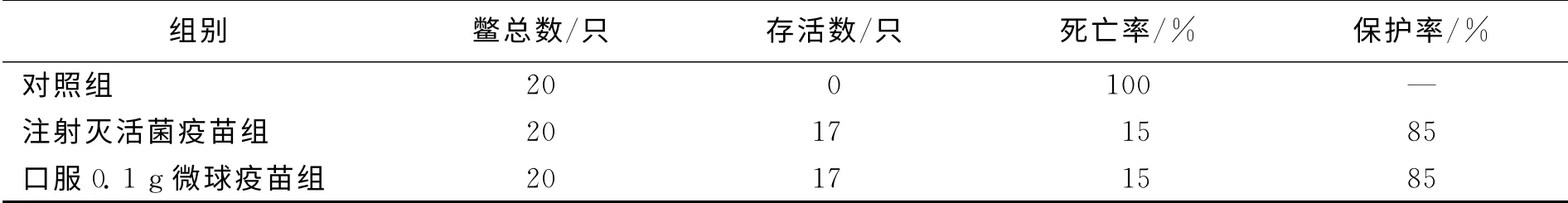
表1 注射免疫和口服微球缓释疫苗后中华鳖的免疫保护率Tab.1 Immune protection rate of Pelodiscus sinensis after immunization by injection or oral administration
3 讨论
中华鳖是我国淡水养殖的重要经济种类,但在人工养殖过程中大量疾病的出现,大大制约了养鳖业的发展,其中Ah常常引发一系列严重的疾病.虞蕴如[3]等对罹患红脖子病、红底板病的中华鳖进行研究,发现病原为Ah.叶巧真[4]等研究发现Ah可以导致中华鳖罹患白底板病和红底板病.储卫华和杨金先[5]从人工养殖患有“腐皮病”的中华鳖肝脏中分离出菌株BH-1,人工回染健康鳖,患病率为100%,经鉴定致病菌为Ah.
采用疫苗免疫中华鳖是解决这一问题的有效途径之一.在Ah疫苗方面,多数直接利用灭活疫苗进行注射免疫,但是在实施过程中工作量大,易造成鳖体注射伤口感染,还易引起机体的应激反应.浸浴是另一种常用方式,但仅适用于稚鳖,或作为注射疫苗的辅助方式,其免疫效果不够理想[17].本实验中,采用PLGA 包裹灭活菌制成缓释微球疫苗,在鳖体内释放时间较长,近40d.这与钱明明等[18]报道的释放时间较长相一致.
血清凝集抗体效价、白细胞吞噬率、白细胞吞噬指数和淋巴细胞转化率经常用于评价免疫效果的方法.以往的研究显示,用Ah(T3菌)灭活疫苗免疫中华鳖,血清凝集抗体效价显著提高[19];从中华鳖的病原菌如Ah等提取细胞壁组分——脂多糖,对其注射免疫,血清凝集抗体及交叉凝集抗体效价显著提高,吞噬细胞的吞噬活力(以吞噬率和吞噬指数为评价指标)显著提高,对Ah活菌的杀菌活性也显著上升[20].
在免疫应答实验后期,口服缓释疫苗组的各免疫应答指标均显著高于对照组,这证明了微球缓释疫苗的有效性.孙红祥等[14]报道,中华鳖口服温和气单胞菌微球疫苗后血清凝集抗体效价和白细胞杀菌百分率可达到灭活菌液注射组的效果,显著高于对照组.本实验中,实验前30d口服0.1g/只微球疫苗免疫中华鳖可以达到注射灭活疫苗的效果.30d 后,注射免疫的效果开始下降,而口服免疫效果还可继续维持,除白细胞吞噬率外其余3项免疫应答指标均显著高于注射免疫组(P<0.05),原因可能是灭活疫苗被包被在微球内部,疫苗在进入中华鳖消化道内被缓慢释放,能持续刺激鳖体,导致免疫应答的持续效果优于注射免疫.
本实验选用了2种剂量的微球疫苗对中华鳖免疫.免疫应答指标结果显示,当剂量为0.05g/只时,虽然免疫效果好于对照组,但多数免疫指标低于剂量较高的口服免疫组,说明口服免疫效果的发挥与选择的剂量密切相关.因此在攻毒实验中,采用剂量为0.1g/只进行口服免疫.至于0.1g/只是否为最优剂量,有待进一步的实验确定.
4 结论
采用复乳化-溶剂挥发法制备缓释微球疫苗,通过灌胃方式免疫中华鳖.以血清抗体效价等免疫应答指标的免疫应答效果与注射免疫组相当,体外释放可持续近40d,证明了缓释微球疫苗免疫的持续性.攻毒实验证明注射免疫方式和口服微球免疫方式的免疫保护率相同,证明了该疫苗的有效性.结合免疫应答和攻毒实验结果,认为该方法可作为控制中华鳖Ah病的一种免疫防治新途径.
[1] 冷闯,邓舜洲,张文波,等.中华鳖致病性嗜水气单胞菌的分离鉴定及药敏试验[J].动物医学进展,2012,33(2):124-129.LENG Chuang,DENG Shunzhou,ZHANG Wenbo,et al.isolation,Identification and drug sensitivity test of pathogenic Aeromonas hydrophilafrom Chinese soft-shelled turtles[J].Progress in Veterinary Medicine,2012,33(2):124-129.
[2] 陆宏达,金丽华.鳖嗜水气单胞菌败血症的研究[J].水产学报,1996,20(3):223-234.LU Hongda,JIN Lihua.Studies on the Aeromonas hydrophila septicemia of soft shelled turtle(Trionyx sinensis)[J].Journal of Fisheries of China,1996,20(3):223-234.
[3] 虞蕴如,储卫华,李克敏,等.中华鳖红脖子、红底板病的病原分离鉴定[J].动物医学进展,2004,25(2):102-105.YU Yunru,CHU Weihua,LI Kemin,et al.Isolation and identification of the pathogen of red neck disease and red abdominal shell disease of Trionyx sinesis[J].Progress in Veterinary Medicine,2004,25(2):102-105.
[4] 叶巧真,何建国,邱德全,等.中华鳖白底板病和红底板病细菌的分离鉴定及致病性[J].微生物学通报,2000,27(6):407-413. YE Qiaozhen,HE Jianguo,QIU Dequan,et al.Bacteria identification and their pathogenesis in red and white abdominal shell disease of Trionyx sinensis[J].Microbiology Bulletin,2000,27(6):407-413.
[5] 储卫华,杨金先.中华鳖"腐皮病"病原的研究[J].中国兽医杂志,2001,37(3):43-45.CHU Weihua,YANG Jinxian.Pathology of the“skin-rotting”disease of Trionyx sinensis[J].Chinese Journal of Veterinary Medicine,2001,37(3):43-45.
[6] 吴惠仙.中华鳖常见细菌病的病原鉴定及药物体外拮抗比较[J].水产科学,2004,23(6):5-9.WU Huixian.Identification and inhibitory effects of drugs against pathogenic bacteria of soft-shelled turtle(Trionyx sinensis)in vitro[J].Fisheries Science,2004,23(6):5-9.
[7] 孙玉华.鳖嗜水气单胞菌疫苗的试制[J].上海水产大学学报,1998,7(1):75-78.SUN Yuhua.The preparation of Aeromonas hydrophila vaccine to soft-shelled Turtle[J].Journal of Shanghai Fisheries University,1998,7(1):75-78.
[8] 刘金兰,杨广.嗜水气单胞菌外毒素免疫血清的制备及其对中华鳖红底板病的防治效果[J].湖北农学院学报,1999,19(3):233-235.LIU Jinlan,YANG Guang.Preparation of immune serum of exotoxin of Aeromonas hydrophila and its effectiveness of prevention and treatment to red abdominal shell disease of Trionyx sinensis[J].Journal of Hubei Agricultural College,1999,19(3):233-235.
[9] 叶巧真,何建国,翁少萍,等.中华鳖气单胞菌菌细胞苗和菌化学成份疫苗研制[J].水产学报,2000,24(2):167-170.YE Qiaozhen,HE Jianguo,WENG Shaoping,et al.Preparation of inactivated whole-cell and cell chemical components of Aeromonas fromTrinyx sinensis[J].Journal of Fisheries of China,2000,24(2):167-170.
[10] ANDERSON J M,SHIVE M S.Biodegradation and biocompatibility of PLA and PLGA microspheres[J].Advanced Drug Delivery Reviews,1997,28:5-24.
[11] ISHIZAKA S T,ISRAEL Z R,AGEGNEHU G,et al.Induction of mucosal antibody responses by microsphere-encapsulated formalin-inactivated simian immunodeciency virus in a male urethral challenge model[J].Vaccine,1997,17:2817-2825.
[12] IGARTUA M,HERNANDEZ R M,ESQUISABEL A,et al.Enhanced immune response after subcutaneous and oral immunization with biodegradable PLGA microspheres[J].Journal of controlled release,1998,56(1):63-73.
[13] CAI H,HU X D,YU D H,et al.Combined DNA vaccine encapsulated in microspheres enhanced protection efficacy against Mycobacterium tuberculosis infection of mice[J].Vaccine,2005,23:4167-4174.
[14] 孙红祥,潘杭君,胡富强,等.中华鳖对温和气单胞菌口服微球缓释疫苗的免疫应答[J].中国兽医学报,2004,24(2):131-133.SUN Hongxiang,PAN Hangjun,HU Fuqiang.Immune response of soft-shelled turtles(Trionyx sinensis)to oral controlled release microencapsulated vaccine of Aeromonas sobria[J].Chinese Journal of Veterinary Science,2004,24(2):131-133.
[15] 吕晓娟,龚建森,施祖灏,等.乳化-溶剂挥发法制备禽霍乱乙基纤维素微胶囊疫苗[J].中国畜牧兽医,2008,35(12):59-61. LÜ Xiaojuan,GONG Jiansen,SHI Zuhao,et al.The preparation of fowl cholera microencapsulated vaccine with ethylcellulose by emulsion-solvent diffusion method[J].China Animal Husbandry & Veterinary Medicine,2008,35(12):59-61.
[16] 张玉芬,亢喜刚,张文丽,等.嗜水气单胞菌疫苗免疫效果研究[J].水产科学,2010,29(11):657-660.ZHANG Yufen,KANG Xigang,ZHANG Wenli,et al.Immune effect of Aeromonas hydrophila vaccine[J].Fisheries Science,2010,29(11):657-660.
[17] 余为一,祖国掌,李槿年,等.鳖的免疫途径和免疫效果的观察[J].安徽农业大学学报,1998,25(1):1-5.YU Weiyi,ZU Guozhang,LI Jinnian,et al.The immune ways and their effectiveness on Trionyx sinensis[J].Journal of Anhui Agricultural University,1998,25(1):1-5.
[18] 钱明明.中华鳖群体死亡症病原菌的分离鉴定及其预防的研究[D].石家庄:河北师范大学,2010.QIAN Mingming.The research on isolation and identification of pathogenic bacteria and prevention of group died in Pelodiscus sinensis[D].Shijiazhuang:Hebei Normal University,2010.
[19] 杨先乐,周剑光,艾晓辉,等.中华鳖对T3菌苗抗原的免疫应答[J].动物学报,2001,47(2):163-169.YANG Xianle,ZHOU Jianguang,AI Xiaohui,et al.Immune Response of soft-shelled turtle(Trionyx sinensis)to bacterin T3[J].Acta zoologica Sinica,2001,47(2):163-169.
[20] 贾亚东,汪成竹,陈昌福.中华鳖对嗜水气单胞菌粗脂多糖(LPS)的免疫应答[J].华中农业大学学报,2007,26(2):228-232.JIA Yadong,WANG Chengzhu,CHEN Changfu.Immune response of crude lipopolysaccharide of Aeromonas hydrophila to soft-shelled turtle,Pelodiscus sinensis[J].Journal of Huazhong Agricultural University,2007,26(2):228-232.
