大花蕙兰原球茎快速繁殖条件的优化
2014-07-20曾桢迦李芳贾黄肖小君傅慧
曾桢迦,李芳,贾黄,肖小君,2,傅慧
(1.内江师范学院生命科学学院,四川内江641100;2.四川省高等学校特色农业资源研究与利用重点实验室,四川内江641100)
大花蕙兰原球茎快速繁殖条件的优化
曾桢迦1,李芳1,贾黄1,肖小君1,2,傅慧1
(1.内江师范学院生命科学学院,四川内江641100;2.四川省高等学校特色农业资源研究与利用重点实验室,四川内江641100)
以大花蕙兰原球茎(PLB)为试验材料,比较不同浓度植物激素6-BA(6-苄氨基腺嘌呤)、NAA(萘乙酸),AC(活性炭),有机添加物(香蕉汁)及不同培养方式(固体培养、液体培养)等因子对大花蕙兰原球茎增殖效果的影响.结果表明:大花蕙兰PLB增殖以MS+6-BA 2.0mg/L+NAA 0.2mg/L+AC 0.1mg/L结合液体振荡的培养方式效果较好,培养基中添加100 g/L香蕉汁对大花蕙兰PLB的增殖具有显著的促进作用.
大花蕙兰;原球茎;增殖;优化
大花蕙兰(Cymbidium hybridum),又称虎头兰、西姆比兰,是兰科兰属植物中大花型附生种类的杂交种.其花大,花多,花型规整丰满,色泽艳丽,花茎直立,花期长,生长健壮,栽培容易,近年来种植极为流行,进口品种在中国的兰花市场上独领风骚[1].大花蕙兰多为杂交品种,其种子繁殖一般无法保持品种特性,结实率相当低,分株能力弱[2],繁殖系数低,繁殖速度也比较慢[3],还容易引起退化,远不能满足大花蕙兰商品化生产的要求[4].与其他兰花组织培养一样,大花蕙兰主要也是通过诱导形成原球茎(PLB)再扩繁建立繁殖体系[5],因此,快速增殖原球茎并诱导分化成苗是实现大花蕙兰工厂化生产的关键[6].本试验探讨了不同浓度的植物激素(6-BA、NAA)、活性炭、有机添加物(香蕉汁)及不同培养方式(固体培养、液体培养)等因子对大花蕙兰原球茎增殖的影响,为大花蕙兰商品开发与利用提供科学依据和参考,以达到降低成本、提高经济效益的目的.
1 材料与方法
1.1 材料
选用长势一致、品名为“火炬”的大花蕙兰原球茎(由内江师范学院生命科学学院植物组织培养室提供).
1.2 方法
1.2.1 大花蕙兰原球茎增殖培养的激素浓度筛选
以MS作为基础培养基,采用3因素3水平正交试验设计方案(见表1),选取生长健壮、大小一致的原球茎切成直径5mm左右接入9种培养基中,每种培养基中均加入蔗糖30 g/L,琼脂条7 g/L,pH为5.8左右,其中每个配方接种6瓶,每瓶接种5个原球茎.
培养条件:白天24℃、夜间20℃左右,光照时间为13.5 h/d,光照强度为2 000 lx,室内的通气条件良好,每周观察原球茎的生长情况,40 d后统计增殖后总芽数、增殖倍数及生长状态.
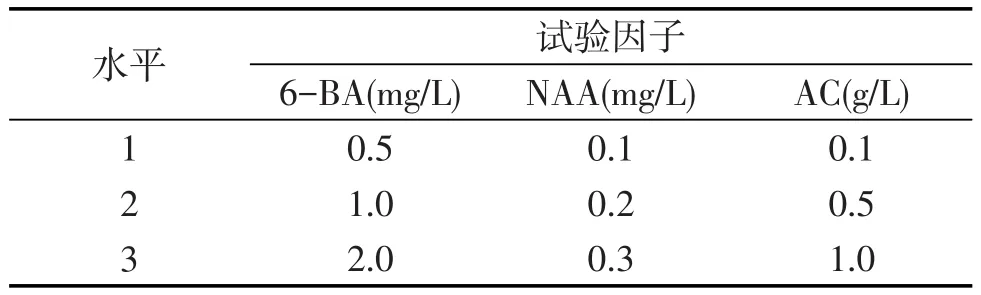
表1 大花蕙兰原球茎增殖正交试验设计
1.2.2 有机添加物对大花蕙兰原球茎增殖效果的影响
选取方法1.2.1中最佳的大花蕙兰原球茎增殖培养基作为对照,在培养基中添加不同浓度梯度香蕉汁(50 g/L、100 g/L、150 g/L),接种方法和培养条件与1.2.1相同.40 d后观察增殖的情况,统计大花蕙兰原球茎增殖总数、增殖倍数及长势情况.
1.2.3 不同培养方式对原球茎增殖生长的影响
选取方法1.2.1中最佳的大花蕙兰原球茎增殖配方作为基本培养基,在固体培养方式中接入质量为6.47 g的原球茎,在液体培养方式中接入质量为8.71 g原球茎,每个培养瓶中加入培养基50mL.每处理接种6瓶作为重复,培养40 d后统计原球茎增殖和生长情况.液体振荡培养的转数为100 r/min,培养条件为温度22℃,相对湿度70%~80%,光照强度2 000 lx,每天光照16 h.
2 试验结果与分析
2.1 不同激素浓度配比对大花蕙兰原球茎增殖的影响
经过观察,原球茎在接种2周后,1号、6号和8号培养基相继出现小的瘤状愈伤组织,原球茎颜色较浅,呈椭圆瘤状,3周之后,原球茎的颜色渐渐从黄绿变为淡绿色,40 d后新生的原球茎充分成熟,颜色转为深绿色.其中2号、3号和5号培养基中原球茎出现少量的黄化现象,3号有几颗原球茎出现芽化情况.表2为不同激素配比对大花蕙兰原球茎增殖的影响.
由表2可知,随着6-BA浓度的增大,原球茎增殖总数和增殖倍数也随着增高,在6-BA为2.0mg/L时达到最大,以MS+6-BA 2.0mg/L+NAA 0.2mg/L+ AC 0.1 g/L的组合生长状况最好,增殖总数为116个,增值倍数为3.87,原球茎生长健壮,颜色浓绿,长势强.适量的NAA有利于原球茎增殖,以0.2mg/L最佳,当NAA的浓度继续增加时,会抑制原球茎的增殖,且长势不好,说明较高浓度的6-BA与低浓度NAA配比,适合大花蕙兰的原球茎增殖.同时发现,添加适量的活性炭可有效抑制原球茎增殖过程中产生褐化.
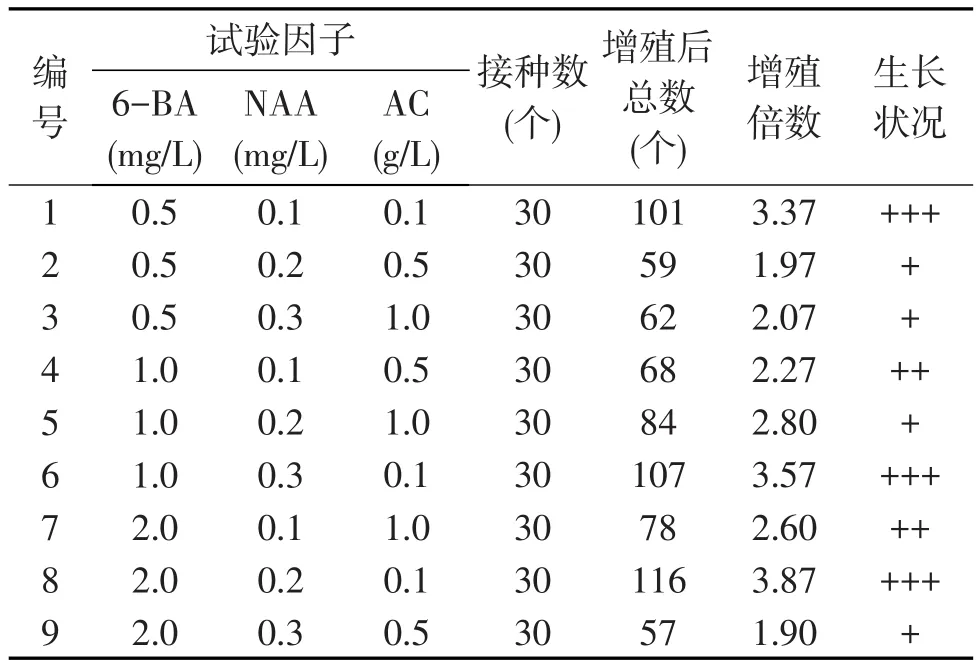
表2 不同激素配比对大花蕙兰原球茎增殖的影响
2.2 有机添加物对大花蕙兰原球茎增殖的影响
由表3可以看出,在MS+6-BA 2.0mg/L+NAA 0.2mg/L+AC 0.1 g/L培养基中,添加香蕉汁均有利于大花蕙兰原球茎的增殖,其中添加100 g/L的香蕉汁增殖效果最为明显,主要表现为原球茎颜色浓绿,生长健壮,长势强,当香蕉汁的浓度为150 g/L时,生长一段时间后就会长出大量的根,对生根有明显的促进作用.
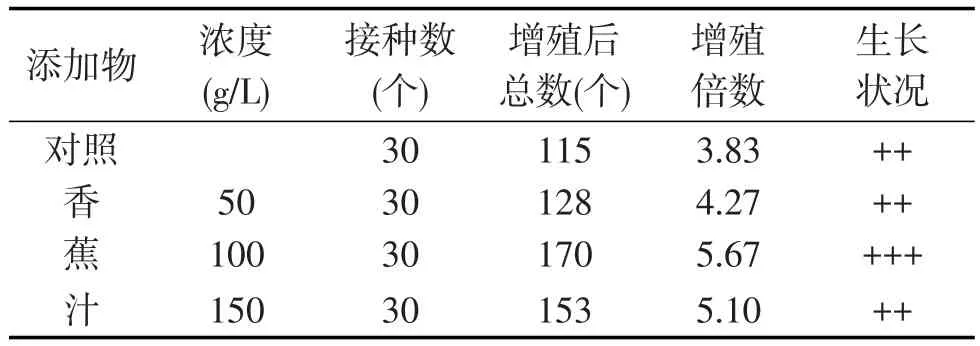
表3 有机添加物对大花蕙兰原球茎增殖的影响
2.3 不同培养方式对原球茎增殖生长的影响
由表4可知,液体振荡培养的原球茎总重为36.28 g,而固体培养基培养的原球茎总重仅为16.91 g,振荡培养的原球茎的增殖倍数(4.2倍)明显高于固体培养(2.6倍).在液体培养基中进行振荡培养的原球茎生长速度快,在短时间内即可诱导出大量的原球茎,且生长状况良好;而固体培养中的原球茎生长速度比较缓慢,前期原球茎生长现象不明显,到第2~3周生长速度较快,切口边缘膨大,外层细胞开始诱导分裂,生成绿色的珠状愈伤组织.这是因为液态培养时培养体可以与培养基充分接触,营养物质快速移动到培养体表面,从而使吸收养分的速度快于固体培养[7].
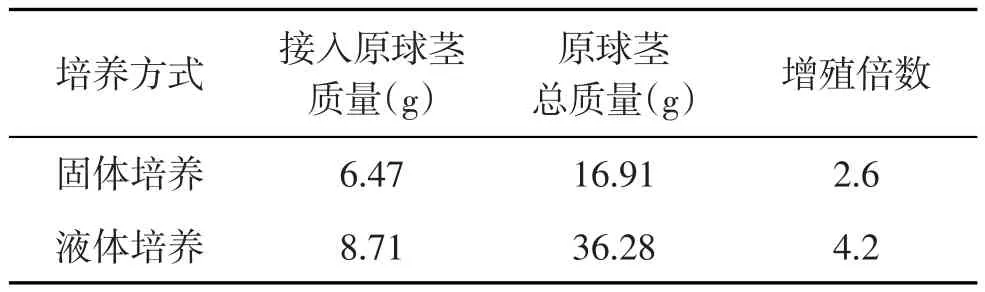
表4 培养方式对大花蕙兰原球茎增殖的影响
3 结论与讨论
试验结果表明:适宜浓度配比的6-BA、NAA和AC,能有效促进大花蕙兰原球茎的增殖,其中MS+ 6-BA 2.0mg/L+NAA 0.2mg/L+AC 0.1 g/L效果较好,在其基础上添加100 g/L的香蕉汁增殖效果显著,当香蕉汁浓度为150 g/L时,可明显促进大花蕙兰的生根,在液体培养基中振荡培养原球茎生长状态显著好于在固体培养基中培养,液体培养基培养的原球茎增殖倍数是固体培养的1.5倍.
在大花蕙兰组培快繁培养过程中,细胞分裂素6-BA与细胞生长素NAA都可促进原球茎的增殖以及诱导,两者以一定浓度组配再添加一定浓度的蔗糖作碳源,可选出最适大花蕙兰原球茎增殖的培养基,在本试验研究中最适合的浓度为6-BA 2.0 mg/L、NAA 0.2mg/L.韩劲峰等[8]在“大花蕙兰组织培养及快速繁殖研究”试验中,得出细胞分裂素6-BA浓度在0.5~1.0mg/L范围内,原球茎的诱导和增殖效果最佳,当6-BA浓度超过1.0mg/L时,对原球茎的诱导和增殖反而起抑制作用.但付志惠[9]在“大花蕙兰快速繁殖技术的研究”中提到随着6-BA浓度的升高,原球茎的增殖率上升,当6-BA浓度为8.0mg/L时,丛生芽生长健壮,颜色浓绿,说明其激素浓度越高,增殖率就越高.田英翠等[10]研究结果表明,当NAA的浓度为0.1~0.5mg/L、6-BA为5mg/L左右时,外植体上原球茎数最多,原球茎的诱导率达到最高.本研究表明低浓度生长素与较高浓度的细胞分裂素对大花蕙兰原球茎增殖有利;低浓度NAA与较高浓度细胞分裂素6-BA会促进原球茎的增殖,抑制分化.
一般认为,一定浓度的活性炭可吸附培养过程中产生的有害物质如酚、醌等,从而有利于原球茎的生长[11-12].高浓度的活性炭能够吸收继代培养中产生的某种物质,从而削弱这种物质对原球茎增殖的阻碍作用,而李方认为活性炭对原球茎增殖有抑制作用[13],与本试验结论不同,这可能是由于接种的原球茎已经多次继代培养,其体内已含大量细胞分裂素,活性炭的浓度对其影响较小的缘故.
前人研究认为香蕉汁是一类含有氨基酸、激素和酶等有机成分较为复杂的天然复合物,对植物细胞和组织的生长和增殖具有明显的促进作用,还能有效地吸收由外植体分泌的多酚类氧化物,抑制外植体的褐变,降低外植体的死亡率[14].付志惠[9]研究认为添加香蕉汁也有利于提高增长率和生长势,降低其褐化.田英翠等[10]、张超等[15]研究结果表明复合添加物如香蕉汁、活性炭、蛋白胨等增殖效果比较明显,原球茎的生长更加健壮,这与本文的试验结果一致.究其原因可能是适宜浓度的香蕉汁等天然有机物能提供一些必要的微量营养成分、生理活性物质和生长激素等,具有较大的pH缓冲作用,对原球茎的生长有促进作用.
[1]张助云,汪希强.大花蕙兰组培快繁技术[J].北方园艺,2007(3): 175-176.
[2]梁新安,杨录军,王慧瑜,等.大花蕙兰高频再生体系的建立[J].河南农业科学,2006(10):85-87.
[3]谭文澄,戴策刚.观赏植物组织培养技术[M].北京:中国林业出版社,1997:237-239.
[4]常美花,金亚征,王兴月,等.大花蕙兰快繁技术体系[J].北方园艺,2009(12):120-122.
[5]姚丽娟,徐晓薇,陈义增,等.大花蕙兰原球茎增殖分化影响因素研究[J].农业科技通讯,2008(5):57-59.
[6]李旭朴,炫春,杨金凤,等.大花蕙兰原球茎增殖影响因素的研究[J].安徽农业科学,2010,38(1):54-55.
[7]齐云,袁月祥,陈飞,等.一组纤维素分解菌的分离、筛选及其产酶条件的研究[J].天然产物研究与开发,2003,15(6):50-51.
[8]韩劲峰,韩晓华.大花蕙兰组织培养及快速繁殖研究[J].广西农业科学,2008,39(3):284-286.
[9]付志惠.大花蕙兰快速繁殖技术的研究[J].广东农业科学,2010 (3):125-127.
[10]田英翠,杨柳.植物激素和复合添加物对大花蕙兰组织培养的影响[J].安徽农业科学,2006,34(18):4566-4567.
[11]卜学贤,陈维伦.活性炭对培养基中调节物质的吸附作用[J].植物生理学报,1988,14(4):401-405.
[12]刘用生,李友勇.植物组织培养中活性炭的作用[J].植物生理学通讯,1994,3(3):214-217.
[13]李方.中国兰快繁技术与推广应用研究[D].杭州:浙江大学, 2004.
[14]谭甜,季勤,张云峰,等.不同培养基对大花蕙兰原球茎诱导与增殖影响的研究[J].安徽农业科学,2009,37(21):9867-9868.
[15]张超,张茜茜,楼楠男,等.有机添加物对大花蕙兰原球茎及幼苗生长发育的影响[J].安徽农业科学,2009,37(19):8866-8868.
【编校:王露】
Optim ization of Conditions for Rapid Propagation of Cymbidium Hybridum Protocorm
ZENGZhenjia1,LIFang1,JIA Huang1,XIAOXiaojun1,2,FUHui1
(1.School ofLife Science,Neijiang Normal University,Neijiang,Sichuan 641100,China;.2.Key Laboratory ofCollegesand Universities in Sichuan for Research and Utilization ofDistinctive Agricultural Undertakings,Neijiang,Sichuan 641100, China)
The effects of different concentrations of plant hormones(6-BA、NAA),AC(activated carbon),organic compounds(banana juice)and different culturemethods(solid culture and liquid culture)on themultiplication of PLB were studied by using Cymbidium hybridium PLB.The results indicated that the bestmethod for PLB propagation wasMS+6-BA 2.0mg/L+NAA 0.2mg/L+AC 0.1mg/L associatingwith liquid shaking culture,adding banana juice 100 g/L in the medium could have significant role on the promotion of themultiplication of Cymbidium hybridium PLB.
Cymbidium hybridum;protocorm;propagation;optimization
S682.313
A
1671-5365(2014)12-0118-03
2014-07-05修回:2014-09-10
内江师范学院大学生科研项目(13NSB-75)
曾桢迦(1993-),女,本科生,研究方向为植物组织培养
肖小君(1982-),女,硕士,助理研究员,研究方向为花卉组织培养
时间:2014-09-12 13:00
http://www.cnki.net/kcms/detail/51.1630.Z.20140912.1300.002.htm l
