Anammox反应器启动过程中颗粒污泥性状变化特性
2014-07-19宋雨夏熊蕾柴立元廖骐唐崇俭闵小波杨志辉
宋雨夏,熊蕾,柴立元,廖骐,唐崇俭,闵小波,杨志辉
1 中南大学冶金与环境学院,湖南 长沙 410083
2 国家重金属污染防治工程技术研究中心,湖南 长沙 410083
Anammox反应器启动过程中颗粒污泥性状变化特性
宋雨夏1,2,熊蕾1,2,柴立元1,2,廖骐1,2,唐崇俭1,2,闵小波1,2,杨志辉1,2
1 中南大学冶金与环境学院,湖南 长沙 410083
2 国家重金属污染防治工程技术研究中心,湖南 长沙 410083
宋雨夏, 熊蕾, 柴立元, 等. Anammox反应器启动过程中颗粒污泥性状变化特性. 生物工程学报, 2014, 30(12): 1854–1864.
Song YX, Xiong L, Chai LY, et al. Physicochemical and ecological characteristics of the granular sludge during start-up of Anammox reactor. Chin J Biotech, 2014, 30(12): 1854–1864.
以厌氧颗粒污泥作为接种物,通过185 d的运行,成功启动了上流式厌氧氨氧化污泥床 (Upflow anaerobic sludge blanket, UASB) 反应器。反应器的进水氨氮与亚硝氮浓度分别提升至224 mg/L和255 mg/L,容积氮去除速率提升至3.76 kg/(m3·d)。采用红外光谱、扫描电镜和透射电镜等对厌氧氨氧化颗粒污泥的性状进行观察,发现颗粒污泥在启动过程中经历了污泥颗粒裂解到污泥颗粒重组的过程,且厌氧氨氧化颗粒污泥表面含有丰富的官能团,说明厌氧氨氧化颗粒污泥可能具有良好的吸附性能。采用宏基因组测序的方法对启动前后颗粒污泥的生态结构进行分析,发现原接种污泥优势菌群 (变形菌门、厚壁菌门、拟杆菌门) 丰度大幅减少,厌氧氨氧化菌所属的浮霉状菌门丰度则由1.59%提升到23.24%。
厌氧氨氧化,UASB反应器,颗粒污泥,启动,理化性状,生态结构
随着生产活动增加和人们生活水平不断提高,水体中的氨氮排放量急剧增加。传统的硝化/反硝化生物脱氮工艺因其耗能大、需外加酸碱中和以及外加碳源等缺陷,难以满足可持续发展的目标。厌氧氨氧化 (ANAMMOX,Anaerobic ammonium oxidation) 是一种新型高效的自养型生物脱氮工艺,可在缺氧条件下以亚硝酸盐作为电子受体氧化氨而生产氮气[1]。与传统的硝化/反硝化工艺相比,厌氧氨氧化工艺无需曝气和外加有机碳源,而且剩余污泥量少[2]。但由于厌氧氨氧化菌为自养型细菌,倍增时间长、生长缓慢[1-3],导致厌氧氨氧化污泥的培育过程十分缓慢,限制了厌氧氨氧化反应器的快速启动。
污泥颗粒化是生物反应器获得高效性的重要技术手段[4-7]。颗粒污泥具有良好的沉降性能,易通过重力沉降持留于反应器内,提高反应器内的微生物浓度[8-9]。由于厌氧氨氧化菌生长缓慢,厌氧氨氧化颗粒污泥的培育尤其困难[1,3,10]。研究表明,选取常规颗粒污泥作为接种污泥直接富集培育厌氧氨氧化颗粒污泥可加快厌氧氨氧化颗粒污泥的培育过程。但对启动过程中颗粒污泥的理化性状变化情况仍不甚明了。本研究以造纸废水处理站厌氧内循环反应器获取的厌氧颗粒污泥为接种污泥,以上流式厌氧污泥床 (UASB) 反应器为载体,通过逐步提高进水基质浓度和缩短水力停留时间,成功启动了厌氧氨氧化反应器,在此基础上,研究了厌氧氨氧化反应器启动过程中颗粒污泥的变化特性。
1 材料与方法
1.1 试验装置
实验装置选择UASB反应器,由有机玻璃制成,有效容积为1 L,外罩厚布以消除光照的负面影响[11-12]。废水通过蠕动泵从底部注入反应器中,产生的气体经三相分离器收集后从反应器顶部排出,泥水分离后的出水从反应器上部排出[7,12]。通过反应器外层的恒温水浴夹套将反应器内的反应温度控制在 (32±1) ℃。如图1所示,通过1∶1 HCl溶液调节反应器进水pH为6.5−7.4。
1.2 试验废水
试验采用模拟废水,其组成为 (g/L) 为:NaH2PO40.01,CaCl2·2H2O 0.005 6,MgSO4·7H2O 0.3,KHCO31.25;微量元素浓缩液Ⅰ、Ⅱ各1.25 mL/L。微量元素浓缩液Ⅰ的成分为 (g/L):EDTA 2.5,FeSO42.5;微量元素浓缩液Ⅱ的成分为 (g/L):EDTA 15,CuSO4·5H2O 0.25,ZnSO4·7H2O 0.43,NaMoO4·2H2O 0.22,NiCl·6H2O 0.19,H3BO30.014[13]。NH4+-N和 NO2--N分别由 (NH4)2SO4和NaNO2提供,浓度按所需配制[14]。
1.3 接种污泥
试验采用厌氧颗粒污泥作为接种污泥,取自于湖南某造纸厂废水处理站厌氧内循环 (IC)反应器,黑色,粒径约为1−2 mm,悬浮固体 (SS)和挥发性悬浮固体 (VSS) 分别为51.2 g/L和43.5 g/L,VSS/SS为0.85。取回后用清水反复冲洗,以洗净污泥中残留的有机物。
1.4 测定项目与方法
氨氮采用水杨酸-次氯酸盐光度法 (722型可见分光光度计) 检测,亚硝氮采用N-(1-萘基)乙二胺分光光度法 (722型可见分光光度计) 检测,硝氮采用紫外分光光度法 (Hitachi U-4100紫外可见光分光光度计) 检测,pH采用雷磁PHBJ-260便携式pH计测定,SS、VSS采用重量法测定,温度采用水银温度计测定。
红外光谱分析:从反应器中取少量颗粒污泥,烘干后将样品与溴化钾混合后研磨20−30 s。将研磨后的样品粉末用不锈钢铲转移至底模面上并刮平,然后小心用柱塞将样品压平,再转动使粉末分布均匀,非常小心并慢慢拔出,然后放入顶模,其上放上柱塞,用10 t的油压机压片。压片完毕后,将片顶出,放于片夹上记录图谱,以溴化钾校正。
扫描电镜观察:取适量混培物样品于2.5%戊二醛溶液中4 ℃固定过夜,经 0.1 mol/L,pH 7.0磷酸缓冲液洗涤3次后用1%饿酸锇酸溶液固定1−2 h,接着用0.1 mol/L,pH 7.0磷酸缓冲液洗涤3次,再用梯度浓度乙醇 (包括50%、70%、80%、90%和100%) 进行脱水处理,脱水处理后的样品用1∶1乙醇醋酸异戊酯处理30 min,用纯醋酸异戊酯处理l−2 h。最后将样品置于临界点干燥,镀膜后用JSM-6360LV型扫描电镜(日本电子JEOL公司) 观察结果。
透射电镜观察:从反应器中取出适量污泥样品,先置于2.5%的戊二醛溶液中,经4 ℃固定过夜后,用0.1 mol/L的磷酸缓冲溶液漂洗,再用1%锇酸溶液固定1−2 h,之后再用上述磷酸缓冲溶液漂洗。经浓度梯度为50%、70%、80%、90%、95%、100%的乙醇溶液脱水处理后,分别用体积比为1∶1和3∶1的包埋剂与丙酮混合液处理1 h和3 h,最后将渗透样品包埋,经过70oC加热过夜后,即得到包埋处理好的样品。采用Reichert超薄切片机对包埋好的样品进行切片,获得70−90 nm的切片,用柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液对切片各染色15 min,再用FEI Tecnai G2 Spirit进行观察拍片。
污泥群落结构分析:采用宏基因测序的分析方法。通过离心获得2 mL的污泥样品,经液氮冷冻后将细胞悬浮在磷酸钠缓冲液中,再加入0.3 g,直径0.25 mm的球磨珠,通过球磨(4 000 r/min) 获得破碎细胞[15-16],然后将细胞保存在50 mL的超纯水中,并放入4 ℃下保存,采用土壤样品试剂盒 (Omega公司) 提取细菌DNA;后将电泳检验后的DNA样品进行PCR扩增 (PCR扩增所用的引物对为515F和806R,扩增细菌16S rRNA基因的V4区域,片段长度为254 bp)、混样、建库并做相应的检测 (诺和致源公司)。检测合格的文库采用Illumina Miseq/Hiseq高通量测序平台对样品进行测序。
2 结果与讨论
2.1 反应器的启动过程及脱氮性能
根据文献报道,厌氧氨氧化反应器的启动过程可分为菌体自溶、活性迟滞、活性提高和活性稳定4个阶段[1,4,7-8]。根据试验结果,本文也将厌氧氨氧化反应器的启动过程分为4个阶段,即1−22 d为菌体自溶期,23−104 d为活性迟滞期,105−135 d为活性提高期,136−185 d为活性稳定期。
在菌体自溶期 (1−22 d),反应器出水氨氮浓度为84.85 mg/L,明显高于进水氨氮浓度 (平均进水浓度为67.96 mg/L) (图2A),显现出典型的菌体自溶特征[7]。在出水中没有检测到亚硝氮(图2A),表明反应器内可能发生了反硝化作用,将亚硝酸盐转化为氮气[7]。

图2 接种厌氧颗粒污泥的UASB反应器启动性能Fig. 2 Performance of UASB seeded with anaerobic granular sludge during start-up. (A) Concentrations. (B) Removal efficiency.
第23−104天,反应器进出水氨氮浓度基本持平,没有观测到明显的氨去除现象,表明反应器处于活性迟滞期。与菌体自溶期相比,反应器出水中的亚硝氮浓度为22.98 mg/L,亚硝氮去除率降低为70.11%,表明在活性迟滞期,反应器内的反硝化作用强度有所减弱。在该阶段,反应器内部分颗粒污泥由黑色转化为棕黄色,表明反应器内的微生物群落结构发生了变化。
第105天,反应器出水氨氮浓度降低为4.59 mg/L,氨氮去除率跃升至66.22%,容积氮负荷由0.17 kg/(m3·d) 跃升至4.29 kg/(m3·d) 见图2B,容积去除速率升高至2.16 kg/(m3·d),此后氨氮去除率逐步升高,厌氧氨氧化功能持续增强,表明启动过程进入活性提高阶段,至第135 d,反应器进水氨氮和亚硝氮浓度分别提高至175.35 mg/L和218.06 mg/L,氨氮、亚硝氮去除率提高为77.78%和87.9%,反应器容积氮去除速率提高为3.0 kg/(m3·d),厌氧氨氧化成为反应器内的主导反应。在该阶段,反应器内棕黄色污泥区域逐渐扩散,出现少量红色颗粒污泥,说明反应器内生态结构和活性继续演变。
第135天后,在该阶段,反应器进水氨氮和亚硝氮浓度逐渐升高至236 mg/L和255 mg/L,平均出水氨氮和亚硝氮浓度分别为40 mg/L和15 mg/L,平均氨氮和亚硝氮去除率分别为71.6%和83.5%,反应器的容积氮去除速率不再随进水容积氮负荷的增加而升高,表明反应器进入活性稳定期。
在活性提高期与活性稳定期,反应器的容积氮去除速率均高于文献报道的厌氧氨氧化反应器启动成功的标准 (0.5 kg/(m3·d))[17],据此判定反应器启动成功。另外,亚硝氮/氨氮计量比基本维持在1.3−1.4,与厌氧氨氧化的理论计量比 (1∶1.32) 基本符合,进一步表明反应器内主要发生了厌氧氨氧化反应。
2.2 颗粒污泥理化性状变化
2.2.1 表观性状变化
接种污泥呈黑色,为椭球型颗粒,外表面光滑,粒径约为1−2 mm。经185 d运行后,反应器内的污泥大多呈棕黄色以及红色,红色颗粒污泥粒径约为2−3 mm,一些新生成的颗粒污泥表面凹凸不平,呈不规则团块状。因厌氧氨氧化菌富含血红素[18],厌氧氨氧化颗粒污泥呈现出典型的红色特征。
进一步采用扫描电镜对反应器内不同时期的颗粒污泥进行了观察。接种的厌氧颗粒污泥表面光滑,无附着物 (图3A),可观察到少量丝状菌。在启动过程中观察到颗粒污泥表面变得粗糙,存在裂痕。因厌氧颗粒污泥从有机环境转移到无机环境,污泥中大量异养菌死亡,这可能是导致污泥颗粒表面出现裂痕的主要原因。对新生成的红色厌氧氨氧化颗粒污泥 (第140天) 进行观察,发现单个污泥颗粒表面粗糙,整个污泥由许多污泥亚单位聚集形成 (图3E),与文献报道的厌氧氨氧化颗粒污泥结构相似[19];污泥表面主要为球菌,并且紧密聚集在一起,同时伴有少量杆菌 (图3F)。研究表明,在胞外多聚物的作用下,厌氧氨氧化菌能够紧密组合,形成一个个小的亚单位[19-20]。
2.2.2 颗粒表面官能团性质
研究表明,在微生物代谢过程中会产生许多分泌物,使污泥表面携带数量可观的官能团,如羟基、羧基、酯基等,使污泥具有良好捕集与吸附污染物 (如重金属) 的性能。有关厌氧氨氧化颗粒污泥表面官能团性质,迄今未见报道。
启动前厌氧颗粒污泥的红外吸收图谱如图4所示,其中3 470 cm−1谱带包括了胺基中-NH2不对称伸缩振动和醇类、糖类O-H的伸缩振动;2 920 cm−1谱带为 CH2的C-H不对称伸缩振动峰;2 200−2 400 cm−1是蛋白质和氨基酸、铵盐类化合物中-NH4+的多重复合谱带;1 650 cm−1谱带为N-H的变形振动与C=O伸缩振动的共轭; 1 540 cm−1谱带为酰胺 Ⅱ的N-H的变形振动与C-N变形振动的共轭;1 030 cm−1处的强峰为多糖或类似多糖物质的C-O-C伸缩振动。由此可见,厌氧颗粒污泥主要含有羟基、氨基、酰胺基、多糖及氨基酸等[21]。
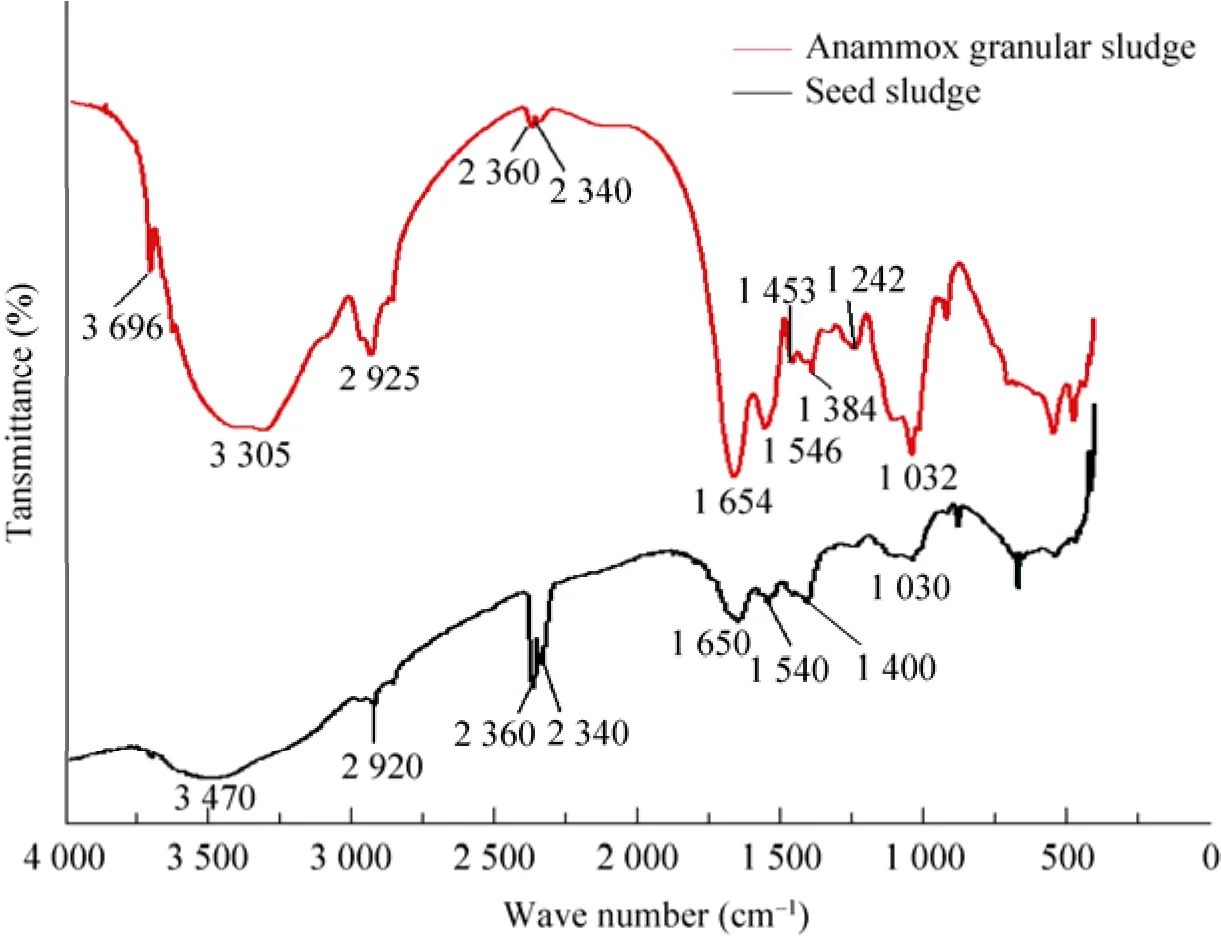
图4 反应器启动前后颗粒污泥的红外光谱Fig. 4 FTIR spectra for sludge before and after the start-up.
研究结果显示,启动后的厌氧氨氧化颗粒污泥样品在整个波数范围 (4 000−400 cm−1) 内均有明显的吸收,表明其表面官能团丰富。与厌氧颗粒污泥相比,主要的差别有:1) 图谱中原3 300到3 500 cm−1处的谱带峰强明显增强,一些谱带发生了微小偏移,如2 920 cm−1处CH2的C-H不对称伸缩振动峰偏移了5 cm−1且谱带变宽,1 650 cm−1谱带偏移4 cm−1,1 540 cm−1谱带偏移6 cm−1,这可能与启动过程中的菌体自溶作用有关;2) 蛋白质和氨基酸、铵盐类化合物中-NH4+的多重复合谱带峰强明显减弱,可能与反应器内发生的厌氧氨氧化有关,污泥表面的-NH4+会进入溶液而被厌氧氨氧化转化;3)新出现的1 384 cm−1常常是腐殖物质的特征光谱,由于在菌体自溶过程中会释放有机物,这一谱带的出现有可能进一步揭示了污泥内存在菌体自溶作用;1 242 cm−1是亚硝酸化合物的-NO2对称伸缩振动,这可能与长期在反应器体系中添加亚硝酸盐有关。厌氧氨氧化颗粒污泥表面所具有的丰富官能团表明其对一些特征污染物具有良好的吸附性能,这对于后续应用厌氧氨氧化颗粒污泥处理含重金属等污染物的氨氮废水提供了新的思路。
2.3 颗粒污泥的微生物生态结构变化
透射电镜观察结果表明,接种污泥中的细胞形态大部分呈现规则的圆形,同时伴有一些长条状细胞 (图 5A)。由于接种污泥取自处理造纸废水的IC反应器,主要发生产甲烷作用,又因产甲烷八叠球菌是厌氧颗粒污泥中的重要组成部分[22],推测接种污泥中观测到的大量圆形细胞可能为产甲烷八叠球菌细胞。对厌氧氨氧化颗粒污泥的透射电镜观察结果 (图 5B) 表明,其细胞多呈不规则的弯月状或椭圆形。与文献报道的经典厌氧氨氧化超微结构比对,可以从图中明显辨别出厌氧氨氧化体(Anammoxosome,图中黑色区域 (A))和外室细胞质 (Paryphoplasm,图中透明区域 (P))等厌氧氨氧化菌细胞的特征结构[20,23],且几个细胞之间通过胞外多聚物 (E) 粘合在一起[11]。
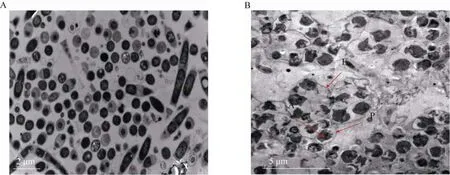
图5 接种污泥 (A) 和反应器启动后污泥 (B) 透射电镜图Fig. 5 TEM observation of the sludge before (A) and after (B) start-up.
为了进一步探明启动前后颗粒污泥的生态结构,采用宏基因组测序的方法对启动前后颗粒污泥的生态结构进行了分析。启动前后厌氧颗粒污泥 (T1)、厌氧氨氧化颗粒污泥 (T2) 的有效序列分别为106 608、67 435 (单位是百万,M),平均片段大小为254 bp;对不同样本在种、属水平下的alpha多样性指数进行统计。其中,种水平下的alpha多样性指数基于97%的序列相似性而得到,属水平下的基于95%的序列相似性得到。结果如表1、表2、图6所示。
接种污泥中的优势菌群为变形菌门Proteobacteria、拟杆菌门Bacteroidetes、广古菌门Euryarchaeota和厚壁菌门Firmicutes,其相对丰度分别为26.66、21.28、9.86和7.66% (表2)。其中,变形菌门、拟杆菌门以及厚壁菌门的细菌作为优势菌群被频繁地发现于厌氧有机环境(如肠道、粪便以及厌氧反应器),具有降解纤维素、淀粉、长链脂肪酸等功能[24-25]。产甲烷菌是广古菌门的重要组成,故而在厌氧颗粒污泥中也占据优势地位。在厌氧颗粒污泥中检测到了包含厌氧氨氧化菌的浮霉状菌门[26],表明采用厌氧颗粒污泥作为接种物富集培育厌氧氨氧化菌在理论上是可行的,但因其相对丰度很低(1.59%),表明其富集培育过程 (反应器的启动过程) 必然是一个十分缓慢的过程。

表1 α多样性指数Table 1 Alpha diversity index
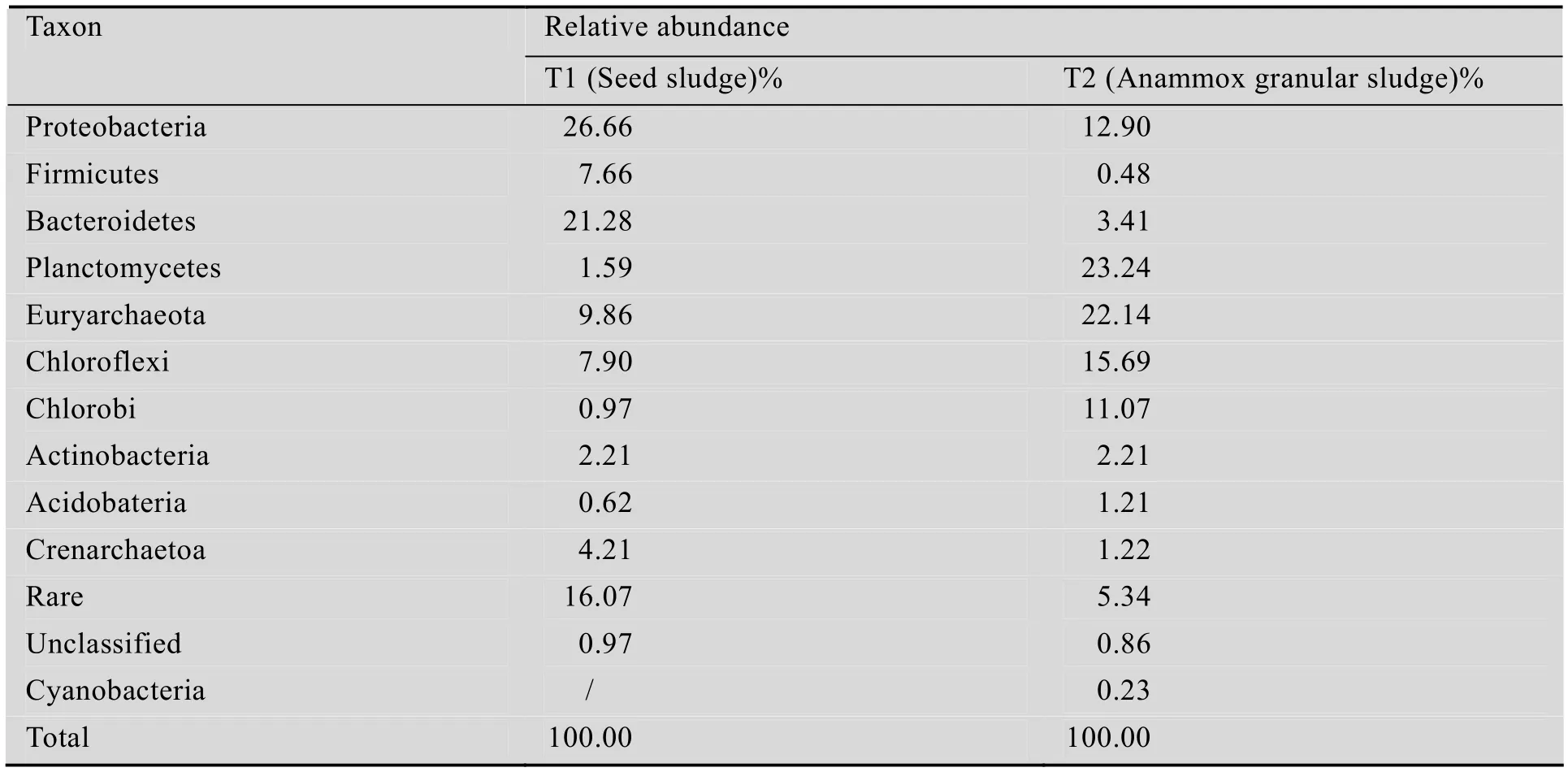
表2 接种颗粒污泥和厌氧氨氧化颗粒污泥菌落组成及丰度Table 2 Composition and relative abundance of the sludge before and after start-up

图6 反应器启动前后颗粒污泥的生态结构 (T1接种厌氧颗粒污泥;T2厌氧氨氧化颗粒污泥)Fig. 6 The ecological structure of granular sludge before and after start-up (T1 seed sludge, T2 anammox granular sludge).
反应器启动成功后,厌氧氨氧化颗粒污泥中的菌落结构发现了显著变化,浮霉状菌门的丰度大幅提高为23.24%,相比于接种污泥增加了13.6倍,可以推断,作为浮霉状菌门下的厌氧氨氧化菌已经成为颗粒污泥中的优势菌群。与厌氧颗粒污泥相比,在厌氧氨氧化颗粒污泥中的相对丰度明显升高且占据优势还有广古菌门、绿菌门Chlorobi和绿弯菌门Chloroflexi,其相对丰富分别为22.14%、11.07%和15.69%,分别提高了2.45、11.4和1.99倍。值得指出的是,广古菌门因含有产甲烷菌而在厌氧颗粒污泥中占据优势,但随着无机环境的持续延长,污泥中的产甲烷菌水解自溶所致的数量减少已经不可避免,然而结果却显示广古菌门细菌的丰度不降反升,这可能与氨氧化过程的重要微生物——氨氧化古菌 (Ammonia-oxidizing archaea,AOA) 相关。研究表明,AOA在低溶解氧条件下易被富集[27],并可与厌氧氨氧化菌共存[27-29]。而绿弯菌门和绿菌门细菌均可进行不产氧的光合作用,含有绿色色素,在反应器运行过程中,肉眼可观测到反应器沉淀区内壁上附着有绿色的微生物,可能即与此有关。此外,由于无机环境的延续,原接种污泥中的优势菌群变形菌门、拟杆菌门和厚壁菌门的丰度均大幅减少至12.90%、3.41%和0.48%,分别降低了51.6%、84%和93.7%,进一步验证了启动过程中的菌体自溶现象。
3 结论
经过185 d的运行,成功启动了厌氧氨氧化UASB反应器。进水氨氮与亚硝氮浓度分别由24 mg/L和28mg/L提升至224 mg/L和255 mg/L,氨氮去除率达97%,亚硝氮去除率为100%,容积氮负荷由0.30 kg/(m3·d) 提升至4.95 kg/(m3·d),容积氮去除速率可提升至3.76 kg/(m3·d)。在启动过程中,颗粒污泥经历了裂解到重组的过程,且其中优势菌群发生了显著变化,原接种污泥优势菌群 (变形菌门、厚壁菌门、拟杆菌门) 丰度大幅减少,包含厌氧氨氧化菌的浮霉状菌门细菌丰度由1.59%大幅度提升到23.24%。厌氧氨氧化颗粒污泥表面含有丰富的官能团,表明其对水中的污染物具有潜在的吸附能力。
REFERENCES
[1] Strous M, Heijnen JJ, Kuenen JG, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms. Appl Microbiol Biotechnol, 1998, 50(5): 589−596.
[2] Jetten MS, Strous M, Pas Schoonen KT, et al. The anaerobic oxidation of ammonium. FEMS Microbiol Rev, 1998, 22(5): 421−437.
[3] Tang CJ, Zheng P, Cheng JW. Effect of sequential biocatalyst addition on Anammox process. Chin J Biotech, 2011, 27(1): 1−8 (in Chinese).唐崇俭, 郑平, 陈建伟. 流加菌种对厌氧氨氧化工艺的影响. 生物工程学报, 2011, 27(1): 1−8.
[4] Tang C, Zheng P, Wang C, et al. Performance of high-loaded ANAMMOX UASB reactors containing granular sludge. Water Res, 2011, 45(1): 135−144.
[5] Thiele JH, Wu WM, Jain MK, et al. Ecoengineering high rate anaerobic digestion systems: analysis of improved syntrophic biomethanation catalysts. Biotechnol Bioeng, 1990, 35(10): 990−999.
[6] Franco A, Roca E, Lema JM. Granulation in high-load denitrifying upflow sludge bed (USB) pulsed reactors. Water Res, 2006, 40(5): 871−880.
[7] Tang CJ. Characteristics and control strategies of ANAMMOX process. Hangzhou: Zhejiang University, 2011 (in Chinese).唐崇俭. 厌氧氨氧化工艺特性与控制技术的研究[D]. 杭州: 浙江大学, 2011.
[8] Zheng P, Lin F, Hu B, et al. Performance of Anammox granular sludge bed reactor started up with nitrifying granular sludge. J Environ Sci, 2004, 16(2): 339−342.
[9] Tang C, Zheng P, Mahmood Q, et al. Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge. J Ind Microbiol Biotechnol, 2009, 36(8): 1093−1100.
[10] Van der Star WR, Abma WR, Blommers D, et al. Startup of reactors for anoxic ammonium oxidation: experiences from the first full-scale anammox reactor in Rotterdam. Water Res, 2007, 41(18): 4149–4163.
[11] van der Star WR, Miclea AI, van Dongen UG, et al. The membrane bioreactor: a novel tool to grow anammox bacteria as free cells. Biotechnol Bioeng, 2008, 101(2): 286–294.
[12] Xiong L, Wang Y, Tang C, et al. Start-up characteristics of a granule-based anammox UASB reactor seeded with anaerobic granular sludge. Biomed Res Int, 2013, 2013: 1–9.
[13] Van de Graaf AA, de Bruijn P, Robertson LA, et al. Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor. Microbiology, 1996, 142(8): 2187–2196.
[14] Zheng P, Hu BL. Study on growth kinetics ofanaerobic ammonia oxiadation biomass. Chin J Biotech, 2001, 17(2): 193–198 (in Chinese).郑平, 胡宝兰. 厌氧氨氧化菌混培物生长及代谢动力学研究. 生物工程学报, 2001, 17(2): 193–198.
[15] Kowalchuk GA, Bruijn FD, Head IM, et al. Molecular Microbial Ecology Manual. Dordrecht: Springer, 2007.
[16] Hu B, Zheng P, Tang C, et al. Identification and quantification of anammox bacteria in eight nitrogen removal reactors. Water Res, 2010, 44(17): 5014–5020.
[17] Jin R, Zheng P, Hu A, et al. Performance comparison of two anammox reactors: SBR and UBF. Chem Eng J, 2008, 138(1): 224–230.
[18] Cirpus IE, Geerts W, Hermans JH, et al. Challenging protein purification from anammox bacteria. Int J Biol Macromol, 2006, 39(1): 88–94. [19] Lu H, Zheng P, Ji Q, et al. The structure, density and settlability of anammox granular sludge in high-rate reactors. Bioresour Technol, 2012, 123: 312–317.
[20] Lindsay MR, Webb RI, Strous M, et al. Cell compartmentalisation in planctomycetes: novel types of structural organisation for the bacterial cell. Arch Microbiol, 2001, 175(6): 413–429.
[21] Fan KN. Introduction of Spectroscopy. Beijing: Higher Education Press, 2001 (in Chinese).范康年. 物理化学. 谱学导论. 北京: 高等教育出版社, 2001.
[22] Guo XL, Hu YY, Gao KR. Anaerobic granular sludge and its formation mechanism. Water Wastewater Eng, 2000, 26(1): 33–38 (in Chinese).郭晓磊, 胡勇有, 高孔荣. 厌氧颗粒污泥及其形成机理. 给水排水, 2000, 26(1): 33–38.
[23] Fuerst JA. Intracellular compartmentation in planctomycetes. Annu Rev Microbiol, 2005, 59: 299–328.
[24] Mao JJ. Vegetable waste prefromances of one-phase anaerobic digestion[D]. Beijing: Beijing University of Chemical Technology, 2010 (in Chinese).毛菁菁. 蔬菜废物中温单相厌氧消化性能研究[D]. 北京: 北京化工大学, 2010.
[25] Zhang L, Gao G, Tang X, et al. Impacts of different salinities on bacterial biofilm communities in fresh water. Can J Microbiol, 2014, 60(5): 319–326.
[26] Strous M, Fuerst JA, Kramer EH, et al. Missing lithotroph identified as new planctomycete. Nature, 1999, 400(6743): 446–449.
[27] Park H, Wells GF, Bae H, et al. Occurrence of ammonia-oxidizing archaea in wastewater treatment plant bioreactors. Appl Environ Microb, 2006, 72(8): 5643–5647.
[28] Hu AY, Jiao NZ. ammonia oxidizing archaea --A hot study of environmental microbial ecology. Prog Nat Sci, 2009, 19(4): 370–379 (in Chinese).胡安谊, 焦念志. 氨氧化古菌——环境微生物生态学研究的一个前沿热点. 自然科学进展, 2009, 19(4): 370–379.
[29] Wang Y, Zhu GB, Wang CX, et al. Coexistence, biodiversity and roles of ammonia-oxidizing archaea and anaerobic ammonium-oxidizing bacteria in deep soil layer of high nitrogen loaded paddy field. J Ecol, 2011, (6): 1487–1493 (in Chinese).王雨, 祝贵兵, 王朝旭, 等. 高含氮稻田深层土壤的氨氧化古菌和厌氧氨氧化菌共存及对氮循环的影响. 生态学报, 2011, (6): 1487–1493.
(本文责编 陈宏宇)
Physicochemical and ecological characteristics of the granular sludge during start-up of Anammox reactor
Yuxia Song1.2, Lei Xiong1.2, Liyuan Chai1.2, Qi Liao1.2, Chongjian Tang1.2, Xiaobo Min1.2, and Zhihui Yang1.2
1 School of Metallurgy and Environment, Central South University, Changsha 410083, Hunan, China
2 National Engineering Research Center for Heavy Metal Pollution Control, Changsha 410083, Hunan, China
The anaerobic granular sludge from an Internal Circulation (IC) reactor of a paper mill wastewater treatment plant were seeded in an Anammox upflow anaerobic sludge blanket reactor. After 185 days operation, the reactor was finally started up by increasing the influent ammonium and nitrite concentrations to 224 mg/L and 255 mg/L, respectively, with volumetric nitrogen removal rate increasing to 3.76 kg/(m3·d). The physicochemical characteristics of the cultivated Anammox granules were observed by scanning electron microscope, transmission electron microscope and FourierTransform infrared spectroscopy (FTIR). Results suggested that during the start-up course, the granular sludge initially disintegrated and then re-aggregated. FTIR spectra results revealed that the Anammox granular sludge contained abundant functional groups, indicating that it may also possess good adsorption properties. The ecological structure of the granular sludge, analyzed by the metagenomic sequencing methods, suggested that the relative abundance of the dominant bacterial community in the seeding sludge, i.e., Proteobacteria, Firmicutes, Bacteroidetes, significantly reduced, while Planctomycetes which contains anaerobic ammonium oxidation bacteria remarkably increased from 1.59% to 23.24% in the Anammox granules.
Anammox, upflow anaerobic sludge blanket reactor, granular sludge, Start-up characteristic, physicochemical characteristics, ecological structure
May 7, 2014; Accepted: August 13, 2014
Chongjian Tang. Tel/Fax: +86-731-88830875; E-mail:chjtang@csu.edu.cn
Supported by: National Natural Science Foundation of China (No. 51204213), the Special National Postdoctoral Science Foundation of China (No. 2013T60782), Key Project of the Science and Technology Program of Hunan Province (No. 2013WK2007).
国家自然科学基金 (No. 51204213),中国博士后科学基金 (No. 2013T60782),湖南省科技计划重点项目 (No. 2013WK2007) 资助。
Received: May 7, 2014; Accepted: August 13, 2014
Supported by: National Natural Science Foundation of China (No. 51204213), the Special National Postdoctoral Science Foundation of China (No. 2013T60782), Key Project of the Science and Technology Program of Hunan Province (No. 2013WK2007).
Corresponding author: Chongjian Tang. Tel/Fax: +86-731-88830875; E-mail:chjtang@csu.edu.cn
国家自然科学基金 (No. 51204213),中国博士后科学基金 (No. 2013T60782),湖南省科技计划重点项目 (No. 2013WK2007) 资助。
Received: May 7, 2014; Accepted: August 13, 2014
Supported by: National Natural Science Foundation of China (No. 51204213), the Special National Postdoctoral Science Foundation of China (No. 2013T60782), Key Project of the Science and Technology Program of Hunan Province (No. 2013WK2007).
Corresponding author: Chongjian Tang. Tel/Fax: +86-731-88830875; E-mail:chjtang@csu.edu.cn
国家自然科学基金 (No. 51204213),中国博士后科学基金 (No. 2013T60782),湖南省科技计划重点项目 (No. 2013WK2007) 资助。
