利用EGSB反应器富集高纯度厌氧氨氧化菌
2014-07-19黄晓丽高大文丛岩王小龙
黄晓丽,高大文,丛岩,王小龙
1 哈尔滨工业大学 城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090
2 中核能源科技有限公司,北京 100193
利用EGSB反应器富集高纯度厌氧氨氧化菌
黄晓丽1,高大文1,丛岩2,王小龙1
1 哈尔滨工业大学 城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090
2 中核能源科技有限公司,北京 100193
黄晓丽, 高大文, 丛岩, 等. 利用EGSB反应器富集高纯度厌氧氨氧化菌. 生物工程学报, 2014, 30(12): 1845–1853.
Huang XL, Gao DW, Cong Y, et al. Enrichment of anaerobic ammonium oxidation bacteria by expanded-granular sludge bed reactor. Chin J Biotech, 2014, 30(12): 1845–1853.
以储存60 d的ANAMMOX污泥为种泥,采用EGSB反应器富集高活性、高纯度的ANAMMOX菌富集培养物,考察反应器的脱氮能力,同时采用分子生物学方法鉴定培养前后ANAMMOX富集培养物中的优势菌种及ANAMMOX菌的相对丰度。在反应器运行的185 d中,最高氮负荷达3.0 kg N/(m3·d),氨氮与亚硝酸盐氮的去除效率均大于85%。培养后ANAMMOX富集培养物中的优势菌种由待定荧光布罗卡地菌Candidatus Brocadia fulgid和待定巴西布罗卡地菌Candidatus Brocadia brasiliensis变为待定亚洲杰特氏菌Candidatus Jettenia asiatica。FISH结果表明ANAMMOX菌所占总细菌的相对丰度明显增加,由 (57.69±4.79)%提高到(83.32±4.40)%。定量PCR结果证实了培养后的富集培养物内ANAMMOX菌的拷贝数由1.14×1011拷贝/g湿重提高到3.69×1011拷贝/g湿重。
ANAMMOX,待定亚洲杰特氏菌,荧光原位杂交,定量PCR,EGSB,富集培养
厌氧氨氧化(Anaerobic Ammonium oxidation,简称ANAMMOX) 菌是一类在厌氧(或缺氧) 条件下以亚硝酸盐为电子受体氧化铵盐的浮霉菌门细菌[1]。20多年的研究证实该菌在全球氮循环中发挥重要作用,广泛存在于自然界的各个系统 (海洋[2-3]、湖泊[4-5]、湿地[6]等) 中。基于ANAMMOX过程开发的脱氮工艺是目前已知的最为经济的新型生物脱氮技术[7],具有需氧量低、节约曝气成本、运行费用低、污泥产量少等优点。因此,ANAMMOX工艺在高氨氮废水处理领域有着广阔的市场需求和应用前景。然而,ANAMMOX菌对环境因素敏感,生长速度缓慢,倍增时间较长 (8−11 d),难以维持较高生物浓度[8-9]。特别是,ANAMMOX菌发现20多年以来,至今未实现纯培养。这些不仅限制了ANAMMOX工艺的进一步应用,还影响了对该菌生理生化特性的深入研究。研究表明ANAMMOX菌在细胞密度达到 1010个/mL 以上时才能显现活性[10],所以传统的微生物分离纯化的方法并不能获得ANAMMOX菌的纯培养。有研究人员利用密度梯度离心技术分离出了纯度高达99.6%的ANAMMOX菌[11],前提是获得具有较高纯度的ANAMMOX富集培养物。因此,利用反应器富集高密度、高活性及高纯度的ANAMMOX菌,可为后续的进一步分离培养及生理生化研究提供种源,对ANAMMOX技术的应用具有重要意义。
目前用于富集ANAMMOX菌的反应器主要有序批式反应器 (SBR),膜生物反应器(MBR)[9]及附着生长型反应器[12-13]。EGSB (Expanded-granular sludge bed,膨胀颗粒污泥床) 反应器具有高效的污泥持留能力,属于悬浮生长型富集装置,培养的微生物具有良好的物理结构、生态结构和沉降性能,且利于使培养物达到高密度及高活性,在富集相对较纯的ANAMMOX富集培养物方面具有一定优势。目前,EGSB反应器多应用于考察ANAMMOX反应器的启动性能及脱氮效能[14-16],关于利用其富集较高纯度ANAMMOX菌方面鲜有报道。
本研究以短期储存的ANAMMOX污泥为种源,利用EGSB反应器进一步富集高活性、高纯度的ANAMMOX菌,考察反应器的运行效能,同时采用分子生物学方法鉴定培养前后ANAMMOX富集培养物中的优势菌种及相对丰度。
1 材料与方法
1.1 实验装置与操作条件
实验采用的EGSB反应器结构见图1。反应器主体结构采用透明有机玻璃制成,有效容积为1.38 L,反应区容积为1 L,反应器壁设3个取样口。由加热套及温控仪 (XMTD-2002,上海项力实业有限公司) 控制温度,利用遮光布避光。反应器运行过程中控制温度为 (33±2) ℃,进水pH为7.2±0.3,回流比为6∶1。通过利用高纯氮气在进水中间歇曝气驱除进水中的溶解氧,保持进水溶解氧浓度 (DO) 低于0.8 mg/L。
1.2 接种污泥与试验废水
本研究中使用的ANAMMOX接种污泥取自于生产性规模厌氧氨氧化反应器的颗粒态ANAMMOX污泥,该反应器位于荷兰鹿特丹市政污水处理厂内[7],进水为Sharon 反应器的污泥硝化液。此污泥在4 ℃下经过60 d的短期储存,起始接种量为150 mL。实验中采用人工模拟废水,主要组成[17]:KHCO31 000 mg/L, KH2PO450 mg/L,MgSO4·7H2O 200 mg/L,CaCl2·2H2O 151 mg/L。微量元素与维生素溶液分别为0.5 mL,0.3 mL。氨氮与亚硝酸盐氮分别由 (NH4)2SO4和NaNO2提供,进水浓度比为1∶1.2,通过提高进水基质浓度或缩短HRT来提高反应器容积负荷。

图1 试验装置示意图Fig. 1 The reactor system.
1.3 分析项目及方法
氨氮浓度采用纳氏试剂分光光度法测定,亚硝酸盐氮浓度采用N-(1-萘基)-乙二胺分光光度法测定,硝酸盐氮浓度采用麝香草酚分光光度法测定,pH值和DO利用德国WTW (pH/Oxi 340i) 手提式多参数测试仪进行测定。
1.4 DNA提取、PCR扩增及克隆测序
DNA 提取采用细菌DNA提取试剂盒 (北京天恩泽基因科技有限公司)。16S rRNA基因的PCR反应采用ANAMMOX菌特异性引物Pla46F/Amx820R (表1)[18],PCR扩增程序:95 ℃预变性8 min;95 ℃变性40 s,59 ℃退火40 s,72 ℃延伸2 min,共进行30个循环;最后在72 ℃下延伸10 min。
PCR扩增产物使用柱式DNA胶回收试剂盒(北京天恩泽基因科技有限公司) 进行纯化。利用连接转化试剂盒 (上海生工生物工程股份有限公司) 将纯化的DNA产物与质粒载体pUCm-T进行连接后,转入到大肠杆菌感受态细胞中 (Trans5α,北京全式金生物技术有限公司),最后进行蓝白斑筛选。阳性克隆的检验使用引物M13±。随机挑取30个阳性克隆子进行测序 (上海生工生物工程股份有限公司)。将获得的序列输入GenBank数据库比对,并使用MEGA5.2序列分析软件构建系统发育树。
1.5 定量PCR
利用1.4中提取的总DNA,进行定量PCR实验。ANAMMOX功能基因引物hzocl1F1-hzocl1R2定量ANAMMOX菌hzo基因的数量(表1)[19-20]。通过分析富集培养物中hzo基因拷贝数的含量判断ANAMMOX菌富集的情况。定量PCR反应体系包括:10 μL 2×SGExcel Fast SYBR Mixture预混体系 (含ROX校正染料) (上海生工生物工程股份有限公司),3 μL DNA模板,0.5 μL正向引物 (10 mmol/L),0.5 μL反向引物(10 mmol/L)。qPCR定量分析仪采用ABI7500 (Foster City, CA, USA),使用icycleriQ5热循环仪和实时监测系统。反应程序为[20]:95 ℃预变性30 min;95 ℃下变性30 s,94 ℃下30 s,55 ℃下退火1 min,共进行40个循环;最后在72 ℃下延伸1 min。ANAMMOX标准曲线采用已知浓度的质粒DNA (北京阅微基因技术有限公司),以10倍稀释的方式获得系列浓度(1.90×101−1.90×109copies/mL)。样品中细菌及ANAMMOX菌相对DNA浓度以循环阈值表征。定量PCR扩增的特异性采用溶解曲线及凝胶电泳检验。每个样品做3个平行。
1.6 荧光原位杂交检测 (FISH)
取自EGSB反应器的微生物样品 (第3天、第185天)经清洗及固定后,采用冷冻包埋液包埋 (ES-LDB-003,EYSIN,日本) 并利用冷冻切片机 (Cryo-Star HM 560MV,MICROM,德国) 对包埋后的颗粒样品进行切片,约10 μm,切片放置在处理后的载玻片上。然后,切片样品经乙醇梯度脱水后杂交,进行FISH分析[21]。针对ANAMMOX菌,采用Cy3标记的Amx-368 (CCTTTCGGGCATTGCGAA) 探针 (上海生工生物工程股份有限公司);细菌使用DAPI (上海生工生物工程股份有限公司) 染色。在荧光显微镜 (BX2U-MWU2,Olympus,日本) 下观察并拍照,利用Image J软件分析FISH图片并计算样品中厌氧氨氧化菌的相对丰度。图片中红色荧光为ANAMMOX菌,蓝色荧光为全菌。

表1 本研究中使用的探针序列Table 1 Probe sequences used in this study
2 结果与分析
2.1 EGSB反应器脱氮效果及ANAMMOX效能
基质去除率和产物生成量的变化可以指示EGSB反应器中ANAMMOX菌的活性。本研究中,通过调整进水浓度与HRT来逐渐提高反应器的总氮负荷,进而不断富集ANAMMOX菌。反应器运行初期氨氮与亚硝酸盐氮进水浓度均为70 mg N/L,去除效率分别为50%与70%,容积总氮负荷0.76 kg N/(m3·d) (图2)。由于接种污泥为ANAMMOX污泥,虽然经过2个月的低温储存 (4 ℃),但仍具有一定的ANAMMOX活性,因此适应环境后很快进入活性提高期 (12−56 d)[22]。但由于基质浓度过高会影响ANAMMOX菌的活性并对其生长产生抑制作用[23-24],特别是亚硝酸盐[25],因此实验中平均进水氨氮、亚硝酸盐氮浓度提升一定浓度后不再继续提高,而通过逐渐降低HRT提高进水负荷。在反应器稳定运行阶段 (57−185 d),ANAMMOX富集培养物的活性较高,平均进水氨氮、亚硝酸盐氮浓度分别为(146.67±15.04) mg N/L,(183.48±14.02) mg N/L,氨氮与亚硝酸盐氮去除率分别为(86.39±8.33)%、(83.26±7.69)%。在运行期间(185 d) 中,最高总氮负荷为3.80 kg N/(m3·d) 时,最大容积总氮去除负荷为3.00 kg N/(m3·d) (图2B)。

图2 EGSB反应器脱氮效果Fig. 2 Performance of EGSB reactor.
EGSB反应器内ANAMMOX菌能够形成颗粒污泥,获得具有较高密度的ANAMMOX富集培养物,从而获得高厌氧氨氧化活性。同时,颗粒污泥沉降性能良好,能够持留于反应器内。然而,与污泥持留效率很高的序批式反应器 (SBR) 相比[23], EGSB反应器除了具有较强的抗基质浓度冲击的性能外,还具有承受更高容积氮负荷的潜力[14]。
2.2 ANAMMOX富集培养物中优势菌种系统发育分析
通过对接种ANAMMOX污泥的生物学性状分析,发现所获得的有效基因序列与Candidatus Brocadia fulgid (B. fulgid) 和Candidatus Brocadia brasiliensis (B. brasiliensis)的序列高度相似 (相似度大于99%) (图3)。经过185 d培养后得ANAMMOX培养物所获得的所有有效序列均与Candidatus Jettenia asiatica (J. Asiatica) 的序列高度相似 (相似度大于97%,序列提交至NCBI,编号分别为KJ002641) (图3)。B. fulgid与B. brasiliensis是污水处理系统中较常见的优势ANAMMOX菌[26],而J. asiatica最先发现于亚洲ANAMMOX颗粒污泥反应器及无纺布生物膜反应器中[27]。在培养前后,反应器内ANAMMOX富集培养物中的优势菌种发生了改变。这是由于接种污泥取自于市政污水处理厂,反应器进水为污泥消化液,而本实验采用人工配水,仅含有氨氮、亚硝酸盐氮、部分无机盐类及微生物生长所必需的微量元素与维生素,某些生长因子的变化导致了反应器内优势菌种的改变。由此可见,生长因子对ANAMMOX菌的生长具有重要作用[28-29]。
2.3 富集培养物中ANAMMOX菌的纯度分析

图3 富集培养物中ANAMMOX菌系统发育分析Fig. 3 Phylogenetic neighbour-joining tree between the ANAMMOX based on 16S rRNA genes.

图4 富集培养物FISH图片Fig. 4 The FISH photos of ANAMMOX enrichment culture.
对富集培养前后的微生物样品取样,用于FISH分析。结果表明在经过培养后,富集培养物中的ANAMMOX菌所占总细菌的比例明显增加(图4),相对丰度由 (57.69±4.79)%提高到(83.32±4.40)%。富集培养物呈明显的颗粒状,ANAMMOX菌主要分布在颗粒的内部,且分布密度较大,与文献[30]所报道一致。由于ANAMMOX菌能分泌胞外多聚物[31],有利于菌体团聚生长,团聚体结构是获得高密度的前提。同时,与附着生长型反应器相比,如序批式生物膜反应器 (SBBR)[12-32]、固定床反应器[33]、上流式生物膜反应器[34]、膨胀床反应器[13]等,利用EGSB反应器获得的悬浮生长型富集培养物不会因为受到填料限制产生纵向性能差异,富集培养物相对较纯,有利于后续ANAMMOX菌的进一步分离及相关生理生化特性分析。
为进一步确定富集培养物中ANAMMOX菌的相对丰度,利用定量PCR技术考察了富集培养物中ANAMMOX菌拷贝数,结果如图5所示。与接种污泥相比,培养185 d后的富集培养物中的hzo基因拷贝数有明显提高。培养后富集培养物中ANAMMOX菌hzo基因拷贝数由1.14×1011拷贝/g湿重提高到3.69×1011拷贝/g湿重。通过以上的分析,可见EGSB反应器适合于富集ANAMMOX菌。这种具有较高纯度ANAMMOX菌富集培养物的获得,可以为后续的进一步菌种分离和相关基础研究提供种源。
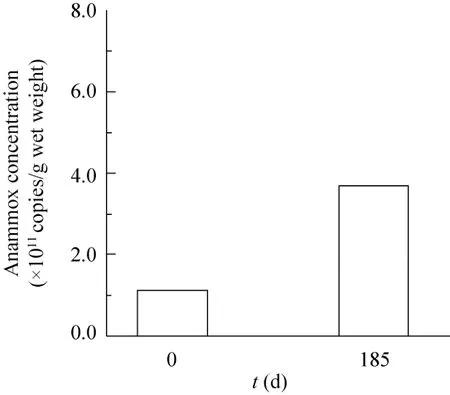
图5 富集培养物中ANAMMOX菌拷贝数Fig. 5 ANAMMOX gene copies in enrichment culture
3 结论
采用EGSB反应器,以经60 d储存的ANAMMOX污泥为接种污泥,获得了具有较高活性的ANAMMOX富集培养物,氨氮与亚硝酸盐氮去除率均大于85%,运行期间最高总氮去除负荷达3.0 kg N/(m3·d)。16S rRNA 克隆测序结果表明,ANAMMOX富集培养物中的优势菌种由培养前的B. fulgid与B. brasiliensis变为J. asiatica。FISH 及定量PCR分析技术表明,185 d后的富集培养物中ANAMMOX菌的比例明显增加,丰度由 (57.69±4.79)%提高到(83.32±4.40)%,且ANAMMOX菌hzo基因由1.14×1011拷贝/g湿重提高到3.69×1011拷贝/g湿重。
REFERENCES
[1] Mulder A, Vandegraaf AA, Robertson LA, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized-bed reactor. FEMS Microbiol Ecol, 1995, 16(3): 177–183.
[2] Kuypers MMM, Sliekers AO, Lavik G, et al. Anaerobic ammonium oxidation by anammox bacteria in the Black Sea. Nature, 2003, 422(6932): 608–611.
[3] Engstrom P, Penton CR, Devol AH. Anaerobic ammonium oxidation in deep-sea sediments off the Washington margin. Limnol Oceanogr, 2009, 54(5): 1643–1652.
[4] Schubert CJ, Durisch-Kaiser E, Wehrli B, et al. Anaerobic ammonium oxidation in a tropical freshwater system (Lake Tanganyika). Environ Microbiol, 2006, 8(10): 1857–1863.
[5] Penton CR, Devol AH, Tiedje JM. Molecularevidence for the broad distribution of anaerobic ammonium-oxidizing bacteria in freshwater and marine sediments. Appl Environ Microbiol, 2006, 72(10): 6829–6832.
[6] Zhu GB, Wang SY, Feng XJ, et al. Anammox bacterial abundance, biodiversity and activity in a constructed wetland. Environ Sci Technol, 2011, 45(23): 9951–9958.
[7] van der Star WRL, Abma WR, Blommers D, et al. Startup of reactors for anoxic ammonium oxidation: experiences from the first full-scale anammox reactor in Rotterdam. Water Res, 2007, 41(18): 4149–4163.
[8] Strous M, Kuenen JG, Jetten MSM. Key physiology of anaerobic ammonium oxidation. Appl Environ Microbiol, 1999, 65(7): 3248–3250.
[9] van der Star WRL, Miclea AI, van Dongen UGJM, et al. The membrane bioreactor: a novel tool to grow anammox bacteria as free cells. Biotechnol Bioeng, 2008, 101(2): 286–294.
[10] Zheng P, Xu XY, Hu BL. Novel Biological Nitrogen Removal: Theory and Technology. Beijing: Science Press, 2004 (in Chinese).郑平, 徐向阳, 胡宝兰. 新型生物脱氮理论与技术. 北京:科学出版社, 2004.
[11] Strous M, Fuerst JA, Kramer EHM, et al. Missing lithotroph identified as new planctomycete. Nature, 1999, 400(6743): 446–449.
[12] Yu YC, Gao DW, Tao Y, et al. Start-up of anammox in a sequencing batch biofilm reactor (SBBR). Chin Environ Sci, 2012, 32(5): 843–849 (in Chinese).于英翠, 高大文, 陶彧, 等. 利用序批式生物膜反应器启动厌氧氨氧化研究. 中国环境科学, 2012, 32(5): 843–849.
[13] Zhang L, Zheng P. Performance of Anammox attached microbial film expanded bed reactor. Chin J Biotech, 2008, 24(7): 1240–1247 (in Chinese).张蕾, 郑平. 厌氧氨氧化膨胀床反应器的运行性能. 生物工程学报, 2008, 24(7): 1240–1247.
[14] Tang CJ, Zheng P, Wang CH, et al. Granulation and characteristics of extracellular polymers of anammox sludge in high-load EGSB reactor. Chin J Chem Eng, 2010, 61(3): 732–739 (in Chinese).唐崇俭, 郑平, 汪彩华, 等. 高负荷厌氧氨氧化EGSB 反应器的运行及其颗粒污泥的 ECP 特性. 化工学报, 2010, 61(3): 732–739.
[15] Tang CJ, Zheng P, Chen WJ, et al. Start-up and process control of a pilot-scale Anammox bioreactor at ambient temperature. Chin J Biotech, 2009, 25(3): 406–412 (in Chinese).唐崇俭, 郑平, 陈建伟, 等. 中试厌氧氨氧化反应器的启动与调控. 生物工程学报, 2009, 25(3): 406–412.
[16] Ding S, Zheng P, Tang CJ, et al. Characteristics of anaerobic sludges in Anammox-EGSB bioreactors started with different inocula. Chin J Chem Eng, 2011, 62(5): 1395–1401 (in Chinese).丁爽, 郑平, 唐崇俭, 等. 不同接种物启动Anammox-EGSB 反应器的污泥性能. 化工学报, 2011, 62(5): 1395–1401.
[17] Cong Y, Huang XL, Wang XL, et al. The faster-formation of anammox granular sludge. Chin J Chem Eng, 2014, 65(2): 664–671 (in Chinese).丛岩, 黄晓丽, 王小龙, 等. 厌氧氨氧化颗粒污泥的快速形成. 化工学报, 2014, 65(2): 664–671.
[18] Egli K, Fanger U, Alvarez PJJ, et al. Enrichment and characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate. Arch Microbiol, 2001, 175(3): 198–207.
[19] Schmid MC, Hooper AB, Klotz MG, et al. Environmental detection of octahaem cytochrome c hydroxylamine/hydrazine oxidoreductase genes of aerobic and anaerobic ammonium-oxidizing bacteria. Environ Microbiol, 2008, 10(11): 3140–3149.
[20] Tao Y, Gao DW, Wang HY, et al. Ecological characteristics of seeding sludge triggering a prompt start-up of anammox. Bioresour Technol, 2013, 133: 475–481.
[21] Schmid MC, Maas B, Dapena A, et al. Biomarkersfor in situ detection of anaerobic ammonium-oxidizing (anammox) bacteria. Appl Environ Microbiol, 2005, 71(4): 1677–1684.
[22] Ding S, Zheng P, Tang CJ, et al. Performances of Anammox-EGSB bioreactors started up with three different seeding sludges. Chin J Biotech, 2011, 27(4): 629–636 (in Chinese).丁爽, 郑平, 唐崇俭, 等. 三种接种物启动Anammox-EGSB 反应器的性能. 生物工程学报, 2011, 27(4): 629–636.
[23] Strous M, Heijnen JJ, Kuenen JG, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms. Appl Microbiol Biotechnol, 1998, 50(5): 589–596.
[24] Waki M, Tokutomi T, Yokoyama H, et al. Nitrogen removal from animal waste treatment water by anammox enrichment. Bioresour Technol, 2007, 98(14): 2775–2780.
[25] Lotti T, van der Star WRL, Kleerebezem R, et al. The effect of nitrite inhibition on the anammox process. Water Res, 2012, 46(8): 2559–2569.
[26] Kartal B, van Niftrik L, Rattray J, et al. Candidatus 'Brocadia fulgida': an autofluorescent anaerobic ammonium oxidizing bacterium. FEMS Microbiol Ecol, 2008, 63(1): 46–55.
[27] Quan ZX, Rhee SK, Zuo JE, et al. Diversity of ammonium-oxidizing bacteria in a granular sludge anaerobic ammonium-oxidizing (anammox) reactor. Environ Microbiol, 2008, 10(11): 3130–3139.
[28] van de Vossenberg J, Rattray JE, Geerts W, et al. Enrichment and characterization of marine anammox bacteria associated with global nitrogen gas production. Environ Microbiol, 2008, 10(11): 3120–3129.
[29] Trigo C, Campos JL, Garrido JM, et al. Start-up of the Anammox process in a membrane bioreactor. J Biotechnol, 2006, 126(4): 475–487.
[30] Imajo U, Tokutomi T, Furukawa K. Granulation of Anammox microorganisms in up-flow reactors. Water Sci Technol, 2004, 49(5/6): 155–163.
[31] Fernandez I, Vazquez-Padin JR, Mosquera-Corral A, et al. Biofilm and granular systems to improve Anammox biomass retention. Biochem Eng J, 2008, 42(3): 308–313.
[32] Li X, Huang Y, Yuan Y. The reactivation and enrichemnt of ANAMMOX bacteria. Environ Pollut Control, 2010, 32(1): 61–66 (in Chinese).李祥, 黄勇, 袁怡. 厌氧氨氧化菌活性恢复及富集培养研究. 环境污染与防治, 2010, 32(1): 61–66.
[33] Fux C, Marchesi V, Brunner I, et al. Anaerobic ammonium oxidation of ammonium-rich waste streams in fixed-bed reactors. Water Sci Technol, 2004, 49(11/12): 77–82.
[34] Liu J, Zuo JE, Zhu SQ, et al. A study on influences of BMTM carriers on starting-up of anammox process. Chin Environ Sci, 2010, 30(11): 1473–1478 (in Chinese).刘杰, 左剑恶, 朱书全, 等. BT (MT) 生物膜载体对厌氧氨氧化反应器启动的影响. 中国环境科学, 2010, 30(11): 1473–1478.
(本文责编 郝黄芳)
Enrichment of anaerobic ammonium oxidation bacteria by expanded-granular sludge bed reactor
Xiaoli Huang1, Dawen Gao1, Yan Cong2, and Xiaolong Wang1
1 State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, Heilongjiang, China
2 Chinergy Co., Ltd, Beijing 100193, China
An expanded-granular sludge bed (EGSB) reactor was set-up with artificial water by seeding a 60 d stored ANAMMOX sludge. The nitrogen removal efficiency of ANAMMOX enrichment culture in the reactor was determined. In addition, the main microbial populations and the relative abundance of ANAMMOX bacteria were investigated by molecular approaches. Results show that the maximum nitrogen removal rate was 3.0 kg-N·m-3·d-1after 185 d, and the ammonium and nitrite removal efficiencies were all over 85%. Analysis of 16S rRNA gene-cloning indicates that the mainmicrobial population in the ANAMMOX enrichment culture was changed from Candidatus Brocadia fulgid and Candidatus Brocadia brasiliensis (0 day) to Candidatus Jettenia asiatica (185 day). Fluorescence in situ hybridization analysis shows that the relative abundance of ANAMMOX bacteria was increased from (57.69±4.79)% to (83.32±4.40)%. The results of qPCR further indicate that the gene copies of ANAMMOX bacteria in the granules were increased from 1.14×1011copies/g wet weight to 3.69×1011copies/g wet weight.
ANAMMOX, Candidatus Jettenia asiatica, FISH, qPCR, EGSB, enrichment
March 17, 2014; Accepted: July 14, 2014
Dawen Gao. Tel/Fax: +86-451-86289185; E-mail: gaodw@hit.edu.cn
Supported by: National Natural Science Foundation of China (No. 21177033), National Water Pollution Control and Management Technology Major Projects (No. 2013ZX07201007).
国家自然科学基金 (No. 21177033),国家水体污染控制与治理科技重大专项 (No. 2013ZX07201007) 资助。
时间:2014-08-20 网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.140162.html
