嗜酸氧化亚铁硫杆菌细胞色素C家族afe_0378基因转录表达差异及生物信息学挖掘
2014-07-18刘元东郭淑慧余润兰
刘元东, 郭淑慧, 余润兰
(中南大学 资源加工与生物工程学院 生物冶金教育部重点实验室,湖南 长沙 410083)
嗜酸氧化亚铁硫杆菌细胞色素C家族afe_0378基因转录表达差异及生物信息学挖掘
刘元东, 郭淑慧, 余润兰*
(中南大学 资源加工与生物工程学院 生物冶金教育部重点实验室,湖南 长沙 410083)
嗜酸氧化亚铁硫杆菌是一种极为重要的浸矿微生物,具有氧化各种还原性含硫物及亚铁等功能。采用实时荧光定量PCR技术及生物信息学等手段对该菌一个涉及铁硫氧化由afe_0378基因编码的细胞色素C家族蛋白CycA2进行了研究。结果表明,afe_0378基因在单质硫培养条件下转录水平是亚铁培养条件下的2.67倍。生物信息学分析表明afe_0378编码蛋白CycA2是分子质量为22.959 ku,pI为9.75的结合内膜的周质蛋白,二级结构为全α-螺旋,无β-折叠,包含2个相似结构域及N端一段跨膜疏水螺旋,属于细胞色素C4型蛋白家族。CycA2蛋白分子三维结构模建表明,双血红素与CycA2蛋白序列片段域C48-X-X-C51-H52及C149-X-X-C152-H153中的半胱氨酸共价连接。结合该菌硫代谢背景知识,推测CycA2蛋白的功能是介导细胞色素bc1复合体及终端氧化酶细胞色素aa3复合体之间的电子传递而参与硫代谢。
嗜酸氧化亚铁硫杆菌;细胞色素C4型蛋白;实时荧光定量PCR;生物信息学
嗜酸氧化亚铁硫杆菌(Acidithiobacillusferrooxidans,简称A.f)是生物浸矿应用中最为著名和非常重要的微生物之一[1-2],属革兰阴性化能自养嗜酸菌,好氧兼无氧呼吸,能量代谢途径复杂、灵活多样,尤其是对各种还原性含硫物及亚铁的能量代谢,是浸矿功能的关键[2],因而其铁硫代谢机制一直是研究的热点。目前,铁代谢机制已基本阐明。关于硫代谢机制模型虽有提出,但因硫化物氧化过程中多价态硫的中间产物的生成及化学氧化协同作用的复杂性,这些模型都未得到直接的实验验证[1,3-4]。细胞色素C4型蛋白是一类通过高度保守序列(CXXCH)共价结合2个血红素辅基为特征的蛋白家族,其功能通常是作为电子传递载体参与多种生物的氧化还原反应,如有氧呼吸等[5]。A.f菌是至今唯一发现基因组内含有4种C4型细胞色素蛋白同源基因的生物,且其C4色素蛋白有着高氧化还原电势、良好的耐酸性及高等电点等鲜明特征,是涉及铁硫氧化的重要候选者[6]。本研究中由afe_0378基因编码的CycA2蛋白即属其中之一。它位于petⅡ操纵子,该操纵子被认为参与以硫/甲酸为供体,O2/Fe3+为终端受体的电子传递过程[1]。但目前关于CycA2蛋白的功能并无定论。为彻底阐明该菌硫氧化代谢机制,弥补以往代谢模型中可能缺失的代谢步骤,展开预测或寻找新的酶及电子传递组分的研究具有重要意义。本文从分子转录水平进一步了解afe_0378基因mRNA表达规律,并利用生物信息学手段探索CycA2蛋白的结构及其在该菌硫代谢中发挥的作用。
1 材料与方法
1.1材料
1.1.1 菌株 原始菌株A.f菌ATCC 23270购自美国ATCC。
1.1.2 试剂及仪器Taq酶(R001A,TaKaRa)、DNA分子Maker(MD 109,天根生化);TRIzol(15596-026,Invirtrogen);DNase I(2212,TaKaRa);PrimeScriptTMRT reagent Kit with gDNA Eraser(RR047A,TaKaRa);RNeasy Mini Kit(74104, Qiagen); SYBR qPCR Mix (204054,Qiagen);Gel extraction kit(D6492-01,Omega)。PCR热循环仪(Bio-rad S1000TMThermal cycler)及实时定量PCR仪(Bio-rad icycler)凝胶成像系统(GelDoc,Bio-rad); NanoDrop®1000微量分光光度计(NanoDrop ND-1000)。
1.2方法
1.2.1 引物设计及合成 引物设计参考目的基因afe_0378(GenBank ID: 7134782)及内参基因rrs(GenBank ID:7136017)的基因序列,Primer premier 5.0软件设计,由南京金斯瑞生物技术有限公司合成。引物对(5′-3′):rrs-F (ACACTGGGACTGAGACACGG),rrs-R (ACCGCCTACGCACCCTTTAC),扩增片段长277 bp;afe_0378-F (AAAGCTGTACTTCGGTGGTCTGC),afe_0378-R (CCAGTGCCGTGATTTGTTTCG),扩增片段长230 bp。两目的片段共用同一PCR扩增参数,参数如下:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s, 72 ℃ 40 s, 共32个循环;72 ℃ 10 min。目的扩增片段经2%琼脂糖凝胶电泳及切胶回收后测序(上海生工生物工程有限公司),BLAST比对分析引物特异性,并做融解曲线分析。
1.2.2 总RNA提取及cDNA合成 菌体在每升9 K基础盐培养基中加入44.7 g FeSO4或10 g单质S,于180 r/min, 30 ℃空气振荡培养。血细胞计数法绘制菌体生长曲线。菌体生长进入对数期中期(Fe2+/44 h,S/107 h)时,滤纸过滤培养液中的黄钾铁矾或单质硫等杂质,于10 000 r/min,4 ℃离心20 min ,弃去上清,收集菌体沉淀。按照经典TRIzol法提取菌体RNA,得到的RNA经Qiagen公司的RNeasy mini kit 纯化及DNase I处理,以rrs引物对PCR验证基因组是否除去。纯化后的RNA质量通过1%的琼脂糖电泳及NanoDrop®1000微量分光光度计检测分析,再逆转录合成cDNA。
1.2.3 实时荧光定量PCR及数据处理 标准品的制备:标准曲线的DNA模板是RT-PCR后切胶回收纯化得到的目的扩增片段,微量分光光度计检测浓度,根据公式:拷贝数=6.02×1023×c/(Mw×Length)(c: 核酸浓度(ng/μL), Mw:碱基对相对分子质量(660),Length:目的扩增片段长度)计算拷贝数; 荧光定量反应体系:SYBR qPCR Mix (Qiagen) 10 μL,正反向引物各3 μL (终浓度为300 nmol/L),梯度稀释标准品模板1 μL,无RNase ddH2O补至20 μL;荧光定量PCR条件:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃延伸40 s,共40个循环。每次实验样品平行3份,重复2次实验。按照双标准曲线法公式:Fold= (待测组样品目的基因拷贝数/待测组样品内参基因拷贝数) / (对照组样品目的基因拷贝数/对照组样品看家基因拷贝数)计算afe_0378基因在Fe2+及S0培养条件下转录表达差异。
1.2.4 生物信息学分析afe_0378基因编码氨基酸的一级序列通过ProdictProtein在线软件(https://www.predictprotein.org/)进行蛋白的理化性质分析;利用signalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;利用在线分析软件InterPro(http://www.ebi.ac.uk/interpro/)预测蛋白的分类及结构域;I-TASSER(http://zhanglab.ccmb.med.umich.edu/I-TASSER/) 预测二级结构;以结晶结构已经得到解析的A.ferrooxidansCyc1(PDB ID:1H1O)蛋白[7]为模板,利用SIWSS-MODEL(http://swissmodel.expasy.org/)自动模式(automated model)在线同源建模。
2 结果与分析
2.1亚铁和硫能源培养下基因afe_0378转录差异
提到的总RNA经电泳检测,23S/16S rRNA条带亮度比值在1.8~2.2范围内,OD260/OD280=1.90~2.10范围内。PCR验证,电泳表明无条带出现(未给出图片),说明总RNA无基因组污染。反转录得到的cDNA经NanoDrop®1000微量分光光度计检测,在260 nm处有最大吸收峰,其中OD260/OD280在1.75~1.85范围内,表明总RNA、cDNA质量符合实验要求。PCR扩增片段经2 %琼脂糖凝胶电泳及切胶回收后,再次2 %琼脂糖凝胶电泳,结果表明扩增片段长度与期望相符;RT-PCR融解曲线表明未形成引物二聚体及非特异性扩增,说明设计引物质量实验可用(图1)。
目的基因afe_0378及内参基因rrs的标准曲线R2均≥0.98,扩增效率在100%~106%范围内(图2),说明标准曲线线性关系良好,可用于样品定量分析。RT-PCR实验显示,以单质硫为能源底物的培养条件下,afe_0378基因的数据为6.75E+05±3.69E+04,rrs基因的数据为9.63E+07±5.07E+06;以亚铁为能源底物的培养条件下,afe_0378基因的数据为5.01E+05±6.08E+04,rrs基因的数据为1.91E+08±1.31E+07;由双标准曲线法分析可得,afe_0378基因在以单质硫为能源底物的培养条件下较以亚铁为能源物质条件下表达量上调2.67倍,与文献报道的A.f菌硫代谢关键酶硫化物泛醌氧还酶的sqr基因[3]及内膜单核细胞色素C蛋白的afe_1130基因情况一致[4]。
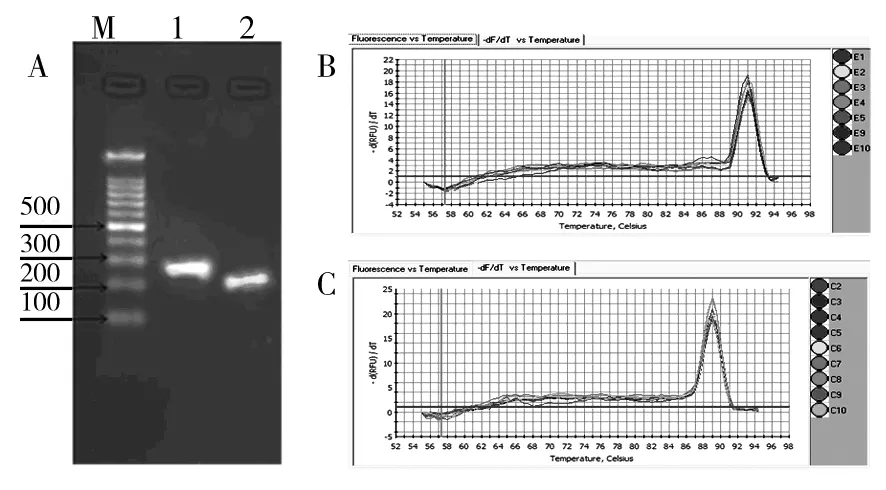
图1 引物特异性验证Fig.1 Verification of primer pairs’specificity
A:目的片段切胶纯化回收后电泳图;M:DNA Marker(100 bp DNA Ladder,天根);1:rrs基因目的扩增片段;2:afe_0378基因目的扩增片段;B:rrs基因融解曲线;C:afe_0378融解曲线分析
A: Electrophoresis of purified PCR product; M: DNA Marker(100 bp DNA Ladder,tiangen);1: The purified PCR product ofrrsgene;2:The purified PCR prdouct ofafe_0378 gene;B: The melt curve ofrrsgene;C: The melt curve ofafe_0378 gene
2.2基因afe_0378生物信息学分析
理化性质预测,afe_0378基因编码一个分子质量为22.959 ku,pI为9.75的亲水周质蛋白,该蛋白不稳定,但热稳定性强,在原核生物胞内半衰期超过10 h以上。信号肽预测分析在N端有一段长30个氨基酸的信号肽。跨膜预测在N端有一段疏水跨膜螺旋氨基酸序列,且定位在细胞周质中,因此CycA2可能通过一段疏水跨膜螺旋锚定在细胞内膜上并面向细胞周质侧,这与文献报道一致[6]。二级结构及结构域分析预测表明,α-螺旋占54.38%,无规卷曲占45.62%,没有β-折叠,这说明该蛋白属于α-螺旋类型。多序列比对分析显示CycA2蛋白有2个特征血红素结合片段域CXXCH(图3)。结构域分析表明该蛋白有2个相似的结构域,对应氨基酸序列分别是34~118位、125~217位,分别结合2个血红素辅基,属于典型细胞色素C4蛋白家族,该家族蛋白主要在微生物的呼吸链中作为中间电子传递载体[5]。
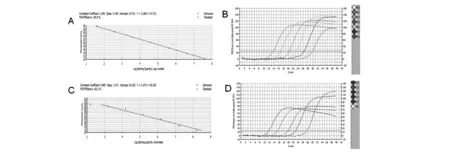
图2 实时荧光定量基因的标准曲线及扩增曲线图Fig.2 Standard curve and PCR quantification curve of real-time PCR

图3 多序列比对Fig.3 Multiple sequence alignment (the conserved characteristic sequences are framed)
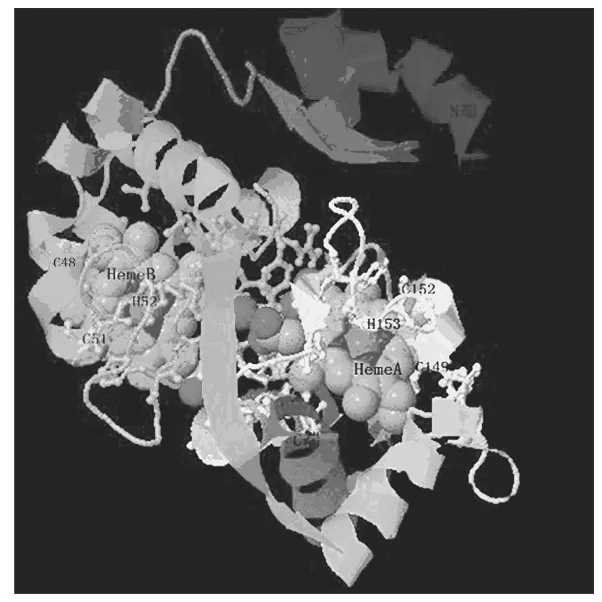
图4 CycA2的建模结构
2.4CycA2蛋白功能探讨
A.f菌有2套bc1复合体[1,3],其中1套称为正向bc1复合体,它发挥“正常”的生理功能,即将来自氢醌的电子传递给小分子氧还蛋白,然后再传给终端氧化酶细胞色素aa3复合体,它的3个亚基由petⅡ操纵子上的petABC2编码,已被推测参与硫代谢;另1套称为反向bc1复合体,即将来自小分子氧还蛋白的电子反向传递给氢醌,它的3个亚基由petⅠ操纵子上的petABC1编码,已被实验证实参与亚铁代谢。基因afe_0378正好位于petⅡ操纵子内。同一操纵子编码的蛋白可能相互作用完成同一功能代谢,因此推测CycA2是在硫代谢中发挥功能。本研究的生物信息学分析和结构预测结果表明,CycA2具有典型微生物电子传递细胞色素C4蛋白家族的特征,其蛋白的理化性质和结构特征与A.f菌中已经得到表征的正向电子传递链中细胞色素C蛋白相符,因此硫代谢中接收来自氢醌的小分子氧还蛋白就是CycA2。本研究的qRT- PCR实验显示了afe_0378基因在硫代谢条件上调,进一步证实了上述结论,这可能是因为在以单质硫为唯一能源的培养条件下,生物体需要大量表达相关基因来合成相应蛋白以充分获取能源。
3 结 论
亚铁培养和单质硫培养条件下转录差异结果表明,A.f菌的afe_0378基因在单质硫培养条件下表达上调,推测CycA2参与硫代谢。生物信息学分析和结构预测结果表明,CycA2属典型细胞色素C4蛋白家族蛋白,在A.f菌中对应于硫代谢中接收来自氢醌的小分子氧还蛋白。结合该菌硫代谢背景知识,推测CycA2蛋白的功能是介导细胞色素bc1复合体及终端氧化酶细胞色素aa3复合体之间的电子传递而参与硫代谢。
[1] Quatrini, R., Appia-Ayme, C., Denis, Y., et al. Extending the models for iron and sulfur oxidation in the extreme acidophileAcidithiobacillusferrooxidans[J].BMC genomics,2009,10:394.
[2] Rohwerder, T., Sand, W. Oxidation of Inorganic Sulfur Compounds in Acidophilic Prokaryotes[J].Engineering in Life Sciences,2007,7(4):301-309.
[3] Quatrini, R., Appia-Ayme, C., Denis, Y., et al. Insights into the iron and sulfur energetic metabolism ofAcidithiobacillusferrooxidansby microarray transcriptome profiling[J]. Hydrometallurgy,2006,83(1-4):263-272.
[4] Yuandong Liu, Shuhui Guo, Runlan Yu, et al. A New Cytoplasmic Monoheme Cytochrome c fromAcidithiobacillusferrooxidansInvolved in Sulfur Oxidation[J]. Current Microbiology,2014,68(3):285-292.
[5] Salemme FR. Structure and function of cytochromes c[J].Annu Rev Biochem,1977,46:299-329.
[6] Yarzábal A, Brasseur G, Bonnefoy V. Cytochromes c ofAcidithiobacillusferrooxidans[J].FEMS Microbiology Letters,2002,209(2): 189-195.
[7] Abergel, C., Nitschke, W., Malarte, G., et al. The structure ofAcidithiobacillusferrooxidansc(4)-cytochrome: A model for complex-induced electron transfer tuning[J]. Structure,2003,11(5):547-555.
DifferentialofTranscriptionExpression&BioinformaticsTappingofaCytochromecFamilyGeneofafe_0378inAcidithiobacillusferrooxidans
LIU Yuan-dong, GUO Shu-hui, YU Run-lan
(Schl.ofMin’l.Process. &Bioengin.,KeyLab.ofBio-MetallurgyofMin.ofEduc.,Cent.S.Uni.,Changsha410083)
Acidithiobacillusferrooxidansis a very important ore-immersing microbe possessing the functions of oxidation of various reductive inorganic sulfur compounds and ferrous. In this study quantitative real-time PCR and bioinformatic means were adopted to carry out the study involving cytochrome protein family aims at the CycA2 protein involved iron and sulfur oxidation encoded by geneafe_0378. The results showed that the down transcription level under sulphur simple substance-culturing conditions ofafe_0378 gene was 2.67-fold of that under ferrous culturing conditions. Bioinformatic analyses suggested that the molecular weight ofafe_0378 gene encoded CycA2 was 22.959 ku, endomembrane combined periplasmic protein of pI at 9.75. Its secondary structure was all α-helix without β-folding, and composed of two similar domains and a N-terminal transmembrane hydrophobic helix, and belonged to C4type protein family. The established model of CycA2 protein molecular three dimensions structure suggested that di-heme was linked covalently with cysteine of C48-X-X-C51-H52 and C149-X-X-C152-H153 in CycA2 protein sequence fragments domains. Combining the background knowledge about sulfur oxidation, it was speculated that the function of CycA2 was electron communication that intermediated cytochrome bc1complex and terminal oxidase cytochrome aa3complex participating in sulfur oxidation inAcidithiobacillusferrooxidans.
Acidithiobacillusferrooxidans; cytochrome C4protein; qRT-PCR; bioinformatics
国家自然科学基金(51274268,50904080);国家“973计划”项目(2010CB630900);中国博士后科学基金(2013M540643)
刘元东 男,副教授。研究方向为生物冶金及生物信息学。E-mail: lydcsu@gmail.com
* 通讯作者。男,教授。研究方向为生物电化学分析。E-mail:yrlcsu@gmail.com
2013-11-04;
2013-11-17
Q81
A
1005-7021(2014)02-0007-05
10.3969/j.issn.1005-7021.2014.02.002
