胞浆轻链测定在多发性骨髓瘤的微小残留病变检测中的价值
2014-07-18赵英男
赵英男,朱 杰
胞浆轻链测定在多发性骨髓瘤的微小残留病变检测中的价值
赵英男1,朱 杰2
目的探讨胞浆轻链检测在多发性骨髓瘤(multiple myeloma,MM)微小残留病变(minimal residual disease,MRD)检测的价值。方法采用四色流式细胞术,用CD45-APC/SSC及CD38/CD56/CD19及CD138联合设门,通过检测胞浆内轻链(cκ链、cλ链)对45 例经治疗后已完全缓解MM患者(治疗前已经过上述免疫分型检测)的骨髓标本进行微小残留病变的检测,同时进行跟踪随访,分析MRD对MM患者的复发率和无病生存时间是否存在影响。结果45例骨髓瘤患者中分泌型为37例(其中IgG型为27例,IgA型为10例),轻链型为5例(λ链型4例,κ链型1例),不分泌型3例。表型为CD38+CD56+CD19-CD45-出现的频率为,分泌型中100% (37/37),轻链型20%(1/5),不分泌型0%(0/3);表型为CD38+CD56-CD19-CD45-为,轻链型80%(4/5),不分泌型100%(3/3)。CD138+,100%(45/45);胞浆轻链(cκ链、cλ链),100%(45/45),其中分泌型:cκ链27%(10/37);cλ链:73%(27/37);轻链型:cκ链20%(1/5),cλ链:80%(4/5);不分泌型:cκ链33%(1/3),cλ链:67%(2/3),经治疗缓解后进行MRD检测,免疫表型为CD38+CD56+CD138+CD19-CD45-MRD阳性率为18%(7/38),免疫表型为CD38+CD56-CD138+CD19-CD45-MRD阳性率为100%(7/7),两组比较有统计学意义(P<0.05),cκ链组MRD阳性率为25%(3/12),cλ链组33%(11/33),两组比较差别无统计学意义。随访24个月后,MRD阴性组复发率13%(4/31),MDR阳性组复发率为71%(10/14),两组复发率比较,差异有统计学意义(P<0.05)。MRD阴性组累积无病生存时间中位数15.53(9.35~21.62)个月,明显长于MRD阳性组的9.75(3.69~14.24)个月,两组比较差异有统计学意义(P<0.05)。结论胞浆轻链测定在多发性骨髓瘤的微小残留病变检测中可以作为临床判断预后的重要指标,并对临床开展相关治疗有指导意义。
多发性骨髓瘤;免疫表型;胞浆轻链;流式细胞术;微小残留病变
多发性骨髓瘤(multiple myeloma,MM)是以克隆性恶性浆细胞(骨髓瘤细胞)在骨髓中异常增殖,并伴有单克隆免疫球蛋白(monoclonal immunoglobulin)增多为特征的疾病,多发于中老年人,临床表现多种多样。经典的化疗方案缓解率低,而随着新药问世、联合化疗和骨髓造血干细胞移植等新技术的应用,MM患者的缓解率不断提高。多参数流式细胞术免疫表型分析有助于MM诊断,而缓解后患者体内MRD分析是判断疗效和预后的重要指标。目前国内有关MRD的报道多为应用于骨髓瘤细胞的膜表面免疫表型。本研究应用多参数流式细胞术进行胞浆轻链的测定,以建立MRD分析方案,并探讨其临床意义。
1 对象与方法
1.1 对象 选取2010-01至2012-11大连医科大学附属第二医院住院确诊MM患者中经化疗后完全缓解病例45例,其中女12例,男33例,中位年龄60岁;初诊骨髓细胞学检查瘤细胞占15%~95%,其中分泌型为37例(IgG型27例,IgA型10例),轻链型为5例(λ链型4例,κ链型1例),不分泌型3例,其完全缓解后形态学及血清学均为阴性。
1.2 仪器和试剂 流式细胞仪:FACSCalibur 美国BD公司。CD38-FITC/CD56-PE/CD19-Percp、CD138-PE、CD45-APC、κ-FITC/λ-PE/ CD19- Percp、κ-FITC/λ-PE、IgG2a-FITC、IgG1-PE,溶血素、破膜剂,以上试剂均购自美国BD公司。
1.3 实验方法
1.3.1 标本处理 抽取0.2 ml骨髓液涂片作显微镜形态学检查;另抽取2 ml置于EDTA-K2抗凝血常规管作MRD检测,48 h内完成检验。骨髓涂片行瑞氏-吉姆萨染色,显微镜下观察并分类计数200个有核细胞。抗凝的骨髓液l ml,加3 ml PBS液,混匀后,在水平离心机上离心(1500 r/min,5 min),弃去上清液,加1 ml PBS液,计数白细胞数,调节至5×106/ml,制成细胞悬液备用。
1.3.2 胞膜标记及胞浆内轻链标记 (1) 胞膜的标记:每管100 μl细胞悬液分别加入(IgG2a-FITC、IgG1-PE、CD45-APC)、(CD38-FITC /CD56-PE/CD19-Percp、CD45-APC)、(CD138-PE、CD45-APC)、(κ-FITC/λ-PE/ CD19- Percp、CD45-APC)各20 μl,混匀避光15 min,加配置好的溶血素2 ml,避光10 min,在水平离心机上离心(1500 r/min,5 min),弃去上清液,加1 ml PBS液,混匀备用。(2)胞浆内轻链标记:取两只试管,每管100 μl细胞悬液分别加入CD45-APC 20 μl,避光15 min,再加入破膜剂A液100 μl,避光10 min,加溶血素2 ml,避光10 min,在水平离心机上离心(1500 r/min,5 min),弃去上清液,加入破膜剂B液50 μl,分别加入(IgG2a- FITC、IgG1-PE)、(κ-FITC/λ-PE),避光15 min,加2 ml PBS洗涤,在水平离心机上离心(1500 r/min,5 min),弃去上清液,加1 ml PBS液,混匀备用。
1.3.3 流式细胞仪测定 用荧光微球校准仪器及补偿后,用Cellquset软件收取(2~4)×105个细胞,通过CD45/SSC和CD38/CD56联合设门,确定瘤细胞的位置及抗原表达情况。
1.3.4 MRD分析 本实验组合CD38、CD56、CDl9、CD45、CD138进行四色MRD分析。根据散点图,先根据前角散射光(Fsc)和侧角散射光(Ssc)来设R1门,排除碎片的干扰,依照R1,再根据CD38和CD56散点图,选取CD38+CD56+/_的细胞团设R2门[1],再在CD45和Ssc及CD19和Ssc散点图上,根据R2的细胞团来选取CD45-CD19-细胞群设R3门,然后根据CD138+来确定R3细胞团是否是浆细胞团,最后根据异常胞浆κ/λ的表达,来确定是否是瘤细胞及其表达率 (图1,图2)[2]。根据此上的免疫分型,本研究设计了以下两种瘤细胞的免疫组合:CD19+CD38+CD56+CD45-CD138+和CD19-CD38+CD56-CD45-CD138+,来寻找浆细胞的位置,最后通过胞浆内轻链的表达率,来确定MRD的阳性率[3],其目的主要是排除正常浆细胞和其他有核细胞干扰。结果判断:目标细胞异常轻链表达>0.1%,即为MRD阳性[4]。
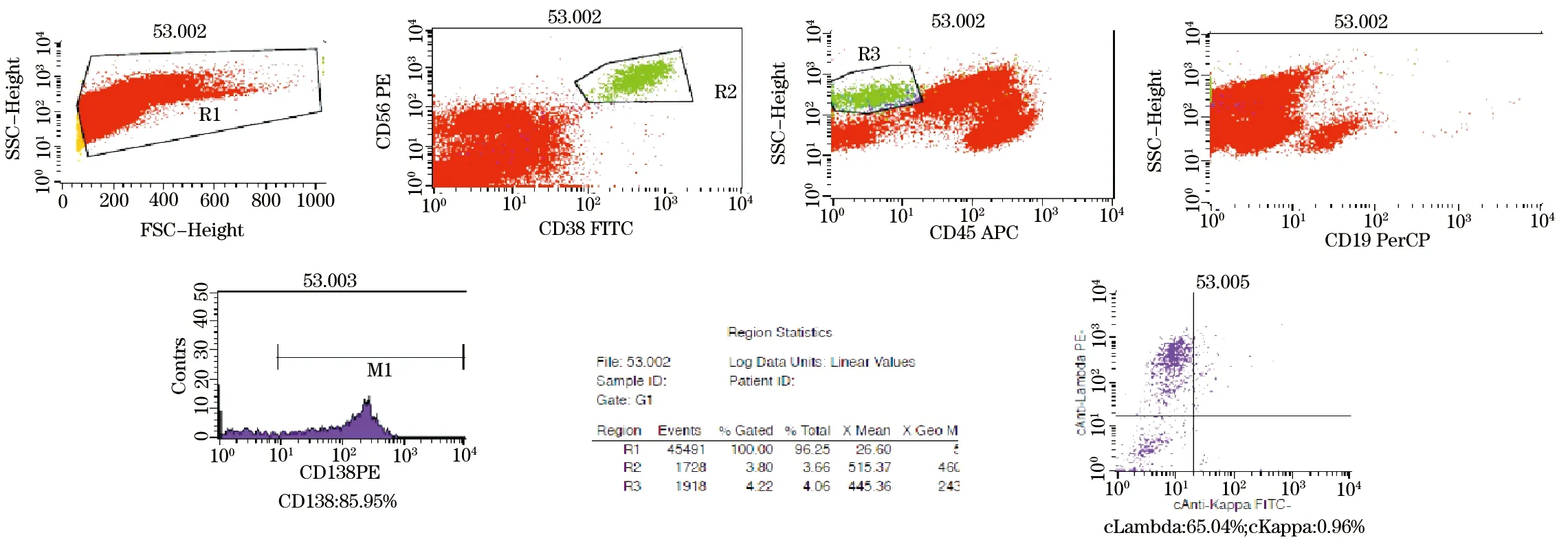
图1 免疫表型为CD38+CD56+CD138+CD19-CD45-

图2 免疫表型为CD38+CD56-CD138+CD19-CD45-
1.4 统计学处理 应用SPSS11.1软件包进行统计学分析,率的比较应用χ2检验;MRD两组间中位生存时间的比较应用log-rank检验,P<0.05为差异有统计学意义。
2 结 果
2.1 免疫表型及胞浆轻链表达 表型为CD38+CD56+CD19-CD45-出现的频率为:分泌型中100% (37/37),轻链型20%(1/5),不分泌型0%(0/3);表型为CD38+CD56-CD19-CD45-出现的频率为:轻链型80%(4/5),不分泌型100%(3/3),见表1。
2.2 两种免疫表型的MRD阳性率 CD38+CD56-CD138+CD19-CD45-的MRD的阳性率为100%(7/7),明显高于CD38+CD56+CD138+CD19-CD45-阳性率18%(7/38),两者比较差异有统计学意义(P<0.05)。
2.3 两种胞浆轻链的MRD阳性率 胞浆轻链(cκ链)MDR的阳性率为25%(3/12),胞浆轻链(cλ链)MDR的阳性率为33%(11/33),两者比较差异无统计学意义。

表1 多发性骨髓瘤45例细胞确诊时免疫表型及胞浆轻链的表达 (n;%)
2.4 复发率与无病生存时间 病例随访时间2~24个月。MRD阴性组31例中4例复发(13%),阳性组14例中10例复发(71%),两组复发率比较,差异有统计学意义(P<0.05)。MRD阴性组的累积无病生存时间中位数为15.53(9.35~21.62)个月,明显长于MRD阳性组的9.75(3.69~14.24)个月,两组比较差异有统计学意义(P<0.05)。
3 讨 论
MM传统意义上CR患者体内仍残留约1010个肿瘤细胞,被认为是疾病进展和复发的根源。传统的形态学检测和血、尿蛋白电泳等方法分析MRD有一定的局限性[5]。形态学是最普遍、最基础的检测手段,在一定程度上可反映治疗效果。但骨髓瘤细胞常呈灶状或斑点状分布,穿刺部位不同、骨髓稀释、制片不佳导致骨髓瘤细胞堆积在片尾或边缘都会降低瘤细胞的比例,且有时形态学上不易与正常浆细胞区分,也难以反映缓解期内肿瘤负荷的变化,且灵敏度仅能达到5×10-2水平[6]。血、尿蛋白电泳可间接反映肿瘤负荷量,但特异性较低,敏感度也不高[7]。笔者采用多参数流式细胞术研究MM 细胞的免疫表型特征及胞浆轻链的表达,并据此建立监测MRD的方法,为MM 的预后判断和个体化治疗提供可靠依据[8]。
欧洲骨髓瘤协作组(European Myeloma Network,EMN)在流式细胞术免疫分型方面达成共识,推荐MM分型至少要用CD38、 CD138、CD45三种抗体来识别浆细胞,初诊设浆细胞门要基于CD38/CD138的共表达[9]。笔者在此基础上初诊增加CD56、CD19、胞浆轻链(κ/λ)的检测,在所有45例的患者中,骨髓瘤细胞的免疫表型主要为两种表型CD38+CD56+CD138+CD19-CD45-和CD38+CD56-CD138+CD19-CD45-,并且都异常表达一种胞浆轻链,所谓的单克隆表达。根据以上免疫表型,利用CD45作为设门抗体,联合CD38、CD56、CD138、CD19来确定浆细胞的位置[10],因为CD45在绝大部分的浆细胞中不表达或者弱表达,而CD138为浆细胞共同抗原,而CD19为B细胞的抗原,通过检测CD19来排除B细胞膜表面轻链及排除一些相关的B细胞的疾病对此实验的影响,同时检测胞浆内轻链的含量来确定是否是骨髓瘤细胞和其残余量。而国内的相关文献报道一般利用三色或四色流式细胞仪通过检测浆细胞膜表面标志CD138或者CD38来检测MM的MRD更加准确和客观,避免把一些正常的浆细胞记入为瘤细胞[11]。
在本研究中发现免疫表型为CD38+CD56-CD138+CD19-CD45-的多发性骨髓瘤患者均为轻链型和不分泌型,并且MRD的检测均为阳性,提示此型的预后较差,但因收集的标本例数较少,尚需大样本数据支持。
MRD阳性的患者其复发率高于阴性的患者,而生存期短于阴性的患者,这就为临床监测和治疗骨髓瘤疾病提供了可靠的依据。对于处于完全缓解期的骨髓瘤患者,如果发现MRD阳性,应该巩固和加强治疗,以期望MRD转为阴性,来获得更好的疗效[6,12]。
对于骨髓瘤MRD的检测,初诊时应全面分析MM患者免疫表型和胞浆轻链,并且记录和保存好,特别是对一些轻链型和不分泌型的骨髓瘤患者,因为其血清学的表现尤为不明显,检测胞浆轻链显得尤为重要,这样才能为以后的MRD检测提供更可靠的依据。
尽管高剂量化疗联合自体造血干细胞移植已经可以使多数MM患者达到完全缓解,但复发仍是临床影响患者生存期的主要问题。多参数流式细胞术是目前检测MRD敏感性和特异性都很高的方法[13,14]。应用四色免疫荧光流式细胞术,通过CD45作为设门抗体,应用CD45-APC/SSC及CD38/CD56/CD19及CD138联合设门,通过检测胞浆内轻链(cκ链、cλ链)含量对多发性骨髓瘤微小残留病变监测以及判断预后具有重要价值,并对临床开展相关治疗具有指导意义。
[1] 陈葆国,罗文达,李伯利,等.多发性骨髓瘤流式细胞术免疫表型及微量残留病研究[J].中华检验医学杂志,201l,34(1):10-14.
[2] 张之南.血液病诊断及疗效标准[M]. 2版.北京:科学出版社,1998: 373-379.
[3] J Pefetti V,Viguarelli M C,Palladini G,etal.Insights into the regulation of immunoglobulin light chain gene rearrangements via analysis of the kappa light chain locus in lambda myeloma[J].Immunology,2004,112:420-427.
[4] 古 建,肖 平,陈焯文.微小残留病灶监测在多发性骨髓瘤的临床预后应用[J]. 中国热带医学,2012,12(7):848-850.
[5] Rawstron A C,Orfao A,Beksac M,etal.Report of the European Myeloma Network on muhiparametric flow cyt0metry in muhiple myeloma andrelated disorders[J].Haematologica, 2008, 93: 431-438.
[6] Gupta R,Bhaskar A,Kumar L,etal.Flow Cytometric Immunophenotyping and Minimal Residual Disease Analysis in Multiple Myeloma[J].Am J Clin Pathol,2009,132:728-732.[7] Lin P,Owens R,Tricot G,etal.Flow Cytometrie immunophenotypic analysis of 306 cases of multiple myeloma[J].Am J Clin Pathol,2004,121:482-488.
[8] Cumova J,Kovarova L,Potacova A,etal.Optimization of immunomagnetic selection of myeloma cells from bone marrow using magnetic activated cell sorting [J]. Int J Hematol,2010,92:314-319.
[9] 秦 燕,丁润生,陆 伟.多参数流式细胞术在多发性骨髓瘤诊断中的价值[J].交通医学,2009,23(2):137-140.
[10] 李金兰,刘艳荣,常 艳.多发性骨髓瘤细胞的免疫表型特点[J].中国实验血液学杂志,2002,10(3):226-228.
[11] Rawstron A C,Orfao A,Beksac M,etal.Report of the European Myeloma Network on muhiparametric flow cometry in multiplemyeloma and related disorders[J].Haematologiea,2008,93:431-438.
[12] Carlo-Stella C,Guidetti A,Dinicola M,etal.CD52 antigenexpressed by malign an t plasma cells can be targeted byalemtuzumab in vitro in NOD/SCID mice[J].Exp Hematol,2006,34:721-727.
[13] 庞 妍,李 力,邝丽萍,等.多发性骨髓瘤免疫表型研究进展[J].中国实验血液学杂志, 2011,19(6):1518-1522.
[14] 朱永梅,陈赛娟.微小残留病检测方法及其临床应用[J].中国实验血液学杂志,2005,13(6):1131-1136.
(2013-08-16收稿 2013-10-30修回)
(责任编辑 武建虎)
Valueofcytoplasmlightchaindetectioninminimalresidualdiseaseofmultiplemyeloma
ZHAO Yingnan1and ZHU Jie2.
Department of Clinical Laboratory, Dalian Hospital, Liaoning Provincial Corps of Chinese People’s Armed Police Forces, Dalian 116017, China; 2. Department of Laboratory, the Second Affiliated Hospital of Dalian Medical University, Dalian 116027, China
ObjectiveTo study the role of light chain detection in the minimal residual disease (MRD) of multiple myeloma (MM).MethodsThe light chains of 45 bone marrow samples from the patients who were diagnosed as having MM and showed complete remission after some treatments were tested using four color flow cytometry (CD45-APC/SSC, CD38/CD56/CD19 and CD138 were detected together). The positive rate of MRD was determined according to the results of flow cytometry and the progression of the disease of each patient was followed up. After that, whether the positive rate of MRD affected recurrence rate and disease free survival (DFS) of MM was analyzed.ResultsAmong the 45 cases, 37 were of secretory type (IgG 27 cases; IgA 10 cases); 5 were of light chain type (λ chain:4 cases; κ chain: 1 case) and 3 were of un-secretory type. As the frequency of immunophenotype, 37/37(100%) secretory type, 1/5(20%)light chain type and 0/3(0%)showed CD38+CD56+CD19-CD45-; 4/5(80%)light chain type and 3/3(100%)un-secretory type showed CD38+CD56-CD19-CD45-; 100% (45/45) cases showed CD138+and light chain in cytoplasm positive. Among secretory type cases, 10/37(27%)was cκ chain and 27/37(73%)was cλ chain. Among light chain type cases, 1/5(20%)was cκ chain and 4/5(80%)was cλ chain. Among un-secretory type cases, 1/3(33%)was cκchain and 2/3(67%)was cλ chain. After treatment, the samples from the complete remission patients were tested again. The positive rate of CD38+CD56+CD138+CD19-CD45-was 7/38(18%),which was significantly lower than that of CD38+CD56-CD138+CD19-CD45-(7/7, 100%),P<0.05. And there was no significant difference in MRD between cκ chain (3/12, 25%) and cλ chain (11/33, 33%),P>0.05. After 24 months’ follow-up, the recurrence rate in negative MRD group was 13%(4/31), which was significantly lower than that in positive MRD group (71%, 10/14),P<0.05. The median of disease-free interval in negative MRD group was 15.53 (9.35-21.62) months, which was significantly longer than that in positive MRD group 9.75 (3.69-14.24) months,P<0.05.ConclusionsThe detection of light chain in cytoplasm may be an important marker for predicting MRD in MM and it also may guide the direction of related clinic treatment.
multiple myeloma; immunephenotype; cytoplasmic light chain; flow cytometry; minimal residual disease
赵英男,本科学历,主管技师,E-mail: san.zhao@163.com
1. 116013,武警辽宁总队医院大连分院检验科;2. 116027,大连医科大学第二临床学院检验科
朱 杰,E-mail:zhujie1111@aliyun.com
R733.3
