雷帕霉素对顺铂作用下人肺腺癌A549及耐药A549/DDP细胞增殖、侵袭、黏附及自噬凋亡的影响*
2014-07-18高宝安
金 柱, 高宝安
(三峡大学第一临床医学院,宜昌市中心人民医院呼吸内科,湖北 宜昌 443003)
雷帕霉素对顺铂作用下人肺腺癌A549及耐药A549/DDP细胞增殖、侵袭、黏附及自噬凋亡的影响*
金 柱, 高宝安△
(三峡大学第一临床医学院,宜昌市中心人民医院呼吸内科,湖北 宜昌 443003)
目的: 研究雷帕霉素(Rap)对顺铂(DDP)作用下人肺腺癌A549及耐药A549/DDP 细胞增殖、迁移、黏附及其自噬凋亡的影响。方法: 培养人肺腺癌A549及耐药A549/DDP细胞株,利用MTT方法分别检测Rap和DDP单独与联合作用对A549及耐药A549/DDP细胞增殖抑制率的影响;Transwell方法检测Rap和DDP单独与联合作用对A549及耐药A549/DDP细胞体外侵袭能力的影响;黏附实验检测Rap和DDP单独与联合作用对A549及耐药A549/DDP细胞体外侵袭能力的影响;流式细胞术检测Rap和DDP单独与联合作用对A549及耐药A549/DDP细胞凋亡的影响;Western blotting检测Rap和DDP单独与联合作用对A549及耐药A549/DDP细胞自噬标志蛋白beclin-1和LC3表达的影响。结果: 与Rap或DDP单独作用组相比,Rap和DDP联合作用能够同时显著抑制人肺腺癌A549及耐药A549/DDP细胞增殖、体外侵袭能力及细胞黏附能力,并能够促进细胞凋亡和自噬标志蛋白beclin-1和LC3的表达(均P<0.05)。结论: Rap能够通过促进细胞自噬而增强DDP的作用,进而抑制人肺腺癌A549及耐药A549/DDP细胞的增殖、侵袭、黏附并促进细胞凋亡作用,具有协同作用。
雷帕霉素; 顺铂; 人肺腺癌细胞; 细胞凋亡; 细胞侵袭; 自噬
肺癌是目前世界上发病率和死亡率增长最快的一种恶性肿瘤,在我国发病率和死亡率也一直呈上升趋势,而其中以非小细胞肺癌(non-small cell lung cancer, NSCLC)为主,占到发病率的85%[1]。非小细胞肺癌患者一般发现较晚,确诊时大多已不易采用直接手术治疗,临床上多采用化疗作为NSCLC治疗的重要手段[2]。NSCLC的化疗多以铂类药物作为联合化疗的基础,顺铂(cis-diamminedichloroplatinum,DDP)是目前广泛使用并较有效的一线化疗药物,其对肿瘤细胞的抑制毒性作用主要通过形成铂-DNA复合物,但临床上使用易产生其耐药性从而制约了疗效[3]。肺癌的铂类耐药是影响化疗疗效的重要因素,因此如何解决肺癌的耐药性对于临床治疗NSCLC具有重要意义,而侵袭、黏附和凋亡等细胞功能作为恶性肿瘤的重要生物学特征,也是临床NSCLC患者治疗复发和死亡的主要原因[4]。雷帕霉素(rapamycin,Rap)是mTOR信号通路的特异性抑制剂,可通过抑制mTOR信号通路活化自噬,从而发挥肿瘤抑制效应[5]。A549/DDP是人肺腺癌系A549经DDP诱导产生的多药耐药性NSCLC细胞系,它同时对卡铂、氨甲喋呤等产生交叉耐药性[6]。本研究将mTOR信号通路抑制剂雷帕霉素Rap和DDP单独或联合作用,观察其能否增加DDP对人肺腺癌A549及耐药A549/DDP细胞的敏感性及对细胞增殖、侵袭、黏附、凋亡的影响,并探讨其是否通过促进细胞自噬发挥作用。通过本研究对摆脱肺癌化疗耐药现象,显著提高化疗效果具有重要意义。
材 料 和 方 法
1 细胞株与试剂
人肺腺癌A549及耐药A549/DDP细胞株购自北京中科院肿瘤医院中心细胞库,最大耐药倍数为12.47;RPMI-1640细胞培养基、EDTA和胰酶购自HyClone;胎牛血清购自Gibco;雷帕霉素、顺铂和二甲基亚砜(DMSO)购自Sigma;噻唑蓝(MTT)购自上海生工公司;Transwell Permeable Supports购自Corning;Matrigel基质胶购自B&D;Annexin V细胞凋亡试剂盒购自北京鼎国公司;兔抗人beclin-1、LC3和β-actin多克隆抗体购自Abcam;辣根过氧化物酶标记山羊抗兔IgG II抗、ECL化学发光试剂购自北京碧云天公司;其它试剂均为国产分析纯。
2 方法
2.1 人肺腺癌A549及耐药A549/DDP细胞株的培养 将购买的人肺腺癌A549细胞及其耐药A549/DDP细胞株在含10%胎牛血清、1%青霉素和链霉素双抗的RPMI-1640细胞培养基中培养,并置于37 ℃、5% CO2的细胞培养箱中。隔12 h换新培养基1次,待细胞长满培养瓶80%左右后进行细胞传代和冻存。将传代的A549及A549/DDP细胞进行连续培养以备实验使用。
2.2 MTT方法检测细胞增殖抑制率 将处于对数生长期的A549及A549/DDP细胞经含0.25%胰蛋白酶消化后进行细胞计数,并用RPMI-1640细胞培养基稀释细胞浓度为5×107/L接种于96孔板中,每孔为100 μL,每组同时设置6个复孔。细胞置于37 ℃、5% CO2的细胞培养箱中培养24 h后弃去上清培养基,并先后分别在A549及A549/DDP细胞中加入含不同浓度的Rap(0、0.5、1、2、4 μmol/L)、不同浓度的DDP(0、5、10、15、10 μmol/L)及Rap与DDP的联合作用组。设置调零组和空白对照组,连续培养48 h。每孔加入20 μL MTT(5 g/L)溶液继续温育4 h,后弃去上清,每孔加入150 μL DMSO振荡15 min,在酶联免疫检测仪检测570 nm处各孔吸光值(A),并计算各组细胞的生长抑制率。按公式计算各组细胞生长抑制率(%)=[1-(加药组A值-调零A值)/(对照组A值-调零A值)]×100%。
2.3 Transwell实验检测细胞体外侵袭能力 将各组分别用10 μmol/L DDP、2 μmol/L Rap、10 μmol/L DDP+2 μmol/L Rap预处理及对照组的A549细胞及其耐药A549/DDP细胞用0.25%含EDTA的胰酶消化液消化,离心后收集细胞并用RPMI-1640细胞培养基稀释细胞浓度为5×108/L。分别在各组Transwell板上室膜上涂匀1 g/L的Matrigel胶50 μL,并置于37 ℃、30 min使之在微孔膜上重塑成基底膜结构。将稀释的A549和A549/DDP细胞每组取100 μL接种于Transwell上室内,下室加入含20%胎牛血清的RPMI-1640培养基600 μL,每组设置3个重复,置于37 ℃、5% CO2培养箱中培养48 h。结束后,用4%多聚甲醛固定小室滤膜,用棉签擦去上表面的细胞,然后用结晶紫染色10 min后用PBS清洗2遍,在200倍显微镜下观察每组滤膜上穿过膜侵袭的细胞,并随机拍照计数计算各组肿瘤细胞侵袭抑制率。侵袭抑制率(%)=(1-处理组平均侵袭细胞数/对照组平均侵袭细胞数)×100%。
2.4 细胞黏附实验检测细胞黏附能力变化 在96孔板中每孔加入100 μL Matrigel胶(1 g/L),4 ℃下处理过夜后吸出Matrigel胶,37 ℃放置1 h。在Matrigel预处理的96孔板中每孔分别接种1×108/L的A549及A549/DDP细胞200 μL。设置空白对照组、10 μmol/L DDP组、2 μmol/L Rap组和10 μmol/L DDP+2 μmol/L Rap组,每组6个复孔。于37 ℃、5% CO2培养箱中培养0.5 h后弃去培养基并用PBS清洗2遍后(参照组不处理),加入100 μL培养液和20 μL MTT(5 g/L),在37 ℃孵育4 h后,吸出上清,加入150 μL DMSO,振荡10 min后,在酶联仪上测定490 nm波长时A值,计算各组细胞黏附率(%)=实验组黏附细胞A值/参照组黏附细胞A值×100%
2.5 流式细胞术检测细胞凋亡情况 将对数生长期的A549及A549/DDP细胞消化后分别接种于6孔板中,培养12 h细胞贴壁后,各自分成4组,即control组(PBS对照)、Rap组(2 μmol/L Rap)、DDP组(10 μmol/L DDP组)和Rap与DDP联合组(10 μmol/L DDP+2 μmol/L Rap),分别作用48 h后用PBS洗涤3次后,消化离心收集细胞。按照Annexin V/PI细胞凋亡检测试剂盒操作,先用500 μL PBS重悬各组细胞,再加入5 μL FITC标记的Annexin V和5 μL PI混匀避光孵育20 min,用PBS洗涤1次后,离心并用150 μL重悬细胞。运用流式细胞术检测各组细胞的凋亡率。
2.6 Western blotting检测细胞自噬 利用Western blotting检测细胞自噬标志蛋白beclin-1和LC3的表达。取对数生长期的A549及A549/DDP细胞,消化后用含10%的胎牛血清的RPMI-1640培养基培养并各分成4组处理。Control组加入PBS为对照, DDP处理组加入浓度为10 μmol/L的DDP, Rap处理组加入浓度为2 μmol/L 的Rap,而Rap和DDP联合处理组加入10 μmol/L DDP+2 μmol/L Rap,作用48 h后分别收集各组A549及A549/DDP细胞。用预冷PBS洗涤2次后,各加入100 μL的RIPA细胞裂解液振荡混匀后冰上裂解15 min提取细胞中总蛋白。后利用BCA试剂盒测定各组中细胞总蛋白浓度。各组上样30 μg总蛋白进行12%的SDS-PAGE 2 h,电泳结束后进行半干法转PVDF膜,用5%脱脂奶粉溶液封闭1 h后分别孵育兔抗人多克隆beclin-1、LC3和β-actin的I抗(1∶1 000),4 ℃孵育过夜后TBST溶液洗涤10 min 3次,加入HRP标记山羊抗兔II抗(1∶5 000),室温孵育2 h后TBST溶液洗涤10 min 3次。利用化学发光ECL试剂显影,曝光拍照。细胞自噬标志物beclin-1和LC3蛋白表达强度用Quantity One软件分析目的条带和内参照β-actin条带的灰度值表示。
3 统计学处理
所有实验数据用均数±标准差(mean±SD)表示。采用SPSS 13.0统计软件进行统计学分析,多组间数据比较采用单因素方差分析(One-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 雷帕霉素和顺铂对A549及A549/DDP细胞增殖的影响
如表1所示,与control对照组相比,不同浓度的Rap均能抑制A549及A549/DDP细胞增殖,增加细胞增殖抑制率。不同浓度Rap间,当Rap浓度大于2 μmol/L时能同时显著抑制A549及耐药A549/DDP细胞增殖(P<0.05)。但Rap对耐药A549/DDP细胞增殖抑制效应明显弱于同浓度组的A549细胞(P<0.05)。而不同浓度的DDP均能显著抑制A549细胞的增殖(P<0.05),但其对耐药A549/DDP细胞增殖抑制效应不明显,仅当DDP浓度大于15 μmol/L时,不同浓度组间A549/DDP细胞增殖才受显著抑制。同时同浓度组的DDP对A549/DDP细胞的抑制效应均显著低于A549细胞(P<0.05),验证了耐药A549/DDP细胞对顺铂具有强耐药性,见表2。为了揭示Rap和DDP联合作用对A549及A549/DDP细胞增殖的影响,利用MTT检测了2 μmol/L Rap和不同浓度DDP联合作用对A549及A549/DDP细胞增殖抑制率,结果见图1。研究发现与2 μmol/L Rap单独作用组相比,Rap和DDP联合作用均能显著抑制A549细胞的增殖(P<0.05);而联合作用DDP浓度大于10 μmol/L时,Rap和DDP联合作用同样能够显著抑制耐药A549/DDP细胞增殖(P<0.05)。因此,选择2 μmol/L Rap和10 μmol/L DDP研究其联合作用对人肺腺癌细胞株A549及耐药A549/DDP细胞的影响。
表1 不同浓度的雷帕霉素作用48 h对人肺腺癌A549及耐药A549/DDP细胞增殖抑制率的影响
Table 1.The inhibitory effect of rapamycin at different concentrations on the proliferation of A549 and A549/DDP cells (%.Mean±SD.n=6)
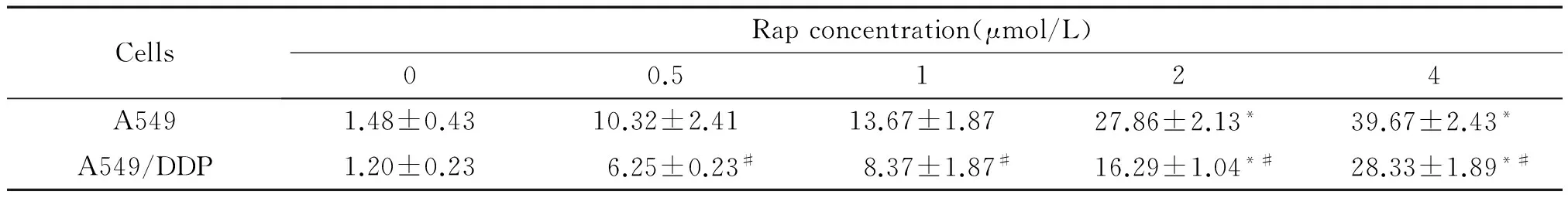
CellsRapconcentration(μmol/L)00.5124A5491.48±0.4310.32±2.4113.67±1.8727.86±2.13*39.67±2.43*A549/DDP1.20±0.236.25±0.23#8.37±1.87#16.29±1.04*#28.33±1.89*#
TableP<0.05vsother concentrations of Rap;#P<0.05vsA549 cells.
表2 不同浓度的顺铂作用48 h对人肺腺癌A549及耐药A549/DDP细胞增殖抑制率的影响
Table 2.The inhibitory effect of DDP at different concentrations on the proliferation of A549 and A549/DDP cells (%.Mean±SD.n=6)
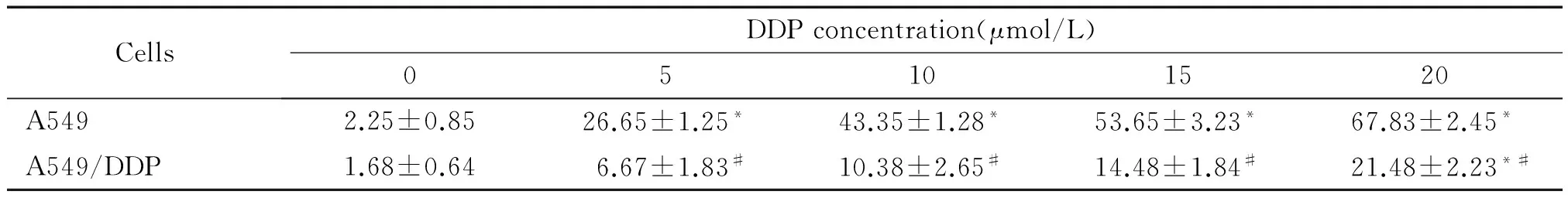
CellsDDPconcentration(μmol/L)05101520A5492.25±0.8526.65±1.25*43.35±1.28*53.65±3.23*67.83±2.45*A549/DDP1.68±0.646.67±1.83#10.38±2.65#14.48±1.84#21.48±2.23*#
TableP<0.05vsother concentrations of DDP;#P<0.05vsA549 cells.
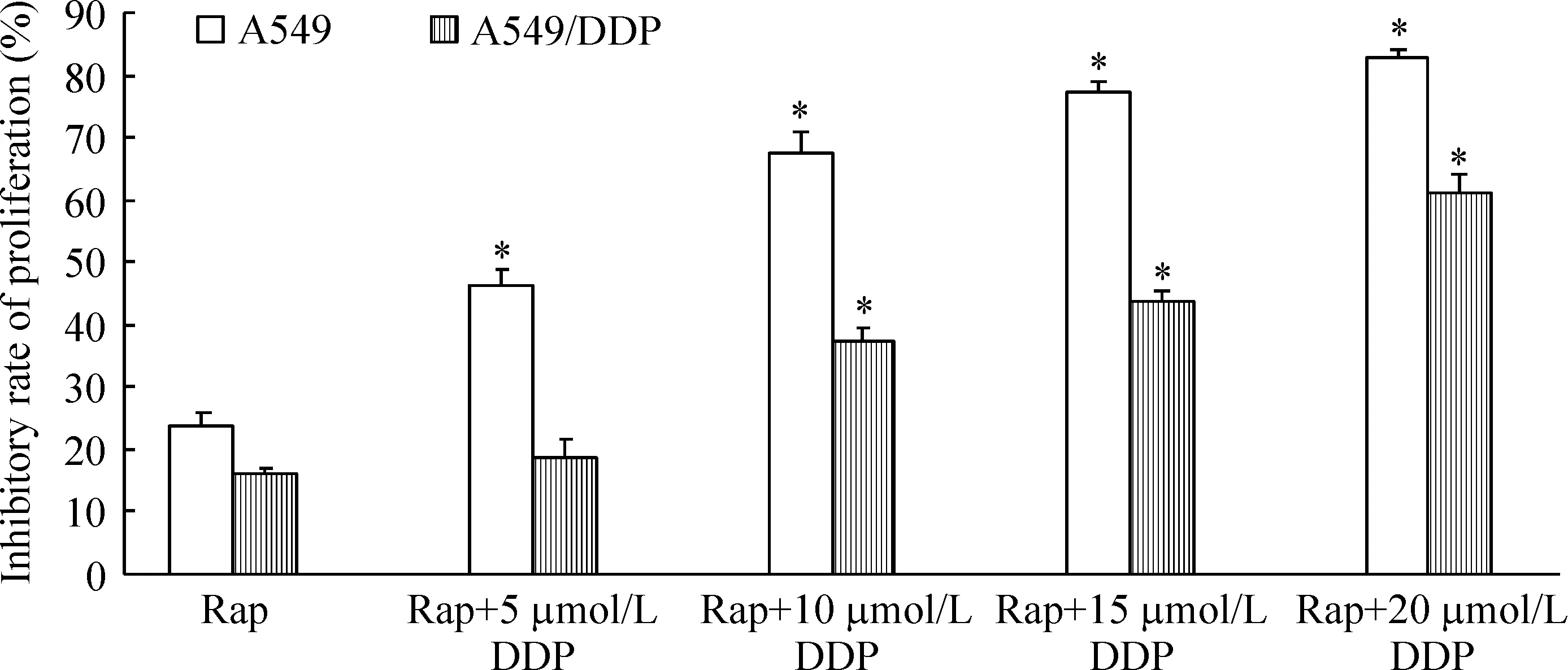
Figure 1.The inhibitory effects of Rap combined with DDP for 48 h on the proliferation of A549 and A549/DDP cells. Mean±SD.n=6.*P<0.05vsRap group.
图1 雷帕霉素和顺铂联合作用48 h对人肺腺癌A549及耐药A549/DDP细胞增殖抑制率的影响
2 雷帕霉素和顺铂对A549及A549/DDP细胞侵袭的影响
如图2所示,与control组相比,10 μmol/L DDP单独作用能够显著抑制A549细胞的体外侵袭能力,但对于耐药A549/DDP细胞作用不明显;2 μmol/L Rap单独作用对A549及A549/DDP细胞体外侵袭能力均有抑制作用;而2 μmol/L Rap和10 μmol/L DDP联合作用组中,A549及A549/DDP细胞体外侵袭能力均受到显著抑制,均强于单独作用组。对各组细胞侵袭抑制率进行统计,DDP单独作用对A549细胞侵袭的抑制作用明显(P<0.05),但对于耐药A549/DDP细胞却无明显作用。与Rap和DDP单独作用组相比,Rap与DDP联合作用组可以显著增加对A549及A549/DDP细胞的侵袭抑制率(P<0.05),说明Rap可以提升DDP对耐药A549/DDP细胞发挥侵袭抑制作用,且具有协同效应。
3 雷帕霉素和顺铂对A549及A549/DDP细胞黏附的影响
细胞黏附实验检测发现Rap和DDP联合作用同样可以显著抑制A549及耐药A549/DDP细胞的黏附能力,结果见图3。与control组相比,10 μmol/L DDP单独作用对A549细胞的黏附能力均有显著抑制效应(P<0.05),但对耐药A549/DDP细胞黏附抑制无明显作用。而2 μmol/L Rap作用于A549及A549/DDP细胞,对其黏附抑制能力均有明显抑制作用(P<0.05)。当Rap和DDP同时作用于A549及耐药A549/DDP细胞时,对细胞黏附抑制率显著提高,均高于Rap和DDP单独作用组(P<0.05)。

Figure 2.The invasion ability of A549 and A549/DDP cells treated with Rap and DDP by Transwell assay. A: the invasion ability of A549 and A549/DDP cells detected by Transwell assay (×100).B: the results of quantitative analysis. Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsDDP or Rap.
图2 Transwell检测雷帕霉素和顺铂对A549及A549/DDP细胞侵袭能力的影响
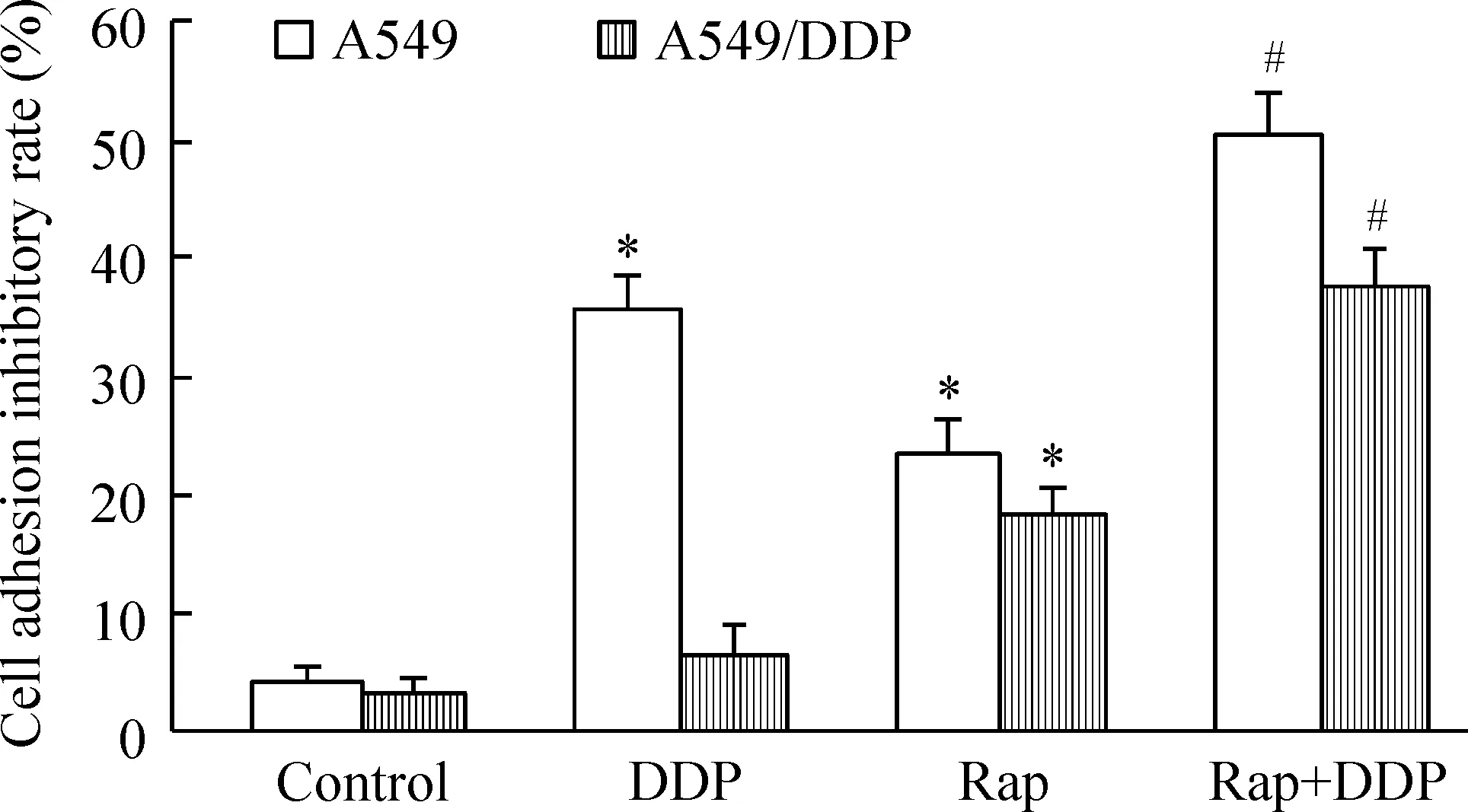
Figure 3.The adhesion ability of A549 and A549/DDP cells treated with Rap and DDP. Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsDDP or Rap.
图3 雷帕霉素和顺铂对A549及A549/DDP细胞黏附能力的影响
4 雷帕霉素和顺铂对A549及A549/DDP细胞凋亡的影响
与control组相比,2 μmol/L Rap和10 μmol/L DDP单独作用于A549细胞时,均能显著促进细胞凋亡(P<0.05);而Rap和DDP联合作用对A549细胞凋亡促进作用更加明显,均高于单独作用组(P<0.05),说明Rap和DDP促进A549细胞凋亡具有协同效应。与control组相比,10 μmol/L DDP单独作用于A549/DDP细胞时,细胞凋亡效应不明显,说明了A549/DDP细胞的耐药性。而当2 μmol/L Rap和10 μmol/L DDP同时作用于A549/DDP细胞时,耐药A549/DDP细胞的凋亡率却显著增加(P<0.05)。说明在Rap的作用下可以逆转耐药A549/DDP细胞对DDP的耐药性,见图4。

Figure 4.The apoptosis of A549 and A549/DDP cells treated with Rap and DDP. A: the apoptosis of A549 and A549/DDP cells detected by flow cytometry.B: the quantitative analysis of apoptotic rates. Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsDDP or Rap.
图4 雷帕霉素和顺铂对A549及A549/DDP细胞凋亡的影响
5 雷帕霉素和顺铂对A549及A549/DDP细胞自噬的影响
利用Western blotting检测细胞自噬标志蛋白beclin-1和自噬体双层膜形成蛋白LC3的表达,可以检测Rap和DDP对人肺腺癌细胞株A549及耐药A549/DDP细胞自噬的影响,结果见图5。与control组相比,DDP和Rap单独处理A549细胞可以显著诱导自噬标志蛋白beclin-1及LC3Ⅱ/LC3Ⅰ蛋白的表达(P<0.05)。而Rap和DDP同时作用于A549细胞时,beclin-1及LC3Ⅱ/LC3Ⅰ蛋白表达均显著高于DDP或Rap单独作用组(P<0.05),说明Rap和DDP联合作用可以促进A549细胞自噬。当DDP单独作用于耐药A549/DDP细胞时,自噬标志蛋白beclin-1及LC3Ⅱ/LC3Ⅰ蛋白均未见明显的表达变化,说明DDP对A549/DDP细胞自噬影响不明显。但Rap作为自噬活化剂,对耐药A549/DDP自噬仍然具有显著诱导作用,可以显著诱导自噬标志蛋白beclin-1及LC3Ⅱ/LC3Ⅰ蛋白表达(P<0.05)。当Rap和DDP联合作用于A549/DDP细胞时,与单独作用组相比,自噬标志蛋白beclin-1及LC3Ⅱ/LC3Ⅰ蛋白表达显著上升(P<0.05),说明Rap可以促进DDP对耐药A549/DDP细胞发挥自噬诱导作用,同时DDP对Rap发挥自噬诱导具有协同作用。
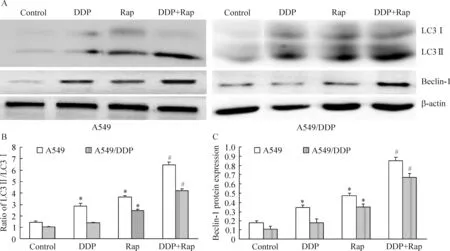
Figure 5.The autophagy of A549 and A549/DDP cells treated with Rap and DDP. A: the autophagy of A549 and A549/DDP cells detected by Western blotting; B: the ratio of LC3Ⅱ/LC3Ⅰ; C: the relative protein expression of beclin-1. Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsDDP or Rap.
图5 雷帕霉素和顺铂对A549及A549/DDP细胞自噬的影响
讨 论
目前,针对肺癌肿瘤的治疗不断有新化疗药物出现并且方案也更趋于完善,但肺癌细胞常常对化疗药物产生原发性或继发性耐药效应,从而导致肿瘤细胞转移、复发和化疗失败[7]。如何有效增加化疗药物的敏感性并抑制肺癌细胞的耐药性是当前亟需解决的难题。有数据表明[8],DDP作为广泛使用的化疗药物在多种恶性肿瘤治疗中均有较好效果,但NSCLC极易对顺铂药物产生耐药性。因此,临床上寻找可抵抗NSCLC对DDP耐药的方法和提升DDP化疗效果对于肺癌患者具有重要意义。本研究以NSCLC耐药标准细胞系A549和A549/DDP细胞为研究对象,观察在Rap干预下DDP对A549及耐药A549/DDP细胞增殖、迁移、黏附等细胞功能的影响变化,以揭示Rap能否对肺癌细胞A549/DDP的耐药性产生抵抗作用并增强DDP的药性。
A549细胞为对化疗药物敏感细胞株,而A549/DDP细胞为化疗药物耐受性细胞株[9]。当用相同浓度DDP同时处理A549和A549/DDP细胞时,DDP对A549细胞的增殖抑制率均显著高于耐药A549/DDP细胞,验证了A549/DDP细胞对DDP的耐药性。Rap作为临床免疫抑制剂,可通过影响mTOR信号通路抑制多种肿瘤细胞的增殖和细胞周期,但关于其对肺癌细胞的功能影响研究尚较少[10]。在本研究中当Rap浓度大于2 μmol/L时,对A549和A549/DDP细胞增殖均能产生显著抑制作用,因此选择2 μmol/L Rap和不同浓度的DDP联合作用研究其对A549和A549/DDP增殖抑制率的影响变化。当Rap和不同浓度DDP联合作用时,A549细胞的增殖抑制率均显著高于同浓度DDP单独作用组;而当联合作用DDP浓度大于10 μmol/L时,耐药A549/DDP细胞的增殖也受到显著抑制,但同浓度DDP单独作用对耐药A549/DDP细胞的增殖无明显影响。说明Rap可以提升DDP对A549及耐药A549/DDP细胞的敏感性。
肺癌细胞的侵袭转移是肺癌肿瘤恶性的生物标志,也常常是肺癌病人治疗失败和死亡的主要原因[11]。本研究利用Transwell实验发现人肺腺癌A549及耐药A549/DDP细胞在体外均具有较强侵袭能力,而当DDP和Rap单独作用于A549细胞时,细胞侵袭能力均受显著抑制,但DDP单独作用对耐药A549/DDP细胞的侵袭能力无明显影响。当Rap和DDP联合作用时,耐药A549/DDP细胞的体外侵袭能力却能显著下降,说明在Rap的作用下能够提升DDP对耐药A549/DDP细胞的侵袭抑制能力。而Rap和DDP联合作用对A549及A549/DDP的侵袭抑制能力均显著高于Rap和DDP各自单独作用组,说明Rap和DDP对抑制细胞体外侵袭能够发挥协同作用。同时肺癌细胞的转移机制不仅与侵袭能力有关,还涉及到细胞的黏附能力[12]。有研究指出,肿瘤细胞黏附力的强弱动态调节在肿瘤细胞的运动、转移和侵袭过程中发挥重要作用[13]。本文证实人肺腺癌A549及耐药A549/DDP细胞均具有较强黏附能力,与未处理对照组相比,DDP和Rap单独作用对A549细胞有明显的黏附抑制作用,且DDP发挥作用比Rap更明显。对耐药的A549/DDP细胞,DDP单独作用对其细胞黏附能力影响作用不明显,只有当Rap和DDP联合作用时耐药A549/DDP细胞的黏附能力才受显著抑制,且均高于Rap和DDP单独作用组,再次说明Rap可以作为DDP抑制耐药性肺腺癌A549/DDP细胞黏附能力的增敏剂。
细胞自噬,是亚细胞水平的自我吞噬,当细胞处于外界刺激或饥饿状态下时可通过消化自身细胞器清除细胞内垃圾,为细胞的再循环提供能量,因此低水平的细胞自噬在特定细胞环境下是一种自身保护机制,但当大量自噬发生时却能够诱导细胞凋亡[14]。细胞自噬在维持细胞自身稳态中起着重要作用,而细胞自噬功能异常在肿瘤发生、发展中也扮演重要角色。前期研究表明[15],细胞自噬作用既能使某些肿瘤细胞耐受应激刺激而获得更好生存,也能够发挥肿瘤抑制机制杀死肿瘤细胞,在肿瘤发展过程中起着抑制和促进的双重作用并可能相互转换。但针对许多相关肿瘤的研究也表明[16],肿瘤细胞的自噬能力常常低于正常细胞,而诱导肿瘤细胞的自噬活性能够促进细胞凋亡水平,提示能够通过诱导肿瘤细胞的自噬水平来防治肿瘤恶化。Beclin-1是细胞自噬作用中的关键蛋白,也是自噬的直接执行者,常被作为细胞自噬检测的标记蛋白[17]。LC3也是检测细胞自噬体形成的特异性标记蛋白,当细胞自噬形成时LC3可由胞浆型LC3-Ⅰ转变成自噬体膜型LC3-Ⅱ,而LC3-Ⅱ/Ⅰ比值的大小可估计细胞自噬水平的高低[18]。因此,本研究利用Western blotting检测Rap和DDP诱导处理人肺腺癌A549及耐药A549/DDP细胞中beclin-1和LC3蛋白的表达以揭示其对细胞自噬的影响变化。在未处理对照组中A549及耐药A549/DDP细胞中自噬标志蛋白beclin-1表达和LC3-Ⅱ/Ⅰ比值均较小,说明人肺腺癌A549及耐药A549/DDP细胞中自身自噬水平较低。当用自噬诱导剂Rap处理A549及耐药A549/DDP细胞时,beclin-1蛋白表达及LC3-Ⅱ/Ⅰ比值均有所上升;而DDP单独作用A549细胞时,细胞自噬水平同样上升,但对耐药A549/DDP细胞自噬水平影响不明显,说明耐药A549/DDP细胞对DDP化疗药物的耐受性也可能与抑制细胞自噬作用有关。而当Rap和DDP联合作用时,A549及耐药A549/DDP细胞中自噬标记蛋白beclin-1表达和LC3-Ⅱ/Ⅰ比值均显著上升且高于Rap单独诱导组,说明Rap可以刺激DDP对耐药A549/DDP细胞自噬发挥促进作用。另研究表明,当细胞自噬水平发生变化会影响细胞增殖、迁移、黏附、凋亡等细胞功能,而自噬与恶性肿瘤侵袭转移具有相关性[19]。本研究中Rap和DDP联合作用时,A549及耐药A549/DDP细胞增殖抑制率、侵袭抑制能力、黏附抑制能力及细胞凋亡率均显著上升,和其诱导细胞自噬水平具有一致性,说明Rap可以通过提升DDP对人肺腺癌A549及耐药A549/DDP细胞的自噬诱导作用,从而抑制细胞增殖、侵袭、黏附并促进细胞凋亡。因此,通过本研究首次发现Rap和DDP联合作用可以降低耐药A549/DDP细胞的耐药性并提高化疗药物DDP的敏感性,对于临床治疗非小细胞肺癌具有重要的指导意义。
[1] Shackelford DB, Abt E, Gerken L, et al. LKB1 inactivation dictates therapeutic response of non-small cell lung cancer to the metabolism drug phenformin[J]. Cancer Cell, 2013, 23(2):143-158.
[2] 刘换新, 吴晓霞, 张 燕, 等. 钾离子通道蛋白 Kir2. 1/KCNJ2 及多药耐药蛋白 MRP1/ABCC1 在小细胞肺癌中的表达及相关性[J]. 中国病理生理杂志, 2013, 29(11):1940-1945.
[3] Valle J, Wasan H, Palmer DH, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer[J]. New Engl J Med, 2010, 362(14): 1273-1281.
[4] Tang CH, Parham C, Shocron E, et al. Picoplatin overcomes resistance to cell toxicity in small-cell lung cancer cells previously treated with cisplatin and carboplatin[J]. Cancer Chemother Pharmacol, 2011, 67(6):1389-1400.
[5] 许成芳, 李小毛, 李 田, 等. 雷帕霉素增强子宫内膜癌细胞对阿霉素的敏感性[J]. 中国病理生理杂志, 2011, 27(11):2090-2095.
[6] 李文艳, 朱 珺. 雷帕霉素对人非小细胞肺癌细胞株 A549 生长及增殖的影响[J]. 上海交通大学学报:医学版, 2011, 31(3):275-278.
[7] Joshi M, Liu X, Belani CP. Taxanes, past, present, and future impact on non-small cell lung cancer[J]. Anti-cancer Drugs, 2014, 25(5):571-583.
[8] Gao Y, Baird AM, Barr M, et al. Epigenetic therapy for cisplatin resistance in non-small-cell lung cancer: the way forward?[J]. Lung Cancer Mgt, 2013, 2(1):1-4.
[9] Wang Q, Zhong M, Liu W, et al. Alterations of micro-RNAs in cisplatin-resistant human non-small cell lung cancer cells (A549/DDP)[J]. Exp Lung Res, 2011, 37(7):427-434.
[10]邓守恒, 喻雄杰, 柯贤柱, 等. 雷帕霉素增强 Ishikawa 细胞化疗敏感性实验研究[J]. 武汉大学学报:医学版, 2012, 33(1):55-58.
[11]Ramer R, Bublitz K, Freimuth N, et al. Cannabidiol inhibits lung cancer cell invasion and metastasis via intercellular adhesion molecule-1[J]. FASEB J, 2012, 26(4):1535-1548.
[12]Yang X, Popescu NC, Zimonjic DB. DLC1 interaction with S100A10 mediates inhibition ofinvitrocell invasion and tumorigenicity of lung cancer cells through a RhoGAP-independent mechanism[J]. Cancer Res, 2011, 71(8): 2916-2925.
[13]Chien ST, Lin SS, Wang CK, et al. Acacetin inhibits the invasion and migration of human non-small cell lung cancer A549 cells by suppressing the p38α MAPK signaling pathway[J]. Mol Cell Biochem, 2011, 350(1-2):135-148.
[14]吕 雷, 林 康, 高伟阳, 等. 饥饿诱导增生性瘢痕成纤维细胞自噬发生[J]. 中国病理生理杂志, 2013, 29(2):330-333.
[15]蒋 倩, 罗招阳, 张志伟, 等. 自噬与肿瘤关系的研究与进展[J]. 现代生物医学进展, 2013, 13(14):2783-2785.
[16]Xiong HY, Guo XL, Bu XX, et al. Autophagic cell death induced by 5-FU in Bax or PUMA deficient human colon cancer cell[J]. Cancer Lett, 2010,288(1):68-74.
[17]Kang R, Zeh HJ, Lotze MT, et al. The Beclin 1 network regulates autophagy and apoptosis[J]. Cell Death Differ, 2011, 18(4):571-580.
[18]Tanida I, Minematsu-Ikeguchi N, Ueno T, et al. Lysosomal turnover, but not a cellular level, of endogenous LC3 is a marker for autophagy[J]. Autophagy, 2005, 1(2):84-91.
[19]翁军权, 侯劲松. 自噬与恶性肿瘤侵袭转移的相关性[J]. 国际肿瘤学杂志, 2012, 39(6):408-411.
Effect of rapamycin on proliferation, invasion, adhesion, apoptosis and autophagy of human lung adenocarcinoma A549 and resistant A549/DDP cells treated with cis-diamminedichloroplatinum
JIN Zhu, GAO Bao-an
(DepartmentofRespiratoryMedicine,YichangCentralPeople’sHospital,TheFirstClinicalMedicalCollegeofChinaThreeGorgesUniversity,Yichang443003,China.E-mail: 222xiaozhao@163.com)
AIM: To study the effect of rapamycin (Rap) on the proliferation, invasion, adhesion, apoptosis and autophagy of human adenocarcinoma A549 and resistant A549/DDP cells treated with cis-diamminedichloroplatinum (DDP). METHODS: Human adenocarcinoma A549 and resistant A549/DDP cell lines were cultured. The inhibitory effects of Rap alone or combined with DDP on A549 and resistant A549/DDP cells were detected by MTT assay. Theinvitroinvasion abilities of the 2 cell lines treated with Rap alone or combined with DDP were detected by Transwell methods. Theinvitroadhesion abilities of the 2 cell lines treated with Rap alone or combined with DDP were detected by adhesion experiments. The apoptosis of A549 and resistant A549/DDP cells induced by Rap alone or combined with DDP was analyzed by flow cytometry. The cell autophagy marker proteins beclin-1 and LC3 in A549 and resistant A549/DDP cells treated with Rap alone or combined with DDP were detected by Western blotting.RESULTS: Compared with Rap or DDP alone group, the combination of Rap and DDP significantly inhibited the proliferation, invasion and adhesion of A549 and resistant A549/DDP cellsinvitro, and promoted the cell apoptosis and autophagy marker proteins beclin-1 and LC3 expression (allP<0.05).CONCLUSION: Rap enhances the effect of DDP through promoting the cell autophagy, thereby inhibiting the proliferation, invasion and adhesion of A549 and resistant A549/DDP cells and inducing the cell apoptosis with a synergistic effect.
Rapamycin; Cis-diamminedichloroplatinum; Human lung adenocarcinoma cells; Apoptosis; Cell invasion; Autophagy
1000- 4718(2014)12- 2120- 08
2014- 09- 23
2014- 10- 22
湖北省自然科学基金资助项目(No. 2011CDB178);湖北省教育厅中青年人才基金资助项目(No. Q20111202)
R730.23
A
10.3969/j.issn.1000- 4718.2014.12.002
△通讯作者Tel: 0717-6526428; E-mail:222xiaozhao@163.com
