旋毛虫感染黑线仓鼠及其白化突变系后细胞因子变化比较分析
2014-07-18张小飞崔晓霞张西臣白杰英
张小飞,刘 冉,2,崔晓霞,马 帅,张西臣,白杰英
(1.军事医学科学院实验动物中心,北京 100071;2.北京城市学院生物医药学部,北京 100081;3.吉林大学畜牧兽医学院,长春 130062)
研究报告
旋毛虫感染黑线仓鼠及其白化突变系后细胞因子变化比较分析
张小飞1,刘 冉1,2,崔晓霞1,马 帅1,张西臣3,白杰英1
(1.军事医学科学院实验动物中心,北京 100071;2.北京城市学院生物医药学部,北京 100081;3.吉林大学畜牧兽医学院,长春 130062)
目的 比较旋毛虫感染黑线仓鼠及其白化突变系后两种动物免疫状态的变化,建立适合感染寄生虫的动物模型。方法 用旋毛虫感染黑线仓鼠及其白化突变系后,通过检测血细胞生理值、脾脏 IL-2蛋白浓度和脾脏 IL-6基因表达水平,分析两种动物在感染旋毛虫前后免疫应答水平及免疫调控状态的变化。结果 黑线仓鼠在感染旋毛虫后免疫细胞及细胞因子的水平高于白化突变系,反应程度更加剧烈。结论 黑线仓鼠是旋毛虫感染的较为适宜的模型动物。
旋毛虫;黑线仓鼠;白化突变系;细胞因子
旋毛虫病是世界重要的食源性寄生虫人畜共患病。人旋毛虫病大多是由于吃了带有旋毛虫的生肉引起的,往往出现严重病症,有的能引起死亡[1]。据王中全等[2]报道,目前我国人旋毛虫病的暴发次数及发病人数与20世纪80~90年代相比有所下降,可能与旋毛虫感染率的降低、肉检工作的加强有关。人感染旋毛虫后大部分临床症状都是非特异性的,所以抗体检测对旋毛虫病的诊断具有重要意义。旋毛虫的发育包括新生幼虫、肌幼虫和成虫3个阶段,产生的抗原具有非常显著的期特异性[3],旋毛虫的宿主免疫系统对不同发育阶段的旋毛虫有着不同的免疫反应。细胞因子具有免疫调节作用,参与人体多种重要的生理功能。外来病原感染机体后,体内细胞因子存有量与部分功能将发生特异性变化。
黑线仓鼠(Cricetulusbarabensis)俗称中国地鼠(Chinese hamster),对许多致病细菌及病毒都具有高度的敏感性。如黑线仓鼠对白喉病比豚鼠更为易感,对结核菌的感染效果也远远超过小鼠,其症状和致病比豚鼠不仅早而且明显。黑线仓鼠白化突变系是新培育的动物品种,与黑线仓鼠在生化指标上有差异[4],本实验用旋毛虫感染黑线仓鼠及其白化突变系,分析比较两者细胞因子变化,判断机体免疫机能在感染前后的变化,建立最适旋毛虫感染仓鼠模型。该模型将有助于深入了解感染宿主的免疫应答水平及免疫调控状态,对旋毛虫病的临床诊治和免疫预防具有一定的指导意义。
1 材料和方法
1.1 实验动物
黑线仓鼠和黑线仓鼠白化突变系(简称白化仓鼠),体重(20~22)g,各18只(雌雄各半),8周龄,购自军事医学科学院实验动物中心[SCXK-(军)2007-004], 实验动物使用合格证号:[SYXK-(军)2007- 005]。
1.2 仪器和材料
胃蛋白酶和IL-2 ELISA kit(上海西唐); RNA(Qiagen);反转录试剂盒( PrimeScript RT reagent kit )、SYBR Premix Ex TaqTM II(TaKaRa);DNAMarker2000(康为世纪);Real Time PCR 扩增仪( Bio- Rar iQTM5);血液分析仪。旋毛虫获赠于吉林大学农学部畜牧兽医学院张西臣教授。
1.3 实验方法
1.3.1 旋毛虫制备及感染:取旋毛虫感染的小鼠全身肌肉,剪碎后用蛋白酶消化液消化,37℃,18 h。细胞筛过滤,37℃中沉淀1 h,弃去上部约2/3的液体,加3倍以上经过预热的生理盐水稀释。37℃中沉淀1 h,弃去上部约3/4的液体。重复洗3次,把最后剩下的液体用100目细胞筛过滤,用细胞计数板计数,获得旋毛虫脱囊幼虫,加细胞培养液至浓度为100条/100 μL。
黑线仓鼠和白化仓鼠均分为8组,每组2只,1~8组灌胃300条旋毛虫,9组灌胃生理盐水,感染后第3、5、7天、第2、3、4、5、6周采集黑线仓鼠和白化仓鼠的抗凝血和脾脏保存备用。
1.3.2 血液生理值测定:本次实验运用小鼠专用的血细胞分析仪测定,实验材料取自实验仓鼠的抗凝血。
1.3.3 脾脏IL-2 ELISA检测:用来自上海西唐生物科技有限公司的白介素-2ELISA试剂盒,实验采用双抗夹心-ELISA法。用抗小鼠IL-2单抗包被与酶标板上,标准品和样品中得IL-2与单抗相结合,加入生物素化的抗小鼠IL-2,形成免疫复合连接在板上,辣根过氧化物酶标记的streptavidin与生物素相结合,加入底物工作液后显蓝色,最后加终止液硫酸,在450 nm处测A值,绘制标准曲线计算标本中IL-2的浓度。
1.3.4 脾脏IL-6基因QRT-PCR检测:使用QIAGEN RNA kit提取黑线仓鼠与白化突变系脾脏总RNA,电泳检测其完整性,并使用ND2100 微量核酸蛋白测定仪测定核酸浓度和纯度。
反转录体系:5× PrimeScriptTM buffer 4 μL,PimeScript RT Enzyme Mix 1. 0 μL,Oligo (dT) primer 1.0 μL, 随机引物1.0 μL, Total RNA 2 μL,DEPC水加至20 μL。反应条件: 37℃ 30 min,85℃ 7 s,4℃ 保存。
根据Genbank上黑线仓鼠IL-6的DNA序列(序列号AF044667.1)设计引物,内参为β-actin。CIL-6上下游引物序列为5′-TTG GGA AAT TTG CCT ACT GAA-3′和5′-GTT TTG GTG GTG CTC TGA ATG AC-3′;β-actin上下游引物序列为 5′-AGT GTC CCA ACA TCC CAG C-3′和5′-GTG ACA CCG TCC CCA GAA T-3′,扩增产物长度149 bp。
标准曲线:以黑线仓鼠与白化突变系脾脏组织的 cDNA 为模板,按照3倍梯度稀释5个浓度标准,进行QRT-PCR扩增(表1)。

表1 荧光定量PCR反应体系Tab.1 Reaction system of the real-time PCR

2 结果
2.1 血液生理值结果
实验对血液生理值的4个指标进行统计分析,分别是白细胞计数(WBC)、淋巴细胞(LYM)、嗜酸性粒细胞(EOS)和嗜酸性粒细胞百分比(EOS%)。结果发现(图1),黑线仓鼠在感染后自第3天开始,WBC与LYM这两数值均高于同时期的被感染的白化黑线仓鼠;EOS曲线,黑线仓鼠与白化黑线仓鼠在第5天、第2、第6周时数值基本相等;EOS%曲线中,二者百分比值在第5天、第3周处基本持平,黑线仓鼠的嗜酸性粒细胞含量在感染第3天时达到峰值。
同时比较黑线仓鼠和白化仓鼠感染前后白细胞计数和淋巴细胞的数值变化,白化黑线仓鼠与黑线仓鼠在感染后1周时,与感染前相比,白细胞含量有明显增高,淋巴细胞在前3周明显增加。
2.2 脾脏IL-2 ELISA结果
标准标准样品绘制标准曲线图,IL-2浓度计算方程为y=(A - D) / [1 + (x/C)^B] + D(A=3.83758;B=-1.93713;C=18.43249;D=0.07703;r2=0.99590)。血清IL-2含量的变化如图2所示,在感染后第2周降低,从第二周后含量持续增长,黑线仓鼠和白化黑线仓鼠变化趋势相同,但黑线仓鼠的IL-2整体水平均高于白化黑线仓鼠。

A:白细胞数量;B:淋巴细胞数量;C:嗜酸性粒细胞数量;D:嗜酸性粒细胞百分比图1 黑线仓鼠及其白化突变系感染旋毛虫后血液生理变化 A:WBC number;B:LYM number;C:EOS number;D:EOS%Fig.1 Changes of blood physiology of the Cricetulus barabensis and the albino mutant infected with Trichinella spiralis
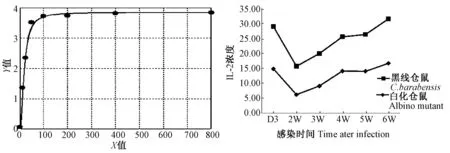
左图为标准曲线;右图为IL-2浓度曲线图2 黑线仓鼠及其白化突变系感染旋毛虫后脾脏IL-2含量变化 Left: Standard curve; Right: IL-2 levelFig.2 Changes of IL-2 levels in the spleen of Cricetulus barabensis and the albino mutant infected with Trichinella spiralis
2.3 脾脏IL-6 QRT-PCR结果
提取的RNA用ND2000微量核酸蛋白测定仪测定RNA浓度A260/A280。各组样品A260/A280的值在1.8~2.0之间,纯度较好。如图3和图4所示,IL-6与cβ-actin的扩增曲线均较为平滑,没有出现非正常的数值偏移,二者融解曲线中在85℃时均有一峰出现,且都为单一峰,判断为目的峰,图5中可以看出,二者的cβ-actin数值均较为平稳,黑线仓鼠的IL-6的含量自第3天开始至6周均为有规律的上下波动,白化黑线仓鼠的IL-6含量前3周有明显降低,自第3周起开始回升,第6周IL-6含量明显增加。

左图为融解曲线;右图为IL-6扩增曲线图3 黑线仓鼠及其白化突变系感染旋毛虫后脾脏IL-6 QRT-PCR反应 Left: Dissociation curves; Right: Amplification plots for IL-6Fig.3 IL-6 QRT-PCR reaction in the spleen of the Cricetulus barabensis and albino mutant infected with Trichinella spiralis

左图为融解曲线;右图为β-actin扩增曲线图4 黑线仓鼠及其白化突变系感染旋毛虫后脾脏β-actin QRT-PCR反应 Left: Dissociation curves; Right: Amplification plots for β-actinFig.4 β-actin QRT-PCR reaction in the spleen of Cricetulus barabensis and albino mutant infected with Trichinella spiralis

图5 黑线仓鼠(B)及其白化突变系(W)感染旋毛虫后脾脏IL-6变化曲线Fig.5 Changes of IL-6 in the spleen of Cricetulus barabensis (B) and the albino mutant (W) infected with Trichinella spiralis
3 讨论
血液生理值检测是判断宿主动物是否感染寄生虫的有效方法,同时可以反映机体全身免疫水平的变化。白细胞升高最常见原因是细菌感染,白细胞低说明免疫低下,极易感染各种病毒和细菌。刘向东研究发现旋毛虫感染早期(第7天)虫体周围以嗜酸性粒细胞为主,感染3周出现以淋巴细胞和单核细胞为主的炎细胞浸润[5]。外周血EOS含量增加是寄生蠕虫感染,特别是组织内寄生蠕虫感染时普遍存在的反应[6]。EOS必须在免疫血清存在的情况下才能发挥杀伤作用,免疫血清中的免疫分子补体和免疫球蛋白在其中发挥了重要作用[7]。杨树国等[8]发现小鼠外周血中性粒细胞及淋巴细胞于第14 天后逐渐上升趋势,21 d、28 d 达高峰,后逐渐下降。我们的研究发现,白细胞计数在仓鼠感染旋毛虫1周后与感染前有明显差异,白细胞总数升高,而淋巴细胞数值也在仓鼠感染旋毛虫3周时与感染前差异最为明显。通过图1可以看出仓鼠在感染旋毛虫后约在2周左右时生理值变化最为明显,其中白细胞计数以及淋巴细胞数值变化最为快速。与小鼠研究相比,黑线仓鼠感染旋毛虫后免疫细胞变化的峰值出现时间比小鼠更早,表明不同品系动物在免疫细胞的激活时间上有差异。
CD4+辅助细胞分为两种不同的效应群[9],Th1主要增强细胞介导作用,IL-2、IL-1β是Th1的重要细胞因子,Th2主要增强体液免疫作用,代表因子是IL-6。IL-1能激活胸腺细胞和T细胞,促进其增殖,表达IL-2受体,分泌细胞因子IL-2、IL-4、IL-6、INF-γ等,同时也是前炎性因子[10]。IL-2能够直接影响的维持细胞免疫功能的重要细胞因子,在宿主感染旋毛虫后的免疫反应中具有重要作用。在机体免疫应答中具有非常重要的作用,是一种免疫增强剂,具有抗病毒、抗肿瘤和提高机体免疫功能等作用[11]。
张光玉等[12]发现小鼠感染旋毛虫后1~5周IL-2的含量较正常组明显增加,且IL-2的含量呈下降趋势,至感染第6周时已基本降至正常水平。但我们研究却发现,黑线仓鼠及其白化突变系动物感染旋毛虫后,IL-2的含量从第2周至第6周呈上升趋势,表明黑线仓鼠的免疫反应性与小鼠有较大差异,不同动物对寄生虫的敏感性不同,黑线仓鼠及其白化突变系动物在旋毛虫移行至肌肉形成包囊的过程中,机体仍持续性分泌细胞因子,增强抵抗力。
IL-6又称B细胞刺激因子,是一种具有多种生物学活性的多效性细胞因子,包括刺激B细胞、胸腺细胞和T细胞分化,激活巨噬细胞和NK细胞,刺激肝细胞产生急性期蛋白(APP)而改变一系列在急性炎症反应中起关键作用的肝源性血清蛋白的浓度,几乎能影响免疫系统的所有细胞,主要诱导活化后期的B细胞,此IL-6在免疫反应及炎症反应中扮演重要角色。本试验应用SYBR green实时荧光定量技术以黑线仓鼠基因序列为靶基因设计了IL-6的引物,成功建立了黑线仓鼠和白化黑线仓鼠细胞因子快速定量检测方法。
对旋毛虫感染白化黑线仓鼠机体免疫水平的研究表明,该动物对寄生虫敏感,可作为旋毛虫病的感染动物模型应用,而且黑线仓鼠的免疫反应性比其白化突变系动物更高。该模型的成功建立,不仅对旋毛虫这类寄生虫病的预防、提早发现和诊断提供参考,而且还可以为后续的寄生虫病方面的深入研制以及相关药物研发提供帮助,未来具有较为广阔的发展空间。
[1] 丛恕增. 旋毛虫病综述 [J]. 中国兽医杂志, 1985, 06:46-49.
[2] 王中全, 崔晶. 旋毛虫排泄分泌抗原的研究进展 [J]. 中国预防兽医学报, 2003, 25(2):155-158.
[3] 崔晶, 王中全, 张玺,等. Ts21基因在旋毛虫不同期虫体的表达及特性的研究 [J]. 中国人兽共患病学报, 2009, 11:1057-1060.
[4] 赵爽, 王冬平, 刘晓, 等. 黑线仓鼠及其白化突变系血液生理生化值的测定与分析 [J]. 中国比较医学杂志, 2011, 21(7):17-21.
[5] 刘向东, 唐红炜, 王淑强. 旋毛虫感染小鼠肌组织的病理研究 [J]. 河北北方学院学报(医学版), 2007, 01:17-19.
[6] 闫玉文, 李鹏, 邢杰, 等. 中性粒细胞体外杀伤旋毛虫肌幼虫的实验观察 [J]. 热带医学杂志, 2006, 6(4):379-381.
[7] 邢杰, 董铮, 马萍, 等. IgE在小鼠旋毛虫感染急性期免疫反应中的作用 [J]. 热带医学杂志, 2010, 10(12):1372-1376.
[8] 杨树国, 钟萍, 张光玉, 等. 旋毛虫在小鼠体内的发育及炎性细胞反应的动态观察 [J]. 中国热带医学, 2012, 12(5):530-532.
[9] Constants L, Bottomly K. Induction of Th1 and Th2 CD4+T cell responses: the alternative approaches [J]. Annu Rev Immunol, 1997, 15(3):297-322.
[10] 王婷, 郑长青. 细胞因子在炎症性肠病发病机制中的作用 [J]. 世界华人消化杂志, 2005, 13 (1):72-75.
[11] Arai S, Tsuji M, Kim SJ, et al. Babesia canis infection in canine-red blood cell-substituted CID mice [J]. Int J Parasitol, 1998, 28(9):1429-1435.
[12] 张光玉, 王云甫, 黄朝芬, 等. IL-2对小鼠旋毛虫感染的影响 [J]. 热带医学杂志, 2006, 6(5):542-543.
Changes of cytokines in theCricetulusbarabensisand their albino mutant infected withtrichinellaspiralis
ZHANG Xiao-fei1, LIU Ran1,2, CUI Xiao-xia1, MA Shuai1, ZHANG Xi-chen3, BAI Jie-ying1
(1. Laboratory Animal Center, Academy of Military Medical Sciences, Beijing 100071, China;2. College of Biotechnology, Beijing City University, Beijing100081, China;3. College of Animal Science and Veterinary Medicine, Jilin University, Changchun 130062)
Objective To explore the differences in immune responses betweenCricetulusbarabensisand their albino mutant infected withTrichinellaspiralis. Methods The physiological parameters of blood, expression levels of IL-2 protein and IL-6 gene in the spleen were analyzed. Results The level of immune cells and cytokines ofCricetulusbarabensiswas higher than that in the albino mutant. ConclusionsCricetulusbarabensisis a suitable model animal for research on long-term latent infection such as infection withTrichinellaspiralis.
Trichinellaspiralis;Cricetulusbarabensis;Albino mutant;Cytokines
军事医学科学院创新基金(2012CXJJ022),动物中心青年基金(QN2011005),“十二五”重大项目(2011zxj09201-031)。
张小飞(1979-),女,实验师。E-mail: 15810074189@163.com。
白杰英(1977-),男,副研究员,主要从事实验动物免疫与生物化学研究。E-mail: baijieying@126. com。
R33
A
1671-7856(2014) 08-0011-05
10.3969.j.issn.1671.7856. 2014.008.003
2014-05-22
