鼠疫耶尔森氏菌YopD抗原基因在大肠杆菌中的克隆表达
2014-07-13申小娜张渝疆
郭 荣, 申小娜, 李 博, 陈 艳, 张渝疆
(1新疆医科大学, 乌鲁木齐 830011; 2新疆维吾尔自治区疾病预防控制中心, 乌鲁木齐 830002; 3中国疾病预防控制中心, 北京 102206)
鼠疫(Plague)是一种由鼠疫耶尔森氏菌(Yersinia pestis,简称鼠疫菌)引起的一种自然疫源性疾病,是一种古老但至今为止仍严重威胁人类健康的烈性传染病。20世纪80年代之后,在全球范围内鼠疫疫情呈明显上升趋势[1]。鼠疫免疫学诊断是鼠疫防治工作中的重要环节,是快速、敏感诊断鼠疫的方法之一。近年来,由于DNA疫苗能够诱导出较好的体液免疫和细胞免疫而日益受到重视[2]。YopD是耶尔森氏菌属特异蛋白,是由70 kb的毒力质粒-pCD1编码的,该编码质粒保守且对耶尔森氏菌毒力的发挥起到重要作用。YopD具有调节或转运 Yops定位攻击靶细胞的功能[3-4]。正是由于上述外膜蛋白的作用,使巨噬细胞不能有效吞噬病原体从而造成耶尔森氏菌仅在感染早期维持细胞内寄生,而在以后阶段主要是在细胞外存活和繁殖的现象。另有研究发现,重组的 YopD 抗原免疫小鼠能抵抗鼠疫耶尔森氏菌 C12 株(无荚膜) 的攻击(但不能抵抗同等剂量的有荚膜鼠疫耶尔森氏菌的攻击)[5]。有关研究认为,YopD可作为潜在的诊断靶点[6]。本研究选取鼠疫菌重要功能蛋白YopD进行克隆表达,为鼠疫潜在诊断靶点及新型疫苗的选择奠定基础。
1 材料与方法
1.1菌株与载体质粒以云南玉龙鼠疫菌株(D106004)DNA为聚合酶链式反应-PCR的模板(由中国疾病预防控制中心传染病预防控制所鼠疫室提供),表达质粒pET-32a(+)和感受态菌株E.coliBL21(DE3)分别购自Novagen和TaKaRa公司。
1.2主要试剂及仪器Taq DNA聚合酶购自上海生工生物工程公司,dNTP 购自TaKaRa BIOTECH公司,蛋白质分子量标准购自BIO-RAD公司,DNA分子量标准购自TransGen公司,质粒提取试剂盒购自天根生工生物工程公司,PCR产物纯化试剂盒购自QIAGEN公司,Easy PAGE Kit 购自Genstar公司,限制性内切酶(BamHI、XhoI)均购自Biolabs公司,T4 DNA Ligase 购自Promega公司,IPTG(异丙基-β-D-硫代半乳糖苷)购自Bio Basic INC。PCR 基因扩增仪、凝胶成像分析系统、核酸蛋白测定仪及垂直电泳仪均为Bio-Rad 公司产品,空气震荡培养箱为Forma Scientific 公司产品。
1.3方法
1.3.1 鼠疫相关蛋白的选取 通过查阅文献及基因比对的方法,选取鼠疫重要功能蛋白进行克隆表达,蛋白YopD长度921 bp,分子量52.8 ku,是耶尔森氏菌属特异蛋白。
1.3.2 重组表达质粒的构建
1.3.2.1 引物设计 根据NCBI公布的鼠疫菌D106004菌株的相应基因序列进行设计(表1),利用Primer5.0进行引物设计,引物由上海生工生物工程技术服务有限公司合成。

表1 扩增所选蛋白编码基因序列的引物
1.3.2.2 PCR扩增 以鼠疫菌D106004菌株DNA为模板及相应引物扩增目的基因,PCR扩增体系25 μL。PCR反应条件:95℃ 预变性5 min;94℃ 变性40 s,60℃ 退火40 s,72℃ 延伸1 min(35个循环);72℃ 延伸5 min。产物进行琼脂糖凝胶电泳检测或置4℃备用。
1.3.2.3 PCR产物电泳鉴定及纯化 扩增产物经1.0%琼脂糖凝胶电泳进行检测,电泳条件为120 V,30 min,凝胶成像仪检测拍照。将上述产物用 DNA 纯化回收试剂盒纯化回收,按操作手册进行,用 Nano Drop ND-1000 Spectrophotometer 检测浓度。
1.3.2.4 质粒的提取 将购买的PET-32a(+)用化学转化法转入E.coliBL21(DE3)中,挑取菌落于20 mL含氨苄抗生素(100 μg/mL)的LB液体培养基中,置摇床37℃培养至OD值约为2.0后,用小量质粒提取试剂盒提取质粒备用,操作方法按说明书步骤进行。产物以1%琼脂糖凝胶电泳,紫外灯下观察提取产物。
1.3.2.5 目的基因与质粒的双酶切、连接反应 将PCR 纯化产物与载体质粒PET-32a(+)分别进行双酶切,将酶切产物置于37℃过夜。随后用DNA纯化试剂盒纯化,将纯化后的目的基因和酶切载体质粒进行连接,酶切和连接参照产品说明书的方法进行。
1.3.2.6 转化 采用化学转化法将连接产物转入感受态细胞E.coliBL21(DE3)中,转化的细菌在Amp100 μg/mL的LB培养基平板上进行筛选。
1.3.3 重组蛋白的诱导表达 将阳性的克隆子接种在5 mL含Amp 100 μg/mL的LB液体培养基中,37℃,220 r/mim,培养3~4 h至OD值为0.3~0.4时,取1 mL菌液作为诱导对照,向剩余菌液中加诱导剂IPTG(终浓度为1 mmol/L),37℃、160 r/min,诱导4 h。
1.3.4 电泳分析 将诱导及未诱导菌液均进行十二烷基硫酸钠聚丙烯酰胺凝(SDS-PAGE)电泳(12%分离胶,5%积层胶)。 恒压电泳,积层胶用80 V,30 min,1%考马斯亮蓝R250染色,于脱色液中脱色,直至背景无色,将凝胶放于成像仪下进行成像分析。
2 结果
2.1目的基因的扩增产物目的基因的PCR扩增产物电泳图如图1所示,结果显示扩增产物片段长度与理论片段相符。
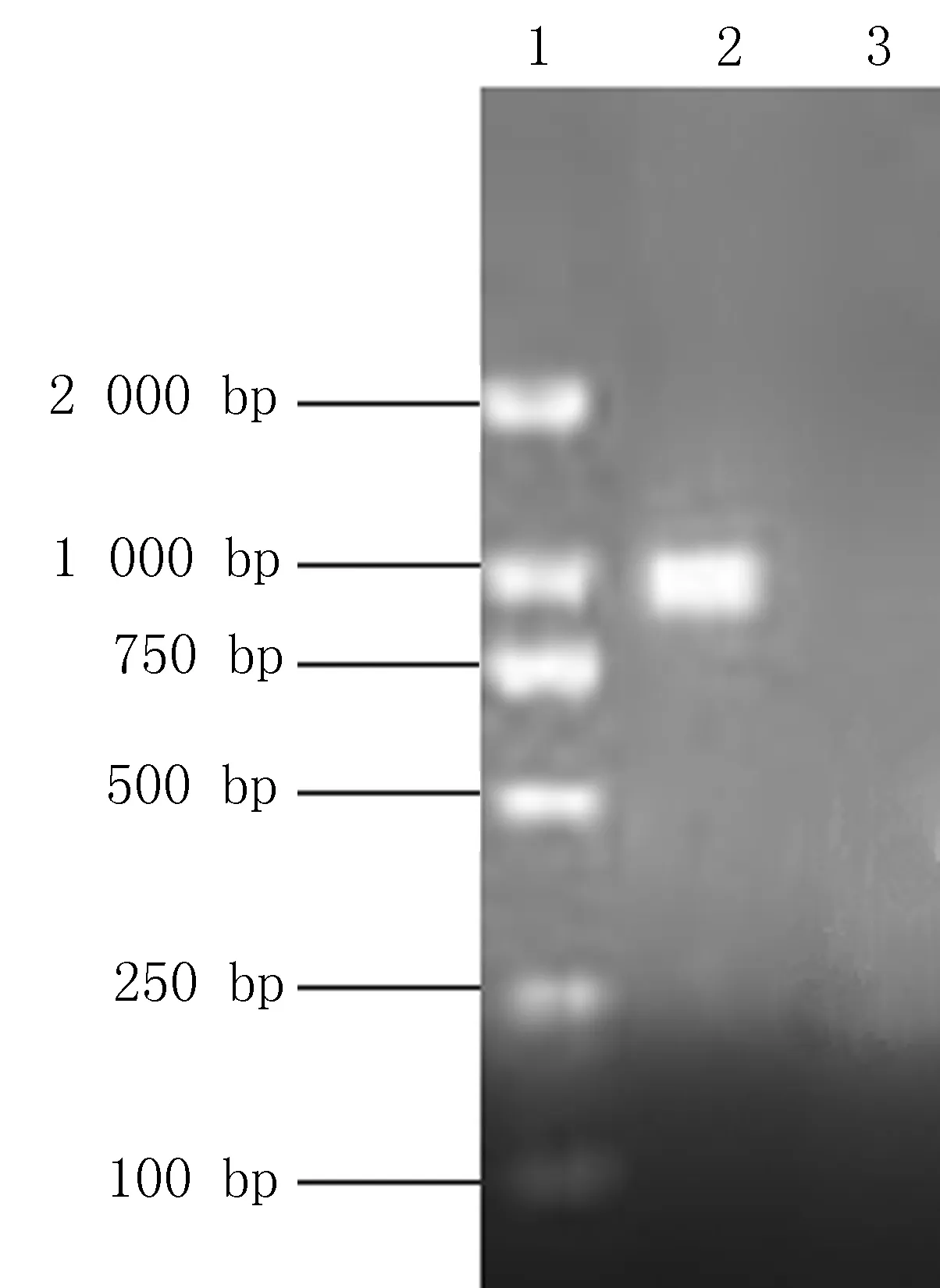
1: Marker; 2: YopD; 3: Blank图1 目的基因的PCR扩增结果
2.2重组质粒的酶切鉴定结果重组质粒的酶切鉴定结果显示,重组质粒的双酶切切出了2个片段,其中较大片段为载体片段,较小片段即目的基因片段,通过分子量比对,切出的目的片段大小与实际基因的大小一致,说明重组质粒构建成功(图2)。
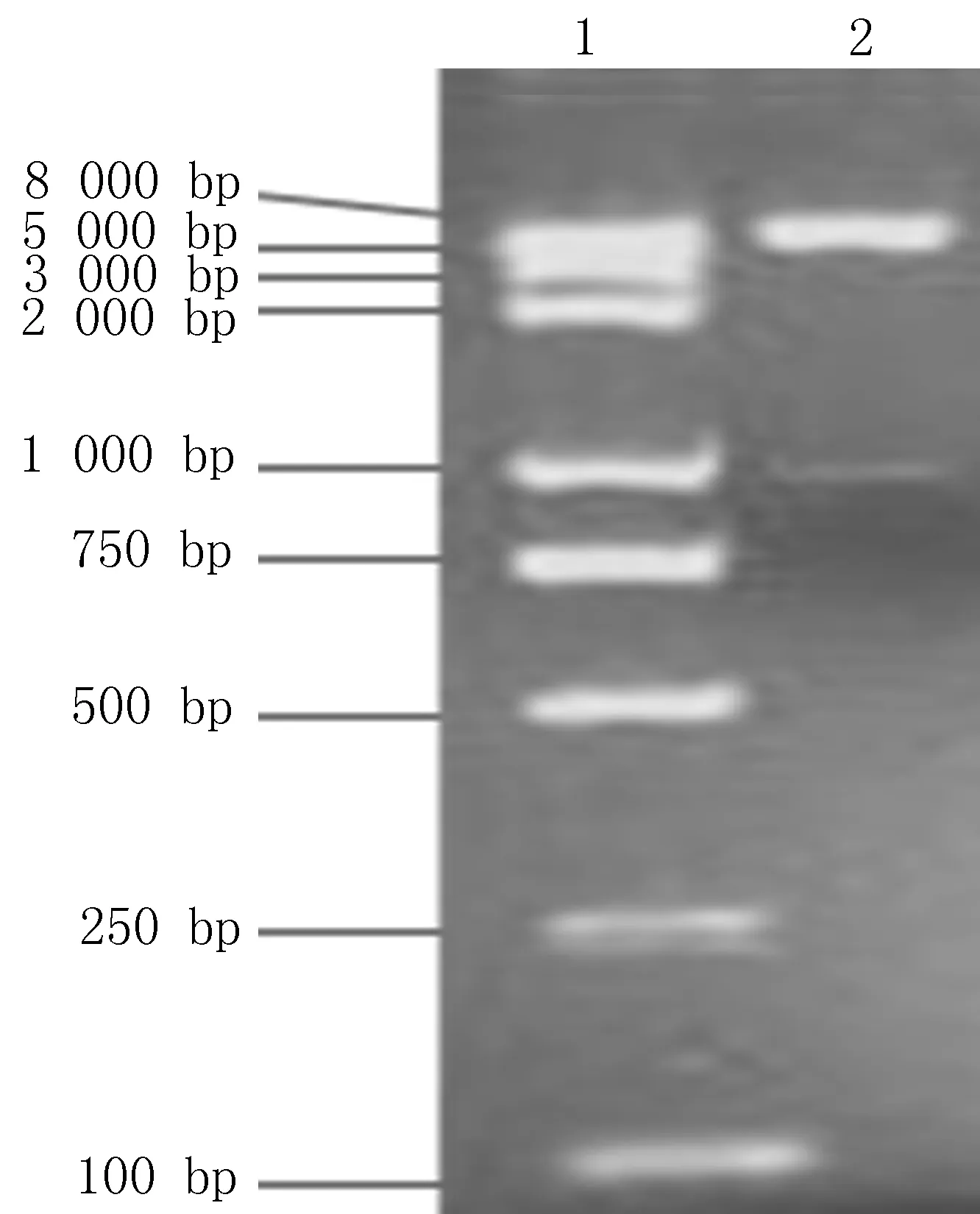
1: Marker; 2: YopD+pET-32a(+)图2 重组质粒的酶切鉴定图
2.3重组质粒的序列分析鉴定采用T7通用引物进行测序,由北京生工生物工程技术服务有限公司完成,以pET-YopD为例,测序结果如图3所示。
2.4重组鼠疫相关蛋白诱导表达结果重组蛋白诱导表达结果显示,重组鼠疫相关蛋白有较好的表达,与rYopD的理论分子量52.8 ku一致(图4)。
图3 重组质粒的测序结果图
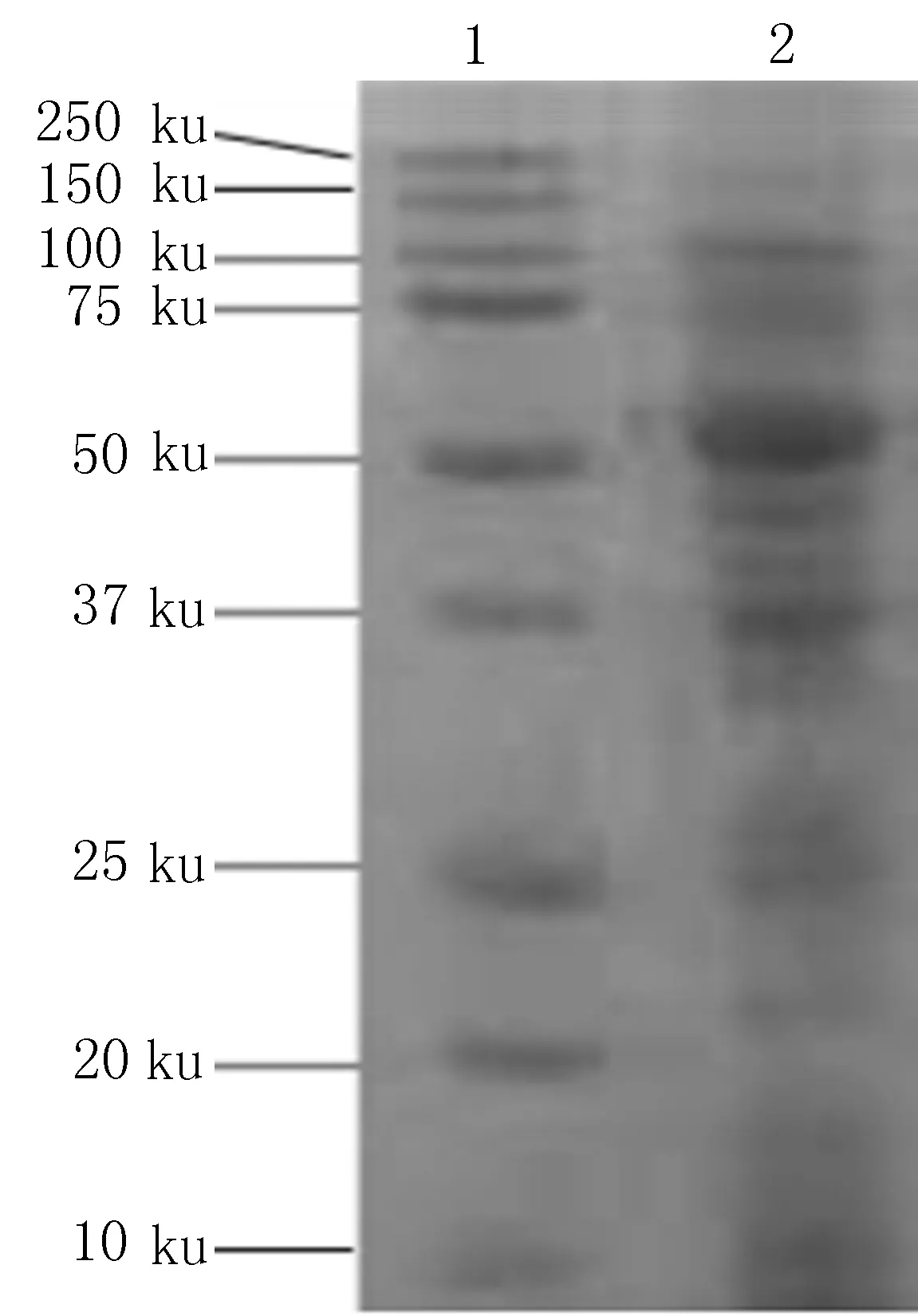
1: Marker; 2: rYopD图4 重组鼠疫相关蛋白诱导表达结果
3 讨论
鼠疫诊断是鼠疫预防控制中的重要内容和关键环节,是发现鼠疫、证实鼠疫的重要手段,是治疗鼠疫及防控鼠疫的主要依据。鼠疫检测的准确性与及时性关系到鼠疫防治工作的总体水平与成效。对于鼠疫而言,任何的误诊与漏诊都可能带来严重的公共卫生事件。长期以来,我国鼠疫的免疫诊断是以天然F1为基础的,当然这些诊断方法在我国的鼠疫检测中发挥了重要作用,但由于提取高纯度的天然F1抗原比较困难,且在没有参比诊断方法的情况下,其可信度将会受到质疑,因此寻找鼠疫新的诊断靶点和发展新的诊断技术对于鼠疫这样一种甲类传染病是极为重要的。
现研究发现的鼠疫杆菌中主要抗原成分或毒力因子除 F1(荚膜抗原)外,还有 Lcr(低钙反应蛋白,包括LcrG、LcrV、LcrH等)、 Yops(耶尔森氏菌外膜蛋白)、 Pgm(色素沉着) 和Pst 1(鼠疫菌素)等,这些毒力因子的编码基因主要位于细菌质粒上[7-9]。
本研究通过查看文献及基因比对,选取了鼠疫重要功能蛋白——YopD,采用基因工程的技术手段进行克隆表达,其是由70 kb的毒力质粒(pCD1)编码的,是耶尔森氏菌属特异蛋白。本实验使用原核表达系统pET-32a(+)作为表达质粒的载体,经过反复摸索诱导条件,该载体可以使重组蛋白在基因工程菌中得到稳定高效的表达,为鼠疫潜在诊断靶点及新型疫苗的选择奠定了基础,这也将是今后研究工作的重点。
参考文献:
[1] 张春华,刘振才,闫卫东,等.世界鼠疫态势及流行特点[J].中国地方病防治杂 志,2001,16(5):280-282.
[2] 韩岳,王希良,董梅,等.鼠疫菌重组质粒pcDNATE/F1-V的构建及其免疫效果的研究[J].免疫学杂志,2005,21(3):208-211.
[3] Cornelis GR.Molecular and cell biology aspects of plague[J].Proc Natl Acad Sci USA,2000,97(16):8778.
[4] Galan JE,Collmer A.Type Ⅲ secretion mahines:baterial devices for protein delivery into host cells[J].Science,1999,284:1322.
[5] 江凌晓,杨瑞馥,俞守义.鼠疫疫苗的研究[J].中国地方病学杂志,2004,23(3):285-287.
[6] Li B,Guo Y,Guo Z,et al.Serologic survey of the sentinel animals for Plague surveillance and screening for complementary diagnostic markers to F1 antigen by protein microarray[J]. Am J Trop Med Hyg,2008,79:799-802.
[7] Protsenko OA, Anisimov PI, Mozharov OT, et al. Detection and characterization of Yersinia pestis plasmids determining pesticin I, Fraction I antigen, and “Mouse” toxin synthesis[J]. Genetika, 1983,19:1081-1090.
[8] Straley SC, Skrzypek E, Plano GV, et al . Yops of Yersinia spp. pathogenic for humans[J]. Infect Immun, 1993, 61:3105- 3110.
[9] Sodeinde OA, Goguen J. Genetic analysis of the 9.5-kilobase virulence plasmid of Yersinia pestis [J]. Infect Immun , 1988, 56:2743-2748.
