新疆汉族与维吾尔族人群CYP2C19 基因多态性分布调查
2014-07-13马依彤杨毅宁李晓梅李香梅巴音斯勒玛丁仰宏
余 铭, 谢 翔, 马依彤, 杨毅宁, 李晓梅, 李香梅, 巴·巴音斯勒玛, 丁仰宏
(新疆医科大学1第一附属医院心脏中心冠心病一科, 2第五附属医院心内科, 3第一附属医院药学部药研室, 乌鲁木齐 830054)
当前医学发展已步入P4医学时代,其主要特征包括参与(participatory)、预测(predictive)、预防(preventive)和个体化(personalized)[1]。 通过基因检测技术,从而实现个体化给药,提高药物对患者的有效性和减少药物不良反应的发生是今后医学发展重要方向之一。CYP2C19作为CYP450酶家族一员,参与氯吡格雷、奥美拉唑、美芬妥英等多种药物代谢。然而CYP2C19代谢表型具有基因多态性[2]。依据其代谢能力差异分为:含有纯合子(*1/*1)的野生型(CYP2C19*1)有效发挥CYP2C19正常代谢能力并定义为快代谢基因型(即:CYP2C19*1/*1)、含有杂合子(*1/*2, *1/*3)的野生型(CYP2C19*1)定义为中间代谢基因型(即:CYP2C19*1/*2 、CYP2C19*1/*3 )、携带2个突变等位基因 (*2 and/or *3) 降低CYP2C19代谢能力被定义为慢代谢基因型(即 CYP2C19*2/*2 、CYP2C19*2/*3、CYP2C19*3/*3)[3-5]。参与机体代谢的主要以快代谢基因型为主,CYP2C19基因突变在中国人群中多为含有CYP2C19*2、CYP2C19*3的基因型,鉴于CYP2C19基因重要性,国内外研究者已对该基因进行了多次研究,但国内主要是针对区域范围内的汉族人群的研究,而就新疆地区汉族与维吾尔族(维族)人群的该基因相关研究较少。因此,本研究以新疆医科大学第一附属医院门诊及住院患者为主要研究对象,采用DNA 微阵列芯片法,了解CYP2C19基因多态性在中国新疆的分布特点以及民族间分布差异。
1 对象与方法
1.1研究对象连续入选2010年8月-2013年4月中国西部地区新疆汉族人群386例和维吾尔族(维族)人群214例,采用基因芯片检测技术对600名无亲缘关系的新疆汉族与维族人群进行CYP2C19*1、*2、*3基因型的检测,所有参与者均常年居住在新疆维吾尔自治区,该研究严格按照赫尔辛基宣言进行,并经新疆医科大学伦理委员会批准,在纳入研究前所有参与者均签署知情同意书。
1.2方法
1.2.1 血生化指标检测 血总胆固醇(total cholesterol,TC)、高密度脂蛋白(high density lipoproteins,HDL)、低密度脂蛋白low density lipoproteins,LDL)、甘油三酯(triglyceride,TG)、血糖(GLU)、尿素氮(blood urea nitrogen,BUN)、血肌酐(creatinine,Cr)、纤维蛋白原(Fg)、血小板(PLT)等生化指标均由新疆医科大学第一附属医院检验中心统一测定。
1.2.2 CYP2C19 基因分型 由新疆医科大学第一附属医院药学部药研室专职工作人员统一测定。基因型的测定采用 CYP2C19 基因检测试剂盒(DNA 微阵列芯片法),具体步骤如下:(1)基因组DNA的提取与纯化。(2)提取并纯化的DNA用CYP2C19基因特异引物对1和引物对2进行PCR扩增。(3)扩增产物经全自动杂交仪杂交显色。所得芯片经生物芯片识读仪识读后用基因芯片图像分析软件进行图像扫描和数据分析,输出检测结果。
1.3统计学处理数据处理应用SPSS 19.0软件包完成,用Hardy-Weinberg平衡检验样本的群体代表性;用Q-Q图进行正态分布检验,连续变量的比较用t检验,计数资料采用χ2检验,检验水准α=0.05。
2 结果
2.1维族和汉族人群一般资料的比较维族和汉族在性别构成上差异无统计学意义(P>0.05);维族和汉族人群在吸烟史、饮酒史、高血压病史、糖尿病病史、收缩压、舒张压、脉搏、BUN、Cr、GLU、TC、TG、HDL、LDL和Fg在差异无统计学意义(P>0.05),汉族人群PLT低于维族人群(P<0.05),见表1。
2.2汉族和维族CYP2C19基因多态性分布频率及其差异比较3种代谢基因型在汉族人群分布频率分别为40.1%、44.8%、15.1%;维族人群分布频率分别为51.4%、42.1%、6.5%。在快代谢基因型人群中2个民族基因型分布差异有统计学意义(P=0.01);在慢代谢基因型人群中2个民族基因型分布差异有统计学意义(P<0.01)。新疆地区汉族和维吾尔族人群中CYP2C19基因型分布有显著民族差异,且快代谢基因型中维族明显高于汉族,慢代谢基因型中维族明显低于汉族,见表2。
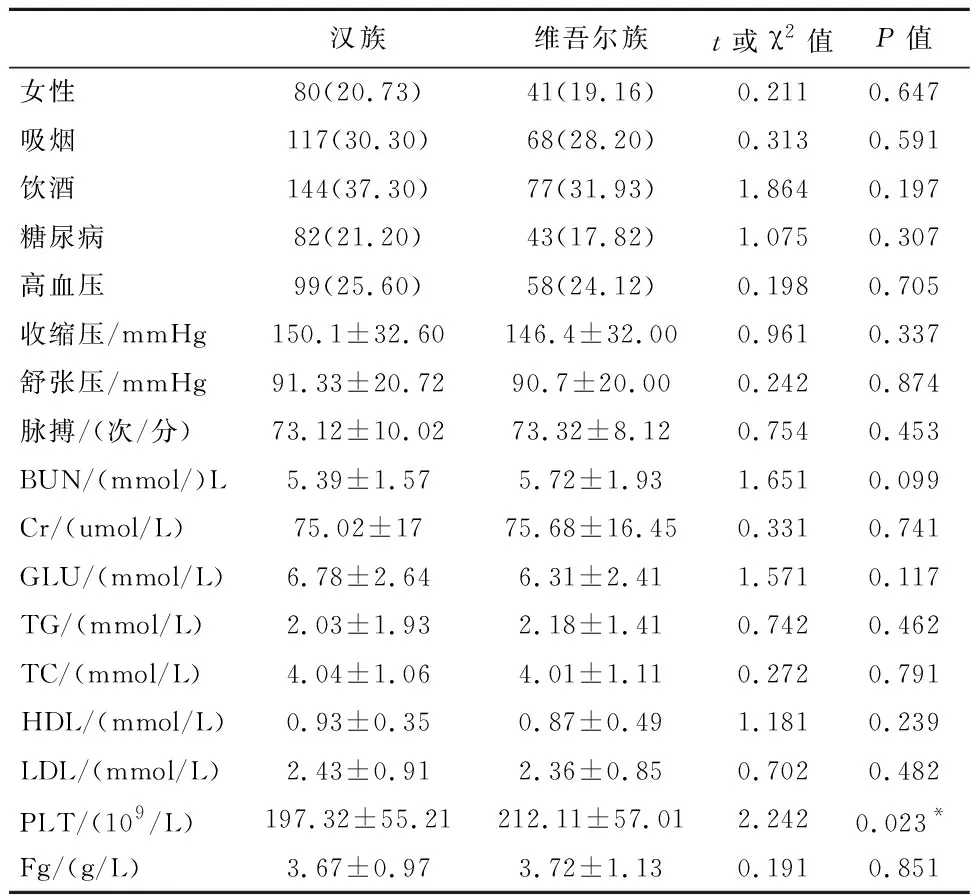
表1 汉族、维族人群一般资料比较/例(%)
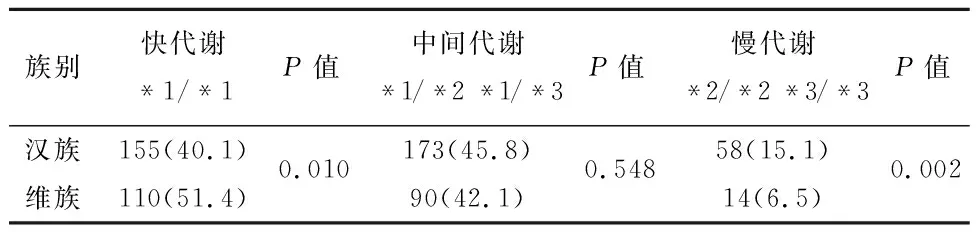
表2 汉族和维族人群CYP2C19基因多态性分布频率及其差异比较/例(%)
3 讨论
CYP2C19酶是Wrighton等[6]于1993年从人体肝脏中分离获得的一种可参与多种药物代谢的羟化酶。该酶参与多种药物代谢,主要有抗血小板聚集药、质子泵抑制剂、三环类抗抑郁药、抗癫痫药、抗精神病药、降糖药、抗疟疾药以及一些抗肿瘤药物等。该酶的编码基因位于人10号染色体q24.1-q24. 3区。CYP2C19具有基因多态性[2],其突变型均属于单个碱基突变,即单核苷酸多态性。Pare等[7]建议将未携带CYP2C19*2、CYP2C19*3和CYP2C19*17者(如*1/*1)划分为正常代谢型;携带1个CYP2C19*2或CYP2C19*3(如*1/*2或*1/*3)者为中间代谢型;同时携带2个CYP2C19*2和(或)CYP2C19*3(如*2/*2、*2/*3或*3/*3)者为弱代谢型;携带CYP2C19*17者为超代谢型(如*1/*17或*17/*17);其余 (如*2/*17、*3/*17)为未知型,并同时呼吁根据代谢分型指导氯吡格雷用药量。同时,国内外许多研究发现,CYP2C19酶代谢活性的高低随CYP2C19基因型而发生变化,按大体分主要有两类:一类是酶活性降低的突变,如CYP2C19*2、*3、*4、*5、*7、*8等[8-9],另一类是增强酶活性的突变,目前仅发现有 CYP2C19*17[9-10]。 近年来,CYP2C19 基因的多态性对氯吡格雷代谢的影响越来越受到重视,特别是 CYP2C19*2 和*3 基因型,这2个等位基因可解释在东方人中99%弱代谢表型[11-12],其中CYP2C19*2 基因型是 CYP2C19 基因的第 5 外显子在第 681位的碱基突变(681G/A,可造成外显子异常结合位点并产生出1个无功能的蛋白(CYP2C19*2酶)[9-12];CYP2C19*3 基因型是第 4 外显子在第636 位的碱基突变(636G>A)造成终止码提前,产生出代谢功能极低的 CYP2C19*3 酶[13-17]。在2010年3月美国食品药品监督管理局(FDA)发出警示,CYP2C19*2、*3 基因携带者不能有效或者降低将氯吡格雷转化为活性产物,要求在氯吡格雷说明书中附加最高警示级别的“黑色标签”,同时建议对要服用氯吡格雷的患者需先测定 CYP2C19 的基因型[18]。在临床上,氯吡格雷抗血小板聚集作用存在较大的个体差异。
本研究发现快代谢基因型在汉族人群分布频率为40.1%,而维族人群高达51.4%;慢代谢基因型在汉族人群分布频率为15.1%;维吾尔族人群分布频率为6.5%,差异均有统计学意义。其中维族分布频率与Wang等[19]的比例相近(快代谢为57%,慢代谢为8.1%)。据此推测,中国维吾尔族可能是由于参与者的遗传欧亚高加索人种的人群,即遗传漂移沿古丝绸之路移民引起;而新疆地区汉族主要来源于内地移民,其分布频率与福建地区汉族分布比例相近(福建汉族快代谢37.6%,慢代谢13.99%)[20]。因此本研究认为新疆地区汉族患者明显比维族患者更易受到CYP2C19基因多态性的影响,提示今后应更注重汉族人群PCI术后使用氯吡格雷的个体化治疗应用。本研究局限在于本院只针对入院病人检查CYP2C19基因多态性,存在选择性偏倚。其次本研究未检测CYP2C19*17,故无法了解并比较CYP2C19*17在新疆地区维族与汉族人群间的差异。本研究结果说明了我国各民族间基因多态性具有一定的可比性。因此研究新疆地区该基因多态性不仅可了解新疆地区CYP2C19各种基因型分布,同时也丰富了该基因在我国不同地区、不同种族人群中的分布情况,可为今后进一步的研究提供更详实帮助。而且还可为研制新药及临床合理用药、判定药物疗效、预测或减少药物不良反应等提供一定的理论和技术指导,从而缩小个体间药物疗效差异,提高药物有效使用率,避免或减低药物损害的发生,进而促进新疆地区冠心病患者支架术后个体化药物治疗的发展。
参考文献:
[1] Auffray C,Charron D,Hood L,et al.Predictive,preventive,personalized and participatory medicine:back to the future[J].Genome Med,2010, 2:57-59.
[2] Goldstein JA, Faletto MB, Romkes M, et al. Evidence that CYP2C19 is the major (S)-mephenytoin4′-hydroxylase in humans[J]. Biochemistry,1994,33(7):1743-1752.
[3] Mega JL, Close SL, Wiviott SD, et al. Cytochrome-P450 polymorphisms and response to clopidogrel[J]. N Engl J Med,2009, 360(3):354-362.
[4] Caraco Y, Close SL, Wiviott SD,et al. Genes and the response to drugs[J].N Engl J Med,2004,351:2867-2869.
[5] Shi WX, Chen SQ, Li Q, et al. Frequencies of poor metabolizers of Cytochrome-P4502C19 in esophagus cancer, stomach cancer, lung cancer and bladder cancer in Chinese population[J]. World J Gastroenterol,2004,10:1961-1963.
[6] Wrighton SA, Stevens JC, Becker GW, et al. Isolation and characterization of human liver cytochrome-P4502C19:correlation between CYP2C19 and S-mephenytoin 4′-hydroxylation. Arch Biochem[J]. Biophys, 1993, 306:240-245.
[7] Pare G, Mehta SR, Yusuf S, et al. Effects of CYP2C19 genotype on outcomes of clopidogrel treatment[J].N Engl J Med,2010,3(18):1704-1714.
[8] Pettersen AA, Arnesen H, Opstad TB, et al. The influence of CYP2C19*2 polymorphism on platelet function testing during single antiplatelet treatment with clopidogrel[J]. Thromb J, 2011, 8:94-98.
[9] Tantry US, Bliden KP, Wei C, et al. First analysis of the relation between CYP2C19 genotype and pharmacodynamics in patients treated with ticagrelor versus clopidogrel:The ONSET/OFFSET and RESPOND genotype studies[J]. Cardiovascular Genetics,2010, 3:556-566.
[10] Frere C, Cuisset T, Gaborit B, et al. The CYP2C19*17 allele is associated with better platelet response to clopidogrel in patients admitted for non-ST acute coronary syndrome[J]. Thromb Haemost, 2009,7:1409-1411.
[11] Hochholzer W, Trenk D, Bestehorn HP, et al.Impact of the degree of peri-interventional platelet inhibition after loading with clopidogrel on early clinical outcome of elective coronary stent placement[J]. J Am Coll Cardiol, 2009,48:1742-1750.
[12] Fontana P, Senouf D, Mach F,et al.Biological effect of increased maintenance dose of clopidogrel in cardiovascular outpatients and influence of the cytochromeP450 2C19*2 allele on clopidogrel responsiveness[J].Thromb Res,2008,121:463-468.
[13] Xiao ZS, Goldstein JA, Xie HG,et al.Differences in the incidence of the CYP2C19 polymorphism affecting the smephenytoin phenotype in Chinese han and bai populations and identification of a new rare CYP2C19 mutant allele[J].Pharmacol Exp Thera,1997,28:604-609.
[14] Brandt JT, Close SL, Iturria SJ, et al. Common Polymorphisms of CYP2C19 and CYP2C9 affect the pharmacokinetic and pharmacodynamic response to clopidogrel but not prasugrel [J]. Thromb Haemosta,2007,5:2429-2436.
[15] Frere C, Cuisset T, Morange PE, et al.Effect of cytochrome P450 Polymorphisms on platelet reactivity after treatment with clopidogrel in acute coronary syndrome[J].Am J Cardiol,2008,101:1088-1093.
[16] Simon T, Verstuyft C, Mary-Krause M,et al.Genetic determinants of response to clopidogrel and cardiovascular events[J].New Eng J Med,2009,3(6):363-375.
[17] Collet JP, Hulot JS, Pena A, et al. Cytochrome-P4502C19 polymorphism in young patients treated with clopidogrel after myocardial infarction:a cohort study[J].Lancet,2009,373:309-317.
[18] Administration FAD. FDA Drug Safety Communication:Reduced effectiveness of Plavix (clopidogrel) in patients who are poor metabolizers of the drug:U.S. Food and Drug Administration; 2010[cited 2011 Nov17]; [4 screen]. Available from:http://www.fda.gov/Drugs/DrugSafety/.
[19] Wang SM, Zhu AP, Li D, et al. Frequencies of genotypes and alleles of the functional SNPs in CYP2C19 and CYP2E1 in mainland Chinese Kazakh, Uygur and Han populations[J].Hum Genet,2009,54:372-375.
[20] 魏伟,方玲,王柠,等.福建汉族氯吡格雷药物代谢相关基因CYP2CI9的多态性分布研究[J]. 中华医学遗传学杂志, 2012, 29:420-425.
