OsPT8过量表达提高转基因烟草的耐低磷能力
2014-07-12贾宏昉张洪映尹贵宁黄化刚徐国华崔红
贾宏昉 张洪映 尹贵宁 黄化刚 徐国华 崔红
(1.河南农业大学烟草学院 国家烟草栽培生理生化基地,郑州 450002;2.贵州省烟草公司毕节市公司,毕节 551700;3.南京农业大学资环学院,南京 210095)
磷是重要的植物营养元素,但是其在土壤中的有效性却很低,因此土壤溶液中植物根系可吸收的有效磷浓度通常只有2-10 μmol/L,远远满足不了植物的生长需要[1,2]。磷在土壤中的低有效性也诱导了植物在长期进化过程中形成了一系列适应低磷胁迫的机制[3]:(1)根系扩大生长,根毛数量增加;(2)增强碳代谢和一些磷酸酶及有机酸的分泌以活化土壤中的难溶性磷;(3)一系列与磷缺乏相关的基因诱导表达(主要为磷转运蛋白);其中,与磷酸盐吸收直接相关的就是磷转运蛋白,依据Km值的不同,磷转运蛋白可以粗分为低亲和力(Low Affinity)和高亲和力(High Affinity)两大运输系统[4,5]。一般认为,高亲和磷转运蛋白(Pht1)家族是受磷营养缺乏而诱导的表达系统,Km值在微摩尔的范围内,这与土壤中的有效磷浓度相当[4,6],因此Pht1在植物吸收磷酸盐过程中起主要作用。
水稻中共有13个高亲和磷转运蛋白家族成员[7]。OsPT8基因编码的蛋白大小都约为58 kD,含有530个氨基酸残基,由12个疏水的跨膜(TM)螺旋组成,每个跨膜螺旋包含有17-25个氨基酸残基,在TM6和TM7有一个亲水大环(Hydrophilic loop)将12个跨膜域分隔成两组,即包括6个N端的跨膜区以及6个C端的跨膜区;蛋白的N端、C端及中间的亲水大环都分布在细胞质中,为典型的质膜转运蛋白拓扑结构[6,8]。前期的研究结果表明OsPT8虽然为组成型表达,但是仍受缺磷诱导表达增强,该基因在维持水稻体内磷素的动态平衡过程中起关键作用。在水稻中过量表达OsPT8基因造成水稻植株在正常供磷条件下叶片积累大量的磷,植株矮小,表现出“磷中毒”现象[8]。到目前为止关于OsPT8基因在双子叶植物上的功能还不清楚。因此,本试验将水稻高亲和磷转运蛋白基因OsPT8转入双子叶模式植物烟草中,研究OsPT8基因对烟草生长发育及耐低磷能力的影响,旨在从分子水平分析OsPT8基因在双子叶植物中的功能,为培养磷高效作物提供理论依据。
1 材料与方法
1.1 材料
1.1.1 受体材料 烟草云烟87种子由本实验室保藏。
1.1.2 基因、载体和菌株 水稻高亲和磷转运蛋白OsPT8基因、植物表达载体Psla-4、农杆菌感受态EHA105均由本实验室保存。
1.2 方法
1.2.1 烟草转化及分子检测[9]构建好的表达载体Ubi-Ps1a-4∷OsPT8通过电击法转化农杆菌EHA105感受态细胞。将鉴定为阳性的农杆菌侵染无菌的烟草叶片,侵染过的叶片置于培养基(MS+0.2 mg/L NAA+2 mg/L 6-BA)上进行共培养,3 d后将其转移到筛选培养基(MS+0.2 mg/L NAA+2 mg/L 6-BA+100 mg/L Kan+500 mg/L Carb)中进行培养,光照周期为16 h光照/8 h黑暗,2-3周后将抗性芽切下并转入生根培养基(MS+100 mg/L Kan+500 mg/L Carb)中诱导生根,最终获得转基因烟草。PCR鉴定转化苗,所用鉴定引物为水稻OsPT8基因特异引物,引物序列见表1。

表1 相关磷转运蛋白基因RT-PCR和Q-PCR引物序列
1.2.2 转基因材料的处理方法 沙培试验于2012年在河南农业大学科教园区进行,人工气候室内生长,基本条件:光强300 μmol/m2·s,光周期16 h;温度25℃。烟草从种子消毒后在无菌水中黑暗催芽,露白后供给1/4营养液至四片真叶完全展开,然后进行营养处理。营养液的配方及浓度为[9]:2 mmol/L KNO3,1 mmol/L NH4NO3,1 mmol/L NaH2PO4,0.5 mmol/L Ca(NO3)2,0.25 mmol/L CaCl2,0.5 mmol/L MgSO4,20 μmol/L Fe-EDTA,9 μmol/L MnCl2,46 μmol/L H3BO3,8 μmol/L ZnSO4,3 μmol/L CuSO4,0.03 μmol/L(NH4)2MoO4,pH调至5.5左右。设置两个磷水平(1 mmol/L和0.1 mmol/L),以磷酸二氢钾为磷源,缺磷处理的营养液中要用等量的KCl补足K+的含量。2 d换一次营养液,每天调节pH为6.0。处理时间为3周。
1.2.3 生物量统计 常规方法,10个重复。
1.2.4 全磷含量和有效磷含量测定[8,10]采用钼蓝比色法。
1.2.5 基因表达分析[8,9]采用Trizol法提取烟草总RNA,样品通过随机引物法反转录合成cDNA。根据GenBank发布的水稻高亲和磷转运蛋白基因(Os-PT8)和烟草高亲和磷酸盐转运蛋白基因(NtPT1和NtPT2)的序列设计各基因扩增引物,进行RT-PCR和Q-PCR。按照Invitrogen公司的RealMasterMix(SYBR Green)试剂盒说明书进行实时定量RT-PCR,每个样品3次重复。实时定量的试验数据采用2-ΔΔCt算法进行分析,假设目的基因在胁迫处理下的表达量是对照(正常培养)的N倍,N=2-ΔΔCt,ΔΔCt=Treat(Ct样品-CtL25)- CK(Ct样品-CtL25)。
1.2.6 数据处理 采用Sigmplot10.0和SPSS 12.0进行数据处理和统计分析。
2 结果
2.1 OsPT8转基因烟草的获得及基因表达鉴定
将水稻中高亲和磷转运蛋白基因OsPT8插入到双元表达载体Ubi-Ps1a-4,获得Ubi -Ps1a-4∷OsPT8表达载体,利用农杆菌介导法转入烟草中。用OsPT8基因中特异的片段序列设计引物对转基因烟株阳性苗进行检测(数据未显示),最后共得到OsPT8-Oe转基因烟草阳性系株系15个,并获得T0代种子。继续对T1代转基因株系进行检测,最终选取其中两个株系OsPT8-Oe1和OsPT8-Oe2(以下简称Oe1和Oe2)进行后续的生理试验。对所选取两个转基因株系的OsPT8基因进行表达检测,RT-PCR结果(图1-A)显示,OsPT8基因在两个转基因株系根部强烈表达,而野生型烟草中并未发现OsPT8基因的表达;为了确定检测结果的准确性,同时采用Real-Time PCR(Q-PCR)的方法检测了转基因株系和野生型根部的OsPT8基因表达水平,结果(图1-B)显示,野生型烟草根部几乎检测不到OsPT8基因的表达,而转基因株系中OsPT8基因却强烈表达,两个转基因株系中该基因的表达量差异不显著,这与RT-PCR结果一致。表明OsPT8基因已经整合到烟草基因组中并在转录水平上表达。
2.2 过量表达OsPT8对烟草幼苗生物量的影响

图1 OsPT8过量表达株系的获得及检测
为了分析高亲和磷转运蛋白OsPT8基因对烟草生长发育的影响,对正常供磷(1 mmol/L Pi)和低磷(0.1 mmol/L Pi)处理3周的烟株进行生物量统计。结果(图2)显示,在正常供磷条件下,两个转基因株系Oe1和Oe2的地下部生物量极显著高于野生型,分别比野生型提高了39.13%和41.15%;地上部生物量相差不大,仅略高于野生型,差异不显著(图2-A);两个转基因株系显著增加了烟株的根冠比,分别比野生型提高了31.4%和32.6%(图2-C),表明在正常供磷条件下过量表达OsPT8仅显著增加了地下部的生物量,而对地上部生物量影响不显著。低磷条件下转基因烟株的地上部和地下部生物量均显著高于野生型,达到了极显著水平,其中两个转基因株系地下部和地上部与野生型相比分别提高了30.12%-31.55%和11.26%-12.11%(图2-B);由于两个转基因株系地上部和地下部生物量均显著增加,因此转基因株系根冠比略高于野生型(图2-D)。这表明在低磷条件下过量表达OsPT8不仅显著增加了转基因烟草地下部的生物量,而对地上部的生物量也影响显著。
2.3 过量表达OsPT8对烟草全磷和有效磷含量的影响
为了分析高亲和磷转运蛋白OsPT8基因对烟草植株中全磷和有效磷积累的影响,对正常供磷(1 mmol/L Pi)和低磷(0.1 mmol/L Pi)处理3周的烟株进行取样,测定不同部位的全磷和有效磷含量。对全磷含量的分析发现,在正常供磷条件下,转基因株系地上部和地下部全磷含量均极显著高于野生型,其中地上部达到了野生型的1.61和1.69倍,而地下部也均比野生型提高了40%左右,两个转基因株系地上部全磷含量增加量均显著高于地下部(图3-A);在低磷条件下,转基因株系地上部和地下部全磷含量均显著高于野生型(图3-B),地上部和地下部均比野生型提高50%左右,两个转基因株系地上部和地下部全磷含量增加量差异不显著。对有效磷含量的分析发现,在正常供磷和低磷条件下,转基因株系地上部和地下部有效磷含量也均显著高于野生型(图3-C,3-D),两个转基因株系有效磷含量达到了野生型的2倍左右。转基因株系和野生型植株全磷含量和有效磷含量分析结果基本一致,说明转基因株系提高了烟株的有效磷利用,增强了烟草的耐低磷能力。
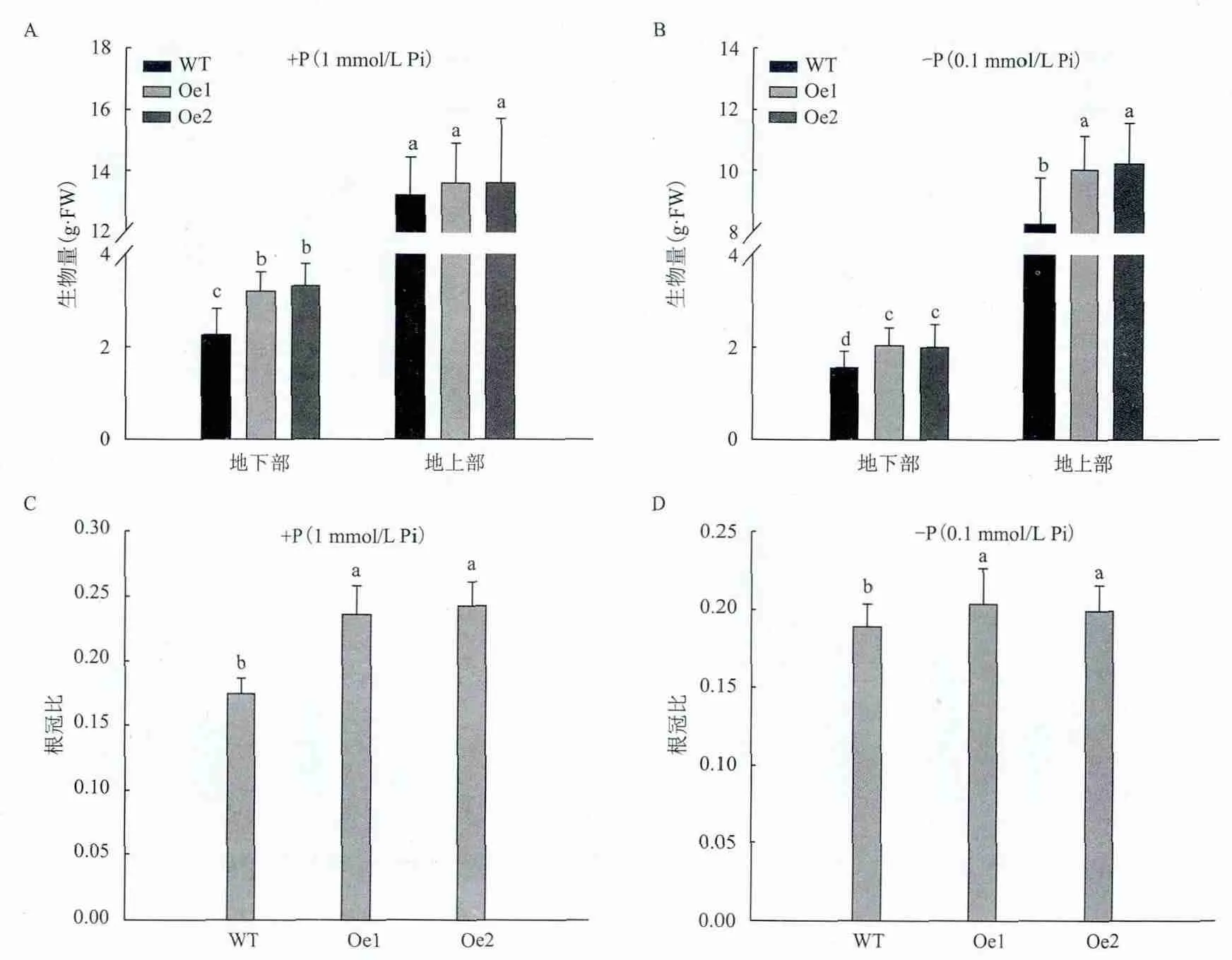
图2 正常供磷(+P)和低磷(-P)条件下转基因和野生型烟草生物量分析
2.4 过量表达OsPT8对烟草高亲和磷转运蛋白基因(Pht1)表达的影响
植物在磷营养胁迫时,高亲和磷转运蛋白会受缺磷诱导强烈表达,提高植物的磷吸收能力,以达到磷营养的最大程度优化利用。目前,在烟草中共克隆出5个高亲和磷转运蛋白基因(Pht1;1-Pht1;5,以下简称NtPT1-NtPT5),其中NtPT1和NtPT2受缺磷诱导表达量显著增强;我们分析了转基因株系和野生型烟草这两个基因的表达情况,结果(图4)显示,缺磷显著上调了烟草高亲和磷转运蛋白(NtPT1和NtPT2)基因的表达,尤其是在根部。我们同时检测了两个转基因株系Oe1和Oe2在正常供磷和低磷条件下根部NtPT1和NtPT2基因的表达情况。结果显示,在正常供磷条件下烟株过量表达OsPT8基因可诱导NtPT1和NtPT2基因的表达。分析NtPT1基因的表达(图4-A)发现,正常供磷条件下Oe1和Oe2转基因株系NtPT1表达量分别是野生型的1.82倍和3.26倍,而低磷条件下转基因株系表达量虽然显著高于野生型,但是该基因增加量却远低于正常供磷的增加量。分析NtPT2基因的表达(图4-B)发现,在正常供磷条件下未在野生型根系中检测到该基因表达,而两个转基因株系中该基因强烈表达;在低磷条件下NtPT2基因表达量仍显著高于野生型,均达到了野生型的2倍以上。基因表达分析表明,在烟草中过量表达OsPT8基因能改变烟草植株内高亲和磷转运蛋白家族成员的表达模式,可能与磷转运蛋白家族成员之间的协同作用有关。

图3 正常供磷(+P)和低磷(-P)条件下转基因株系与野生型全磷和有效磷含量分析

图4 正常供磷(+P)和低磷(-P)条件下转基因株系和野生型根部高亲和磷转运蛋白的表达分析
3 讨论
植物的生长离不开磷肥,在农业生产肥料投入上亩施磷肥居高不下,植物对磷肥的吸收主要取决于植物根系,发掘植物中磷高效吸收的遗传潜力是植物生物学家面临的巨大任务[11]。鉴于此,本研究从水稻高亲和磷转运蛋白OsPT8功能出发,探索该基因在双子叶模式植物模式烟草中耐低磷能力,对于丰富植物磷营养高效的分子机制,解决生产中大量磷肥浪费等现实问题具有重要意义。本研究表明OsPT8转基因烟草在低磷胁迫下地上部和根系生物量显著高于野生型,全磷含量和有效磷含量均比野生型提高50%以上,OsPT8基因过量表达提高了烟草的耐低磷能力。
植物体内磷缺乏时,蛋白质的合成受到阻碍,形成新的细胞质和细胞核较少,影响细胞正常分裂,导致生长比较缓慢,所以在形态结构表现出植株矮化,叶片变小,叶色暗绿或灰绿色,缺少光泽,分枝减少[12,13]。植物体内可以直接利用的磷素为有效磷[14,15],植物缺磷时,首先表现在植株各个部位有效磷含量显著改变,本研究结果表明在烟草中过量表达OsPT8基因显著提高了烟草有效磷的含量。在正常供磷条件下,烟株长势良好,磷酸盐利用率较高,这与水稻中的结果不尽一致。在水稻中该基因过量表达虽然增加了磷酸盐的利用率,但是造成了“磷中毒”现象,影响了水稻植株的正常发育,而在烟草中并未发现这种现象,这可能是因为在水稻中OsPT8还参与磷信号与激素信号的互作,这还需要进一步的研究来证实。
植物Pht1家族基因同源性很高,所以各成员之间在功能上可能存在相互协作[8,16]。OsPT8作为水稻中一个关键的磷转运蛋白,负责调控水稻体内磷素的动态平衡,影响水稻成熟期磷酸盐从营养器官到生殖器官的转运;在水稻中过量表达OsPT8基因同时可以引起其它Pht1家族成员的表达改变[8]。我们在烟草中的研究发现,在烟株中表达外源磷转运蛋白基因OsPT8增强了烟草自身高亲和磷转运蛋白(NtPT1和NtPT2)基因的表达,这与在水稻中得到的基因协作结果相一致[8],证明了磷酸盐转运蛋白之间存在协作。
4 结论
本试验在烟草中验证了OsPT8基因的功能,证明了该基因对于提高作物的磷酸盐利用率具有重要作用,在烟草中过量表达该基因提高了烟草的耐低磷能力,为植物基因工程培养磷高效作物提供了理论依据。
[1] Raghothama KG. Phosphate acquisition [J] . Annu Rev Plant Physiol, Plant Mol Bio, 1999, 50:665-693.
[2] Vance CP, Uhde-Stone C, Allan DL. Phosphorus acquisition and use:critical adaptations by plants for securing a nonrenewable resource [J] . New Phytol,2003, 157(3):423-447.
[3] Abel S, Ticconi CA, Delatorre CA. Phosphate sensing in higher plants [J] . Physiologia Plantarum, 2002, 115(1):1-8.
[4] Mimura T. Regulation of phosphate transport and homeostasis in the plant cells [J] . Inter Rev Cytol, 1995, 191:149-200.
[5] Raghothama KG, Katthikeyan AS. Phosphate acquisition [J] . Plant Soil, 2005, 274:37-49.
[6] 杨存义, 刘灵, 沈宏, 等.植物Pht1家族磷转运子的分子生物学研究进展[J] .分子植物育种, 2006, 4(2):153-159.
[7] Paszkowski U, Kroken S, Roux C, et al. Rice phosphate transporters include an evolutionarily divergent gene specifically activated inArbuscular mycorrhizalsymbiosis [J] . Proc Natl Acad Sci USA,2002, 99(2):13324-13329.
[8] Jia HF, Ren HY, Gu M, et al. Phosphate transporter gene, OsPht1;8,is involved in phosphate homeostasis in rice [J] . Plant Physiology,2011, 156(3):1164-1175.
[9] Chen AQ, Hu J, Sun SB, et al. Conservation and divergence of both phosphate- and mycorrhiza-regulated physiological responses and expression patterns of phosphate transporters inSolanaceousspecies[J] . New Phytol, 2007, 173(4):817-831.
[10] Zhou J, Jiao F, Wu Z, et al. OsPHR2 is involved in phosphatestarvation signaling and excessive phosphate accumulation in shoots of plants [J] . Plant Physiol, 2008, 146(4):1673-1686.
[11] 张福锁, 李春俭, 米国华. 21世纪的生命科学展望[M] //洪德元. 植物营养生理进展. 济南:山东教育出版社, 2003:206-235.
[12] Marschner H. Mineral nutrition of higher plants [M] . 2nd ed.Academic Press, 1995.
[13] Mengel K, Kirkby EA. Principles of plant nutrition [M] . Dordrecht,the Netherlands:Kluwer Academic Publishers, 2001.
[14] Hammond JP, Bennett MJ, Bowen HC. Change in gene expression inArabidopsisshoots during phosphate starvation and the potential for developing smart plants [J] . Plant Physiology, 2003, 132(2):578-596.
[15] Karandashov V, Bucher M. Symbiotic phosphate transport inArbuscular mycorrhizas[J] . Trends in Plant Sci, 2005(1):22-29.
[16] Wang C, Ying S, Huang H, et al. Involvement of OsSPX1 in phosphate homeostasis in rice [J] . Plant J, 2009(5):895-904.
