烟草C3HC4型锌指蛋白的原核表达及转基因植株功能研究
2014-07-12伍文宪杨秀芬刘勇邱德文
伍文宪 杨秀芬 刘勇 邱德文
(1. 中国农业科学院植物保护研究所,北京 100081;2. 四川省农业科学院植物保护研究所,成都 610066)
锌指蛋白是真核生物基因组中最丰富的一类转录因子,最初于1983年被发现存在于非洲爪蟾卵母细胞的转录因子TFIIIA中[1],锌指结构由多个半胱氨酸或(和)组氨酸组成,通过锌离子来维持结构的稳定性。锌指蛋白通过与目的基因的DNA或RNA结合,或与其他蛋白之间的相互作用来调控基因表达。根据半胱氨酸(C)和组氨酸(H)残基数及在蛋白中的位置,可将含锌指结构域的转录因子分为C2H2、C2C2、C3H、C3HC4(Zinc finger)和C3HC5(LIM finger)5个亚类[2],C3HC4锌指蛋白具有较为简单的蛋白质结构[3],由能结合两个离子的4对双配体构成,不仅能结合DNA,还能与RNA,蛋白质和脂质结合[4]。C3HC4锌指蛋白参与基因转录与重组,细胞间信号转导等各种生命过程,也能在蛋白间互作以及泛素化进程中发挥重要作用,许多C3HC4锌指蛋白本身就是E3泛素化连接酶,介导泛素化目标蛋白的转移[5]。
植物C3HC4型锌指蛋白基因的研究多集中在拟南芥与水稻[6]。为人们所熟知的拟南芥C3HC4型锌指蛋白有AtCOP1(参与光反应)、AtCIP8(参与光形态建成)[7]、AtTED3(参与光信号传导)[8]、AtRMA1(参与分泌途径)[9]、AtXB3(参与根的发育)[10]、AtSDIR1(抗逆反应)[11]等。在水稻中,研究比较深入的C3HC4型锌指蛋白大多与光形态建成有关,主要包括OsCOP1、OsCOIN1、OsXB3.1和OsRHC1[7]。目前,尚无对烟草中C3HC4型锌指蛋白的研究报道,本研究以诱导植物抗性的蛋白激发子Hrip1为诱饵蛋白,从烟草cDNA文库中首次获得本生烟C3HC4型锌指蛋白基因NbZFP1,建立该蛋白大肠杆菌体外重组表达系统,获得转基因烟草植株并分析转化株的表型特征和抗病功能,以期为进一步研究烟草C3HC4型RING锌指蛋白在生长发育以及蛋白激发子诱导植物抗性分子机制中的功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 本生烟种子由本实验室保藏。
1.1.2 载体和菌株 原核表达载体pGEX-6P-2与pMAL-C2X、植物表达载体pBI121、农杆菌菌株GV3101均由本实验室保存,TMV-GFP病毒由清华大学生命科学学院刘玉乐教授提供,大肠杆菌感受态BL21购自北京全式金公司。
1.1.3 仪器与试剂 蛋白纯化仪AKTA explorer 900(Amersham公司);地高辛分子检测试剂盒(Roche公司);植物组织RNA提取试剂盒(北京全式金公司);mRNA反转录试剂盒(北京全式金公司);各化学试剂均购自AMRESCO公司。
1.2 方法
1.2.1 总RNA提取及cDNA第一链的合成 采用植物组织RNA提取试剂提取本生烟总RNA,取2 μg mRNA用于cDNA第一链的合成(具体方法参见北京全式金公司反转录试剂盒说明书)。
1.2.2NbZFP1的克隆与序列测定 以从烟草cDNA文库中获得的一段约200 bp的序列为信息探针,搜索本生烟SGN mRNA序列库,同源比较,设计一对特异性PCR引物:F-NbZFP1:5'-CG GGATCCATGTCACTTTCTGGTCGT-3',R-NbZFP1:5'-GCGTCGACTCAGGTTTTCAGCCCTGT-3'(引物由北京华大公司合成)。PCR程序扩增目的基因:94℃预变性2 min;94℃变性30 s,55℃复性30 s,72℃延伸1 min,30个循环;最后72℃延伸10 min。目的条带经胶回收纯化后连接到pEASY-Blunt-Zero载体中,转化至大肠杆菌感受态细胞Trans5α,测序由北京华大公司完成。
1.2.3NbZFP1原核表达重组质粒的构建 质粒提取、双酶切、连接及转化等参照试剂说明书和相关的分子生物方法[12],简要操作步骤如下:提取原核表达载体pGEX-6P-2、pMAL-C2X以及测序正确的pEASY-Blunt-Zero-NbZFP1转化子质粒,用限制性内切酶BamH I和SalI双酶切并回收载体片段及目的基因片段NbZFP1,22℃连接15 min后转化至表达宿主菌E. coliBL21(DE3)中,过夜培养,待长出单菌落,挑取单菌落为模板进行菌落PCR,筛选出阳性转化子后送测序,将验证无误的转化子分别命名为pGEX-6P-2-NbZFP1和pMAL-C2X-NbZFP1。
1.2.4NbZFP1蛋白的诱导表达和检测 挑取pGEX-6P-2-NbZFP1、pMAL-C2X-NbZFP1、pGEX-6P-2空载体和pMAL-C2X空载体单菌落,分别接种于50 mL含Amp(终浓度为100 μg/mL)的液体LB培养基中,37℃ 220 r/min振荡培养6-7 h,按1∶100 的比例稀释到1 L含Amp(100 μg/mL)新鲜液体LB培养基中,37℃ 220 r/min振荡培养4 h,温度调至16℃,转速调至200 r/min,待温度降至16℃后,加入终浓度为0.1 mmol/L IPTG诱导培养过夜,次日将菌液分别转入离心桶中,4℃,5 000 r/min 离心15 min,弃上清,向沉淀中加入40-50 mL pH8.0的Tris缓冲液重悬,之后进行超声破碎处理,待超声波破碎完全,4℃,12 000 r/min离心50 min,取上清,用相应的预装亲和层析柱初步纯化,收集洗脱液以及穿透液,洗脱液经脱盐后,用蛋白纯化仪AKTA explorer 900离子交换层析,收集各个洗脱峰。各个样品通过变性聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析。SDSPAGE试剂的配制及方法参照文献[13] 。
1.2.5 目标基因转化烟草 利用Primer 5.0软件设计1对特异性引物5'-CGATGTCACTTTCTGGTCGT-3'(下划线为BamH I酶切位点)和5'-GCTCAGGTTTTCAGCCCTGT-3'(下划线为SalI酶切位点)扩增NbZFP1的开放阅读框,连接至pEASY-Blunt-Zero载体中,之后用BamH I和SalI双酶切,同时双酶切载体pBI121,然后用T4 DNA连接酶连接获得融合载体pBI121-NbZFP1,用农杆菌介导的叶盘浸染法[14]将融合载体pBI121-NbZFP1转化到野生型本生烟中,叶盘置于培养基(MS+0.1 mg/mL NAA+1 mg/mL BA+3%蔗糖+0.375% phytagel,pH5.7)2℃暗培养2 d,将叶盘转移至分化培养基(MS+0.1 mg/mL NAA+1 mg/mL BA+3%蔗糖+500 mg/mL头孢霉素+100 mg/mL卡那霉素+0.375%phytagel,pH5.7),光照培养一个月左右,保持28-30℃,每10 d更换一次分化培养基,待分化出小苗后,将苗转移至生根培养基(MS+0.1 mg/mL NAA+3%蔗糖+250 mg/mL头孢霉素+80 mg/mL卡那霉素+0.375% phytagel,pH5.7),最终获得转基因烟草。
1.2.6 转基因烟草的分子鉴定 用植物组织基因组DNA试剂盒(北京全式金公司)提取长势较好的T0代转基因烟草基因组DNA,以pBI121载体上一段1 000 bp左右特异性高的序列设计引物,PCR鉴定阳性植株。将阳性烟草植株做Southern杂交试验,Southern鉴定按试剂盒说明书进行。
1.2.7 株高及节间长的测定 温室培养T0代阳性转基因烟草,获得T1代种子,分别在温室中培养野生型本生烟与T1代转基因本生烟,待长至四叶期后每隔10 d测量株高及节间长。
1.2.8 转基因烟草抗病性测定 分别选取培养20 d左右的T1代转基因烟草和野生型烟草,在烟草中部叶片上用棉棒涂抹含TMV-GFP的PBS缓冲液,重复3次。3 d后在紫外灯下观察发病情况[15]。
2 结果
2.1 NbZFP1的克隆
利用设计的特异性PCR引物,从本生烟的cDNA中扩增了一条576 bp产物,命名为NbZFP1。同时将其克隆到平末端载体pEASY-Blunt-Zero中,转化大肠杆菌Trans5α,获得的转化子经菌落PCR及测序后,经序列比对与数据库中序列完全一致。
2.2 NbZFP1的原核表达质粒的构建
原核表达载体pGEX-6P-2在其多克隆位点上游有一个谷胱甘肽-s-转移酶编码序列,目的基因在不改变阅读框架的条件下插入多克隆位点(MCS),在转化大肠杆菌后经过异丙基硫代半乳糖苷(IPTG)的诱导及相应条件的优化,就可表达出与谷胱甘肽-s-转移酶融合的蛋白。将之前构建好的克隆子用BamH I和SalI双酶切并回收目的条带后,与同样使用BamH I和SalI双酶切过的表达载体pGEX-6P-2连接,转化大肠杆菌BL21,通过菌落PCR及测序验证阳性转化子。
原核表达载体pMAL-C2X在其多克隆位点上游有一个麦芽糖结合蛋白编码序列,设计引物时在反向引物添加6个组氨酸密码子,这样在诱导表达时C末端含6个His标签,可以用His亲和层析柱纯化。pMAL-C2X载体可以较高幅度的提高目标蛋白的可溶性。pMAL-C2X-NbZFP1的构建与pGEX-6P-2-NbZFP1一致。
2.3 NbZFP1的原核表达检测
将构建好的含有NbZFP1基因的原核表达载体pGEX-6P-2-NbZFP1、pMAL-C2X-NbZFP1和空白对照质粒pGEX-6P-2、pMAL-C2X分别转化大肠杆菌BL21(DE3),经IPTG诱导后,表达产物经亲和层析,离子交换层析纯化后,进行SDS-PAGE凝胶电泳分析,经考马斯亮蓝染色成像。由于所克隆的基因约为576 bp,所以编码蛋白分子量约为24 kD,表达载体pGEX-6P-2上的GST蛋白约26 kD,因此pGEX-6P-2-NbZFP1融合蛋白的分子量约为50 kD。而pMAL-C2X上的MBP标签蛋白约为45 kD,因此pMAL-C2X-NbZFP1融合蛋白的分子量为69 kD。SDS-PAGE结果(图1,图2)显示,在预计的大小处有明显的深染蛋白条带,而空载对照只分别在25 kD和45 kD有条带,说明已成功构建了pGEX-6P-2-NbZFP1以及pMAL-C2X-NbZFP1基因原核表达载体,并在大肠杆菌中成功表达。

图1 pGEX-6P-2-NbZFP1表达产物SDS-PAGE分析

图2 pMAL-C2X-NbZFP1表达产物SDS-PAGE分析
2.4 转NbZFP1基因的烟草植株获得
将携带NbZFP1基因的过表达载体pBI-121-NbZFP1通过电击法转化至农杆菌GV3101中,利用农杆菌介导的叶盘转化法,侵染本生烟叶片,再经共培养、分化培养后,将分化出的抗性苗剪下转移至生根培养基中,4周左右得到生根的抗性苗。
选取野生型本生烟植株和在抗性培养基上生根的转基因本生烟株系,用植物基因组DNA提取试剂盒提取烟草叶片基因组DNA。选取pBI121载体上特性较高的约1 000 bp的片段设计引物,结果(图3)显示,在18个烟草转化株系中,8个转化株系能稳定扩增出pBI121载体上一段1 000 bp左右特异性条带,与阳性对照大小一致,初步说明NbZFP1基因已成功转化烟草。
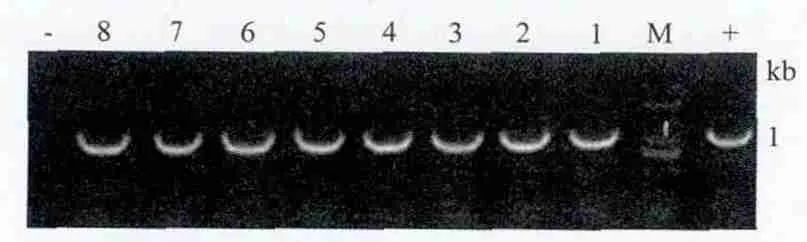
图3 T0代转基因烟草基因组DNA PCR扩增结果
随机挑选的3个PCR阳性的T0代植株用于Southern blot,均检测到目的基因的整合,一个株系为单拷贝,两个株系为多拷贝,而在非转基因对照中没有检测到杂交条带,说明NbZFP1已成功整合到烟草基因组(图4)。

图4 转基因植株的Southern杂交鉴定结果
2.5 NbZFP1对三生烟表型及抗病性的影响
将单拷贝的T1代转基因种子及野生型烟草种子分别培养于1/2MS培养基,生长1周左右,将幼苗移栽至土中,待四叶期后,每隔10 d分别测量野生型和转基因烟草株高及节间长,直至第60天。结果(图5-图7)显示,单拷贝T1代转基因烟草植株相对野生型有明显矮化,株型紧凑,节间缩短。利用TMV-GFP接种于烟草后,通过TMV-GFP荧光强度分析判断抗病能力的方法,将TMV-GFP分别接种于转基因和野生型烟草中部叶面大小一致的叶片上,重复3次。3 d后在紫外灯下观察,发现野生型烟草叶片上绿色荧光强度高于转基因植株(图8),说明单拷贝的转NbZFP1基因植株抗病性强于野生型植株。
3 讨论

图5 T1代单拷贝转基因烟草与野生型烟草平均节间长比较

图6 T1代单拷贝转基因烟草与野生型烟草不同时间株高比较

图7 T1代单拷贝转基因烟草与野生型烟草
锌指蛋白普遍存在于植物中,它们在调节植物生长发育及非生物应答等多种重要的生命过程中起着不可替代的作用。目前,在植物中对锌指蛋白家族的研究主要集中在C2H2型,对C3HC4型的研究比较少,尤其是对烟草C3HC4行锌指蛋白的研究未见报道。本实验室利用酵母双杂交技术筛选蛋白激发子Hrip1互作过程中,首次从烟草cDNA文库中筛选到了一个C3HC4型锌指蛋白,通过病毒介导的基因沉默(VIGS)技术发现该蛋白能影响烟草果实发育(另文发表)。本研究构建了本生烟NbZFP1基因的原核表达载体,获得了在大肠杆菌中大量表达不同标签的融合蛋白,同时利用亲和层析、离子交换层析以及分子筛技术分离纯化了不同NbZFP1融合蛋白,为进一步研究该蛋白影响烟草果实发育的作用机制奠定了基础,同时为今后利用不同技术研究蛋白互作,如GST-Pull down、免疫共沉淀、Biacore等提供了纯化的蛋白样品。

图8 TMV-GFP侵染野生型及转基因烟草后叶片情况
利用农杆菌介导的转基因方法将NbZFP1基因在烟草植株中过表达,结果发现单拷贝的T1代转基因烟草植株表现出株型紧凑、节间缩短。这个结果与其他植物中所报道的锌指蛋白功能上有相似之处,如矮牵牛中锌指蛋白EPF家族基因,以及拟南芥中锌指蛋白SUPERMAN、NNT 控制其生殖发育[16-18],水稻锌指蛋白基因PROG1在株型发育调控和驯化中起重要作用[19],水稻锌指蛋白基因OsZRL沉默后能对根系及植株的生长具有促进作用[20]。在前人研究报道的基础上,猜测NbZFP1可能是作为转录因子通过某种机制参与到生长素信号传导或生长素/细胞分裂素信号传导,从而影响烟草的生长发育,本研究得到的单拷贝转基因植株为下一步研究该蛋白的分子机制提供了试验材料。
在拟南芥中,含有类LSD1(组蛋白赖氨酸特异性脱甲基酶)锌指结构域的LSD1相关蛋白参与抗病反应和细胞程序性死亡,在水稻中,编码锌指蛋白的OsLOL2基因通过调节PR蛋白含量参与调控水稻的生长和抗病[21]。推测本试验转NbZFP1基因烟草可能也是通过上调PR基因达到抗病性增强目的。为此,作者将在下一步试验中验证NbZFP1基因是否参与相应PR基因的表达。
4 结论
本研究以蛋白激发子Hrip1为诱饵蛋白,从烟草cDNA文库中首次获得本生烟C3HC4型锌指蛋白,命名为NbZFP1。将该蛋白基因构建于原核表达载体pGEX-6P-2及pMAL-C2X上并分别转化至大肠杆菌中,经诱导表达得到大量可溶性重组蛋白,通过亲和层析技术、离子交换层析等纯化技术获得了纯度较高、性质稳定的GST-NbZFP1、MBP-NbZFP1蛋白。构建植物表达体系,将NbZFP1基因转化本生烟,经Southern blot检测获得了单拷贝转NbZFP1基因本生烟株系。与野生型烟草植株相比,T1代单拷贝转基因植株株型紧凑、节间缩短、茎干粗壮。同时,NbZFP1基因过表达可以显著提高植株对TMV的抗病性。
[1] Berg JM, Shi Y. The galvanization of biology:a growing appreciation for the roles of zinc [J] . Science, 1996, 271:1081-1085.
[2] 刘强, 张贵友.植物转录因子的结构与调控作用[J] .科学通报,2000, 45(14):1465-1474.
[3] Joazeiro CA, Weissman AM. RING finger proteins:mediators of ubiquitin ligase activity [J] . Cell, 2000, 102:549-552.
[4] Stone SL, Hauksdottir H, Troy A, et al. Functional analysis of the RING-type ubiquitin ligase family ofArabidopsis[J] . Plant Physiol,2005, 137:13-30.
[5] Ciechanover A. The ubiquitin-proteasome pathway:on protein death and cell life [J] . EMBO J, 1998, 17:7151-7160.
[6] Saad RB, Zouari N, Ramdhan WB, et al. Improved drought and salt stress tolerance in transgenic tobacco overexpressing a novel A20/AN1 zinc-finger “AlSAP” gene isolated from the halophyte grassAeluropus littoralis[J] . Plant Mol Biol, 2010, 72:171-190.
[7] Von Arnim AG, Deng XW. Ring finger motif ofArabidopsis thalianaCOP1 defines a new class of zinc-binding domain [J] . Biol Chem,1993, 268:19626-19631.
[8] Pepper AE, Chory J. Extragenic suppressors of theArabidopsisdet1 mutant identify elements of flowering-time and light-response regulatory pathways [J] . Genetics, 1997, 145:1125-1137.
[9] Matsuda N, Suzuki T, Tanaka K, Nakano A. Rma1, a novel type of RING finger protein conserved fromArabidopsisto human, is a membrane-bound ubiquitin ligase [J] . Cell Sci, 2001, 114:1949-1957.
[10] Wang YS, Pi LY, Chen XH, et al. Rice XA21 binding protein 3 is a ubiquitin ligase required for full Xa21-mediated disease resistance[J] . Plant Cell, 2006, 18:3635-3646.
[11] Zhang Y, Yang C, Li Y, et al. SDIR1 is a RING finger E3 ligase that positively regulates stress responsive abscisic acid signaling inArabidopsis[J] . Plant Cell, 2007, 19(6):1912-1929.
[12] 萨姆布鲁克丁, 弗里奇EF, 曼尼阿蒂斯T.分子克隆实验指南[M] .第2版.北京:科学出版社, 1989:34-74.
[13] 汪家政, 范明.蛋白质技术手册[M] .北京:科学出版社,2001.
[14] Anoop N, Gupta AK. Transgenic indica rice cvIR-50 overexpressingVigna aconitifoliadelta-1-pyrroline-5-carboxylae synthetase cDAN shows tolerance to high salt [J] . Plant Biochem Biotechnol, 2003,12:109-116.
[15] Liu Y, Schiff M, Marathe R, Dinesh-Kumar SP. Tobacco Rar1,EDS1 and NPR1/NIM1 like genes are required for N-mediated resistance to tobacco mosaic virus [J] . The Plant Journal, 2002,30(4):415-429.
[16] Kobayashi A, Sakamoto A, Kubo K, et al. Seven zinc-finger transcription factors are expressed sequentially during the development of anthers in petunia [J] . Plant J, 1998, 13(4):571-576.
[17] Sakai H, Medrano LJ, Meyerowitz EM. Role of SUPERMAN in maintainingArabidopsisfloral whorl boundaries [J] . Nature,1995, 378:199-203.
[18] Crawford BCW, Ditta G, Yanofsky MF. The NTT gene is required for transmitting-tract development in carpels ofArabidopsis thaliana[J] . Curr Biol, 2007, 17(13):1101-1108.
[19] Jin J, Huang W, Gao JP, et al. Genetic control of rice plant architecture under domestication [J] . Nat Genet, 2008, 40:1365-1369.
[20] 玉晓红, 晁丽, 陈昌冬, 等.利用RNA干涉研究水稻锌指蛋白基因OsZRL的功能[J] .中国水稻科学, 2013, 27(1):8-16.
[21] Bhatti KH, Xu C, Wu J, He C, et al. Over-expression of rice OsLOL2 gene confers disease resistance in tobacco toPseudomonassyringaepv. tabaci[J] . Progress in Natural Science, 2008, 18:807-812.
