一种引起脊尾白虾红体病病原菌的初步研究
2014-07-12张文文王庚申谢建军许文军
张文文,王庚申,施 慧,谢建军,许文军
(1.浙江海洋学院海洋与渔业研究所,浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山 316100;2.浙江海洋学院水产学院,浙江舟山 316022)
脊尾白虾Exopalaemon carinicauda又名白虾,其肉质细嫩,味道鲜美,营养丰富,深受群众喜爱。同时由于其具有生长快、繁殖力强,繁殖周期短,适应性广,食性杂,经济价值高等特点,已成为浙江省重要的海水围塘养殖混养品种。但随着脊尾白虾养殖面积的增加,病害也越来越多,给养民造成的损失也越来越严重[1]。
2012年7月,浙江省普陀区浙江省海洋水产研究所西闪试验场暂养脊尾白虾种虾爆发红体病,病虾缓游于水面或静伏于池边,该病传播快,死亡率高,一周内发病死亡率达到30%左右(最高日死亡率达0.5%)。试验材料为濒死红体病脊尾白虾,通过病原分离、人工感染试验、病原菌形态、生理生化特征、16S rDNA和热激蛋白HSP60基因序列同源性分析以及药物敏感性试验等方法,对此次引起脊尾白虾红体病的病原进行初步研究,以期为该病的有效防治提供理论依据。现将研究结果报道如下。
1 试验材料与方法
1.1 试验材料来源
病虾样品于2012年7月取自浙江舟山普陀区西闪试验场的发病池塘,均为表现典型患病症状的濒死个体,体重 0.51±0.02 g。
营养琼脂、TCBS培养基购自杭州微生物试剂有限公司;API 20NE细菌鉴定系统试剂条是法国生物梅里埃中国有限公司产品;药敏纸片是杭州天和微生物试剂有限公司产品。TSA培养基系法国Becton公司产品。
Taq酶购自上海生物工程技术有限公司,pGEM—T Easy载体是Promega公司产品。
1.2 病毒 PCR 检测
取症状典型的患病脊尾白虾分别制备检测用DNA模板和RNA模板,分别进行对虾白斑综合症病毒(WSSV)和桃拉综合症病毒(TSV)PCR检测。WSSV采用KIMURA[2]NEST-PCR引物,外引物:P1:5’ATCATGGCTGCTTCACAGAC 3’和 P2:5’GGCTGGAGAGGACAAGACAT 3’内引物:P3:5’TCTTCATCAGATGCTACTGC 3’和 P4:5’TACGGCAGCTGCTGCACCTTGT 3’;TSV 采用 OIE 手册(2009 版)[3]推荐的引物,9195:5’TCAATGGAGCTTGGTCC 3’和 9992:5’AAGTAGACAGCCGCGCTT 3’。
1.3 细菌分离
取症状典型的患病脊尾白虾,用70%酒精棉球对其体表擦洗消毒,无菌条件下取心血淋巴液和肝胰腺,在营养琼脂和TCBS培养基平板上划线接种;27℃恒温倒置培养24 h,挑取形态特征一致的优势菌落进行分离纯化;在营养琼脂和TCBS培养基上接种纯化后的优势菌,27℃恒温倒置培养24 h,观察菌落颜色及形态特征。将纯化后的菌株置于含15%甘油的液体培养基中,-80℃超低温冰箱中保存备用。
1.4 人工感染试验
1.4.1 感染用菌的准备
将实验菌株接种新鲜营养琼脂斜面,27℃下恒温培养(18~24 h),用无菌生理盐水洗下菌苔,采用分光光度法(OD550 nm)结合活菌平板计数法,制成浓度为106~108个/mL的菌悬液备用。
1.4.2 人工感染试验用虾
采自本所试验场围塘养殖的健康脊尾白虾,体重约0.41±0.07 g,选体表无损伤,体色正常的健康虾作为试验用虾。健康虾在室内暂养3 d,无异常反应后备用。
1.4.3 感染试验
采用肌肉注射法,对健康脊尾白虾的第2和第3腹节之间的肌肉进行注射,试验每组设20尾,每尾注射50 μL菌液,分别为106~108个/mL的菌悬液(根据条件试验后设定),对照组注射等量无菌生理盐水。感染试验在20 cm×50 cm玻璃缸水槽内进行,试验期间水温控制在26~27.5℃,每天投喂南美白对虾配合饲料,每日天换水并观察其活动、摄食及死亡情况。对患病濒死的脊尾白虾取肌肉进行细菌再分离,试验持续7 d。
1.5 病原菌鉴定
1.5.1 形态观察及生理生化试验
将病原菌稀释后涂布于TCBS琼脂平板上,于27℃培养24 h,观察其菌落形态特征。革兰氏染色光学显微镜观察。同时用法国生物梅里埃公司API 20NE细菌鉴定系统进行生化反应测试,并根据文献[4]的方法选取有代表性的生化反应,用细菌微量生化鉴定管补充生化试验。
1.5.2 16 S rDNA 和 HSP60 基因序列分析
细菌DNA模板的制备:用细菌接种棒挑取纯化的单菌落于100 μL无菌去离子水中,沸水煮5 min,冰浴5 min,4℃8 000 r/min离心10 min,取上清作为PCR反应所用模板。
PCR扩增和测序:细菌16S rDNA基因通用引物为27F:5’AGAGTTTGATCATGGCTCAG 3’和1492R:5’TACGGTTACCTTGTTACGACTT 3’;HSP60 基因 PCR 扩增简并引物 H60F:5’-GGNGAYGGNACNACNACNGCNACNGT-3’,和 H60R:5’TCNCCRAANCCNGGNGCYTTNACNGC3’。PCR 采用 50 μL 反应体系,反应参数:94℃ 5 min;94℃ 30 s,55℃ 45 s,72℃ 1 min,40个循环;72℃ 10 min。PCR产物由英潍捷基(上海)贸易有限公司完成测序。用DNASTAR软件处理测序得到的16S rDNA和HSP60基因序列,并将序列在GenBank核酸数据中进行进行BLAST分析。HSP60基因序列的系统关系分析使用MEGA(version3.1)分析软件,进行1 000次抽样自展,邻位相连法(Neighbor-joining)构建分子系统树。
1.6 病原菌药敏试验
采用纸片扩散法,涂布接种病原菌于营养琼脂培养基平板,将药敏纸片用无菌镊子轻轻贴在平板表面,27℃恒温培养24 h,观察抑菌圈的有无与直径大小,依据药敏标准判断菌株对药物的敏感性。
2 结果
2.1 患病对虾临床症状
患病脊尾白虾主要表现为虾体全身性发红,额剑发黑,反应迟钝,摄食减少或不摄食,肝胰脏肿大,肠胃空。

图1 患病脊尾白虾Fig.1 The diseased E.carinicauda
2.2 病毒 PCR 检测
对患病虾进行WSSV和TSV PCR扩增,结果显示均为阴性。
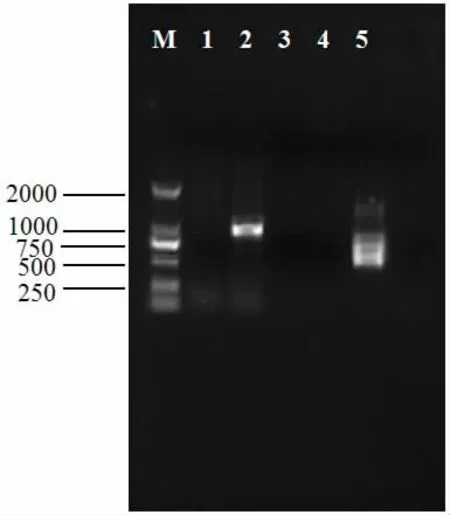
图2 脊尾白虾WSSV的PCR检测结果Fig.2 Deteced the WSSV infection of E.carinicauda by PCR
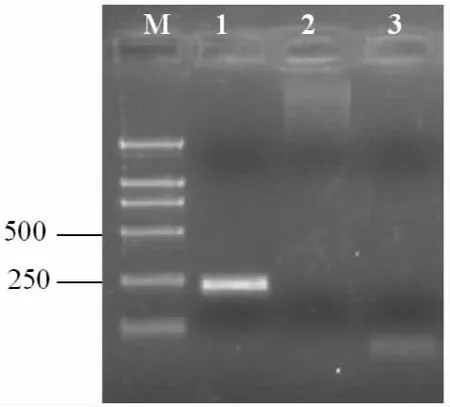
图3 脊尾白虾TSV的RT-PCR检测结果Fig3.Deteced the TSV infection of E.carinicauda by RT-PCR
2.3 病原菌的分离
从患病脊尾白虾血淋巴和肝胰腺上分离到优势菌一株,命名为XS1207005。将优势菌在营养琼脂和TCBS培养基上纯化培养,结果均生长良好。在营养琼脂培养基上菌落形态、颜色均一致,菌落边缘规则,光滑、湿润、不透明、乳白色菌落;在TCBS平板上呈黄色菌落,隆起,圆形,边缘整齐。经革兰氏染色鉴定,XS1207005为革兰氏阴性菌,显微镜下可观察到菌体呈短杆状,分散排列,可运动。培养试验表明,菌株XS1207005在15~30℃生长快,4℃和42℃不生长。
2.4 人工感染试验结果
采用分光光度法(OD550 nm)结合活菌平板计数法,配制成浓度为 3.4×108、3.4×107、3.4×106CFU/mL的菌悬液。
感染试验的结果表明,以XS1207005对健康脊尾白虾进行攻毒感染后,在攻毒第1天即开始陆续死亡,7 d后均全部死亡。死亡对虾表现出的红体症状与患病对虾相同;而对照组只有1尾对虾死亡,且该虾是因为脱壳时被其它对虾捕食导致死亡(表1)。
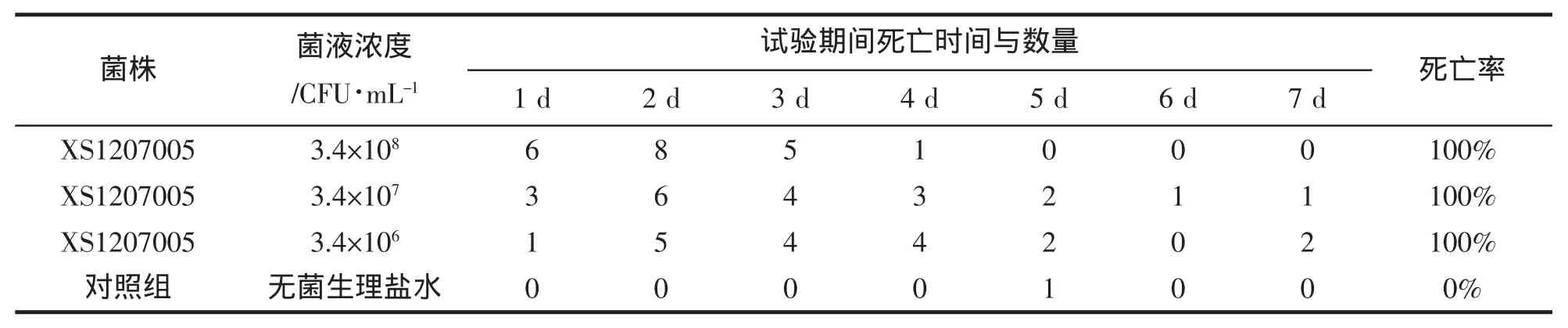
表1 菌株XS1207005对脊尾白虾攻毒试验Tab.1 Virulence to E.carinicauda with strain XS1207005
2.5 病原菌的生理生化特征鉴定结果
对菌株XS1207005进行了主要理化特性的测定,详见表2。结果表明,菌株XS1207005为革兰氏阴性,油镜下观察菌体呈弧形短杆状,可运动,大小约 1.4 μm×0.8 μm,兼性厌氧、发酵葡萄糖发酵、氧化酶和接触酶反应均呈阳性、对弧菌抑制剂O/129(2,4-二氨基-6,7-二异丙基喋啶磷酸盐,150 μg/mL)敏感等,符合弧菌属的典型特征,征初步判定XS1207005菌株为弧菌属(Vibrio)细菌。

表2 菌株XS1207005的生理生化结果Tab.2 Physiological and biochemical results of strain XS1207005
2.6 基因序列分析和系统发育树的构建
测序结果显示菌株XS1207005的16S rDNA基因序列长度为1 516 bp。将该序列进行BLAST分析,结果显示:菌株XS1207005与哈维氏弧菌V.harveyi最为接近,同源性高达99%,但16S rDNA基因序列结果显示,菌株XS1207005与溶藻弧菌V.alginolyticus、副溶血弧菌V.parahaemolyticus的同源性也很高,最高达到98%。
试验同时测定了菌株XS1207005的部分HSP60基因序列,序列长度为496 bp。BLAST分析显示,该基因序列与弧菌属细菌的HSP60基因序列的同源性较高(94%~100%)。其中,与哈维氏弧菌的HSP60序列同源性高达99.6%,而与其他弧菌属细菌的HSP60基因同源性均小于91%。以菌株XS1207005的HSP60序列与相关种属细菌的HSP60序列构建系统发育树(图2),结果表明,菌株XS1207005与哈维氏弧菌自然聚为一支,置信度为100%。
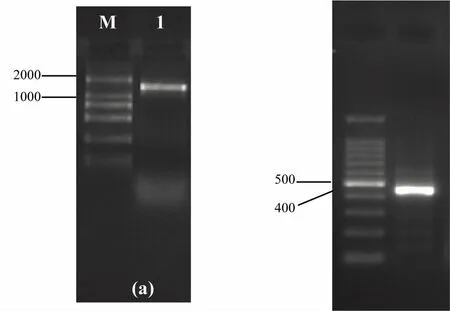
图4 菌株 XS1207005的16S rDNA(a)和HSP60(b)基因PCR扩增产物Fig.4 PCR amplified products of 16S rDNA gene(a)and HSP60 gene(b)of strain XS1207005
2.7 药敏试验结果
采用纸片法测定菌株XS1207005对22种抗菌药物的敏感性。结果表明,病原菌对先锋噻肟、复方新诺明、利福平、先锋必、菌必治、氟哌酸、复方欣及氧氟沙星等8种药物敏感;对先锋V、青霉素G、万古霉素、氨苄青霉素、苯青唑霉素等5种药物不敏感,对头孢拉定、红霉素、呋喃妥因、庆大霉素、链霉素、卡那霉素、头孢呋肟等7种药物中度敏感,详见表3。
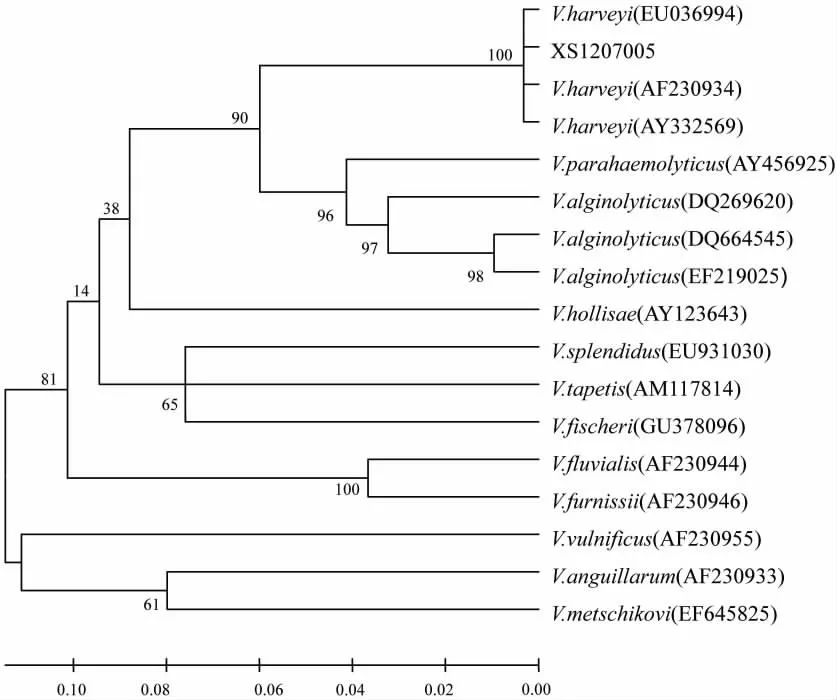
图5 基于HSP60序列的弧菌系统发育树Fig.5 Phylogenetic tree of Vibrio based on HSP60 genes
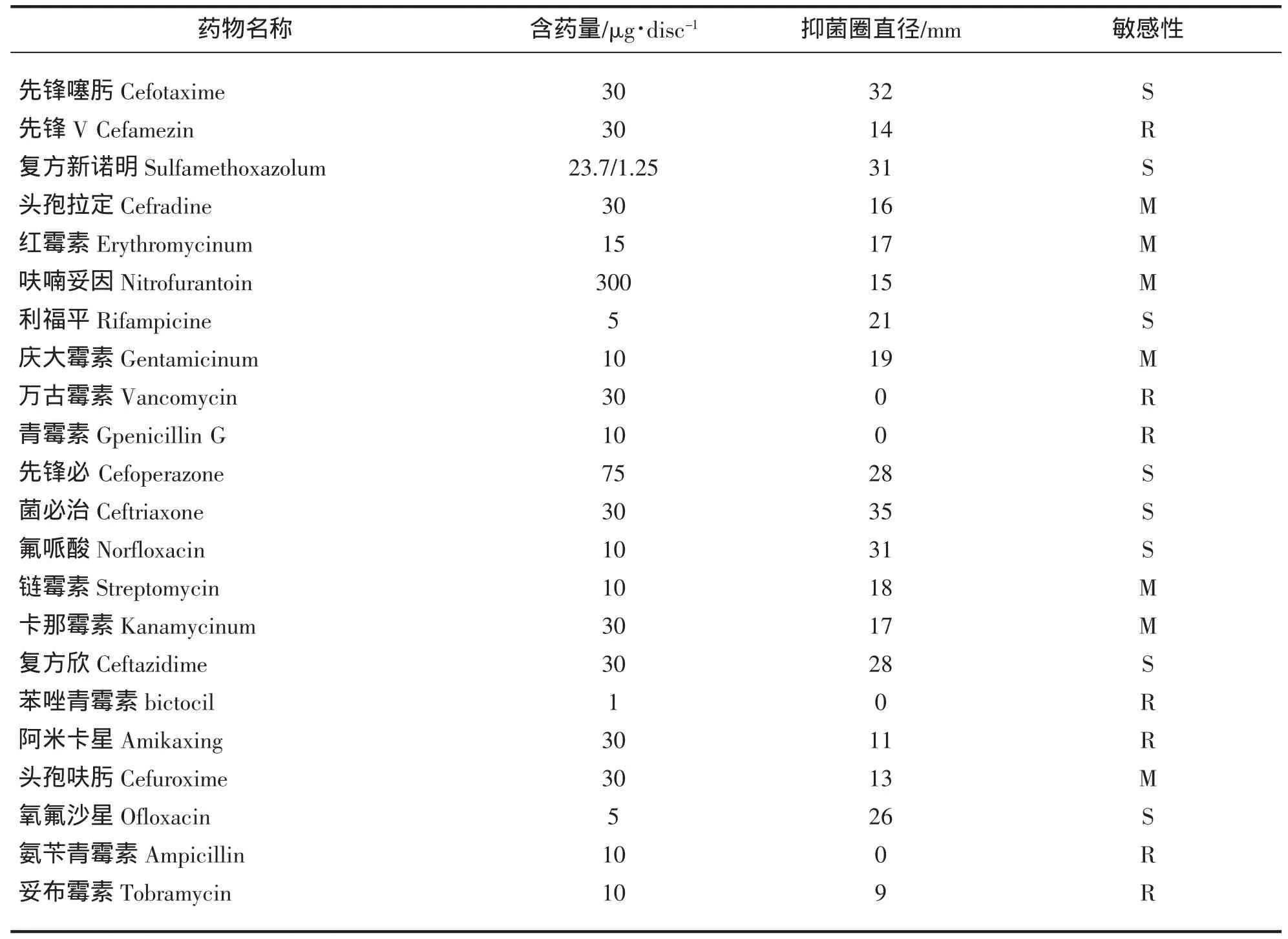
表3 菌株XS1207005对不同抗菌药物的敏感性Tab.3 Sensibility of strain XS1207005 to different antibacterial agents
3 讨论
“红体病”是虾类养殖当中一种危害较大的常见疾病,其主要表现为病虾虾体发红。但正如其他以症状命名的疾病一样,“红体”只是对虾发生某些疾病后的一种表观现象,事实上,研究发现能引起虾类体色发红的原因很多。周永灿等[5]曾报道溶藻弧菌和副溶血弧菌可以引起南美白对虾红体病;薛辉等[6]报道嗜水气单胞菌是引起日本沼虾红体病的病原,叶雪平等[7]也报道了拟态弧菌是引起青虾红体综合症病原。根据南美白对虾的“红体病”的研究发现[8-11],病毒、细菌和氨氮过高引起的环境突变均会引起对虾出现红体症状。本研究从患红体病的脊尾白虾中分离到一株优势菌株XS1207005,根据其菌落形态、生理生化特征及16S rDNA和HSP60基因同源性分析结果,该菌与哈维氏弧菌相似,其中HSP60基因与哈维氏弧菌相应片段同源性高达99.6%,将其鉴定为哈维氏弧菌。用该菌人工感染健康脊尾白虾,其能使健康虾发病,且表现出与自然感染病虾相似的症状,因此,可以确定哈维氏弧菌为引起此次暂养脊尾白虾红体病的病原。
哈维氏弧菌在海水中是较常见的优势菌群,广泛分布于世界各地海水及河口处,并且数量众多,是海水类弧菌之首,为海洋中正常菌群之一,在多种海洋动物中均存在。哈维氏弧菌是鱼、虾、贝等海水养殖品种的条件性致病菌,研究认为宿主的生理状态、养殖环境的理化条件均与哈维氏弧菌的致病性密切相关[12]。本次发病的脊尾白虾是从围塘捕获后暂养于室内水泥池,养殖密度变大,同时养殖管理也相应发生了变化,养殖环境发生的这些变化因素使脊尾白虾造产生了应激反应。在应激期间,脊尾白虾的自身免疫力会急剧下降,此时对虾就会极易因感染水体中的条件性致病菌而发病。
在对虾养殖中,改善水质、定期消毒水体、在饵料中添加Vc和免疫多糖等免疫增强剂以及消毒后投放有益微生物制剂等方法,可以有效预防这类由条件致病菌引起疾病。抗菌药物的使用是治疗该类疾病常用的手段。药敏结果显示:从发病虾上分离到的病原菌对复方新诺明、氧氟沙星、氟派酸等高度敏感,本试验以口服药饵结合水体消毒的方法进行治疗,取得了明显的疗效。
红体病也是近年脊尾白虾养殖过程当中重要的一种疾病,但目前还无有关脊尾白虾“红体病”病原的研究报道,而哈维氏弧菌引起虾类红体病的报道也尚属首次,有关虾体发红的机理,有待于进一步研究。
[1]许文军,谢建军,施 慧,等.池塘养殖脊尾白虾感染血卵涡鞭虫的研究[J].海洋与湖沼,2010,41(3):1-6.
[2]KIMURA T,YAMANO K,NAKANO H,et al.Detection of penaeid rod-shaped DNA virus(PRDV)by PCR[J].Fish Pathol,1996,31(2):93-98.
[3]世界动物卫生组织(OIE).水生动物疾病诊断手册[M].国家质量监督检验检疫总局,译.北京:中国农业出版社,2000:172-209.
[4]中国科学院微生物研究所细菌分类组.一般细菌常用鉴定方法[M].北京:科学出版社,1978.
[5]周永灿,张 本,陈雪芬,等.养殖对虾细菌性红体病的初步研究[J].海洋科学,2003,27(5):61-65.
[6]薛 晖,陆全平,马小荣,等.日本沼虾“红体病”病原的研究[J].水产养殖,2004,25(5):35-37.
[7]叶雪平,罗毅志,杨广智,等.青虾红体综合症病原研究[J].浙江海洋学院学报:自然科学版,2002,21(2):106-108,122.
[8]张 坷,万 志.南美白对虾三种类型红体病的防治方法[J].北京水产,2004(4):34.
[9]ALAPIDE T E V,DUREZA L A.Isolation of Vibrio spp.From Penaeus monodon(Fabricius)with red disease syndrome[J].O-ceanographic Literature Review,1998,45:362-367.
[10]AGUIRRE G,GABRIEL,ASCENCIO V,et al.Infectious disease in shrimp species with aquaculture potential[J].Resent Res Devl Microbiology,2000,4:333-348.
[11]孙克年.南美白对虾红体病的临床鉴别与防治[J].内陆水产,2007(5):25-26.
[12]张晓华,钟英斌,陈吉祥.哈维氏弧菌的生物学特性、流行病学及检测技术[J].中国海洋大学学报:自然科学版,2007,37(5):740-748.
