超声辅助酶法制备山杏仁多肽
2014-07-07于国泳郭鹏孙登岳范俊峰
于国泳,郭鹏,孙登岳,范俊峰*
1.北京林业大学生物科学与技术学院,北京100083 2.山东农业大学食品科学与工程学院,山东泰安271018
超声辅助酶法制备山杏仁多肽
于国泳1,郭鹏2,孙登岳2,范俊峰1*
1.北京林业大学生物科学与技术学院,北京100083 2.山东农业大学食品科学与工程学院,山东泰安271018
本研究以山杏仁为原料,研究了蛋白酶种类、超声功率、超声时间、超声温度、加酶量、pH值、底物浓度对水解度和多肽得率的影响。结果表明:超声功率80 w、超声时间180 min、超声温度50℃、复合蛋白酶加量5000 U/g,pH值6.0,底物浓度40 g/L,山杏仁多肽得率达到最大。该条件下,山杏仁多肽得率为56.68±0.99%。
山杏仁;超声辅助;蛋白酶;多肽
山杏仁为木本植物山杏(Armeniaca sibirica Lam.)的种子,是具有很高营养价值的药食同源性食材[1,2]。目前,山杏仁加工仅是初级加工阶段,多用于提杏仁油与苦杏仁甙的生产,其蛋白质综合利用率低,造成巨大浪费[3,4]。近年来,肽类物质由于具有特殊的营养、良好的加工功能特性及多种生物活性已成为国际研究的热点。因此,利用山杏仁为原料开发山杏仁多肽不但改变山杏仁蛋白的加工特性,而且为功能性食品及药品开发提供了良好的原料,从而促进了山杏仁蛋白深加工业的发展。山杏仁蛋白深加工产业发展能有效优化山杏仁产业结构,推动我国山杏产业及功能食品行业发展,具有巨大的社会效益、经济效益及环保效益。
化学水解法、定向合成法、酶水解法及微生物发酵法是目前获取生物活性肽的常用方法[5]。化学水解法因不能进行特异水解、工艺控制困难、产品质量不稳定、营养成分损失大及环境不友好等原因,不适合于大规模的工业化生产[5,6]。定向合成法在合成过程存在消旋现象,且采用此法很难生产食品级的产品及环境污染问题[7]。微生物发酵法生产活性肽虽安全且易操作,但存在生产周期长、目标产物分离困难[8]。酶水解法制备生物活性肽具有特异高、生产条件温和等优点,是目前获得食品级生物活性肽最主要的方法[6,8]。近年来,超声波技术在天然产物提取、制备方面已经被广泛应用[9]。研究表明,超声波处理能够提高改变原料性质、提高酶活力、增加蛋白酶切位点、促进酶催化反应、提高多肽得率[10,11]。目前,未见采用超声辅助酶法对山杏仁蛋白的酶解工艺的研究。本文对超声辅助酶法制备山杏仁多肽工艺条件进行研究,建立超声辅助酶法制备山杏仁多肽的技术参数,为山杏仁多肽开发提供理论基础和实践经验。
1 材料与方法
1.1 试验材料
山杏仁(Armeniaca mandshurica(Maxim.)Skv),北京市农林科学院林业果树研究所提供;木瓜蛋白酶(酶活:2000 U/g),sigma,风味蛋白酶(酶活:20000 U/g),复合蛋白酶(酶活:120000 U/g),上海源叶生物科技有限公司;中性蛋白酶(酶活:60000 U/g),sigma;碱性蛋白酶(酶活:200000 U/g),sigma;其他化学试剂均为国产分析纯。
1.2 仪器与设备
KQ-600DB型数控超声波清洗器,昆山市超声仪器有限公司;KQ5200E型超声波清洗器,昆山市超声仪器有限公司,PB153-S电子天平,METTLER TOLEDO;HH-6数显恒温水浴锅,常州市华普达教学仪器有限公司;PHS-3D pH计,上海精密科学仪器有限公司;UV754N紫外分光光度计,上海奥普勒仪器有限公司。
1.3 试验方法
1.3.1 山杏仁蛋白提取采用顾欣报道的方法进行提取[12]。
1.3.2 山杏仁多肽制备采用分析天平称取一定数量上述方法制备蛋白粉,用蒸馏水配置一定浓度山杏仁蛋白粉溶液,用0.5 mol/L的HCl或NaOH调节pH值,添加一定量蛋白酶,控温水解,解热灭酶,冷却至室温,3800 r/min离心20 min,得山杏仁短肽溶液(上清液)。
1.3.3 蛋白酶筛选配置40 g/L的山杏蛋白溶液,用0.5 mol/L的HCl或NaOH调整5种蛋白酶的最适pH,分别在5种蛋白的最适温度下,按照加酶量4000 U/g添加5种蛋白酶,酶解过程中不断加入0.5 mol/L NaOH来控制反应体系pH值恒定,酶解3 h,95℃水浴15 min灭酶。以水解度和多肽得率为指标,选择最佳蛋白酶。
1.3.4 试验方案选取山杏仁蛋白酶解因素超声功率(0、60、80,100、120、240 w)、超声温度(40、45、50、55、60℃)、超声时间(120、150、180、210、240 min)、加酶量(3500、4000、4500、5000、5500 U/g)、pH值(5.0、5.5、6.0、6.5、7.0)、底物浓度(30、35、40、45、50、55 g/L),分别考察各因素对水解度和多肽得率的影响。
1.3.5 分析方法(1)蛋白质测定:采用GB/T 5009.5-2010中的方法;(2)水解度测定:采用甲醛滴
定法[1];(3)短肽得率测定:采用三氯乙酸(TCA)可溶性氮法[13]。
1.4 数据分析处理
每项实验重复3次,实验所得数据,采用SAS8.0、DPS7.05进行数据的处理。
2 结果与分析
2.1 不同蛋白酶对水解度和多肽得率的影响
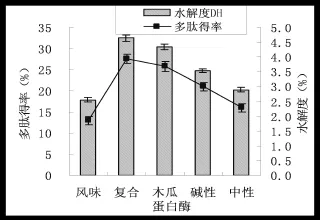
图1 不同蛋白酶对水解度和多肽得率的影响Fig.1 The effect of ultrasonic power on hydrolysis degree and he extraction rate of polypeptide
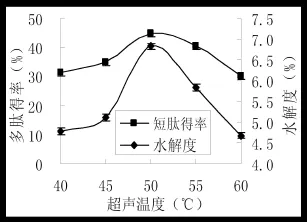
图2 超声温度对水解度和多肽得率的影响Fig.2 The effect of ultrasound temperature on hydrolysis degree and the rate of polypeptide yield
按照1.3.3方法进行试验,测定山杏仁蛋白水解后的多肽得率及水解度,结果如图1。由图1可以看出,不同蛋白酶对山杏仁蛋白水解度效果不同,多肽得率也存在一定差异。复合蛋白酶、木瓜蛋白酶的水解度及多肽得率均较高,且二者差异不明显(P>0.05)。但木瓜蛋白价格远远高于复合蛋白酶,因此,本研究选择复合蛋白酶进一步试验。
2.2 超声功率对水解度和多肽得率的影响
设定超声温度45℃、超声时间150 min、加酶量4000 U/g、pH值6.0、底物浓度40 g/L,研究不同超声时间(0、60、80,100、120、240 w)对水解度和多肽得率的影响,结果见表1。
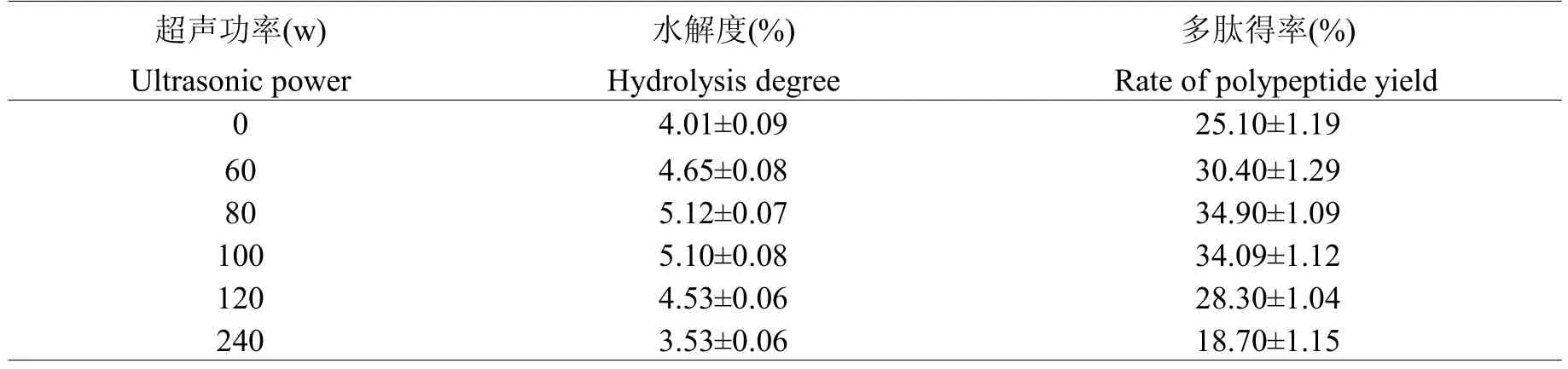
表1 超声功率对水解度和多肽得率的影响Table 1 The effect of ultrasonic power on hydrolysis degree and the rate of polypeptide yield
由表1可知,随着超声功率的升高,山杏仁水解度及多肽得率均呈现先升高后下降的趋势。60 w与未经超声处理处理相比差异显著(P<0.05),80 w处理与100 w处理差异不明(P>0.05),与120 w处理差异明显(P<0.05)。因此,超声功率过大,反而会导致水解度及多肽得率下降。故最佳超声功率为80 w。
2.3 超声温度对水解度和多肽得率的影响
固定其他因素不变,超声功率为80 w,研究不同超声温度(40、45、50、55、60℃)对水解度和多肽得率的影响,结果见图2。
图2可以看出,随着超声温度的提高,水解度及多肽得率呈现升高趋势,当超声温度超过50℃后,超声温度再进一步升高,多肽得率及水解度下降明显(P<0.05)。因此,选择超声温度为50℃。
2.4 超声时间对水解度和多肽得率的影响
改变超声时间120、150、180、210、240 min,超声温度50℃、超声功率为80 w,其他条件不变,测定水解度和多肽得率,结果见图3。

图3 超声时间对水解度和多肽得率的影响Fig.3 The effect of ultrasound time on hydrolysis degree and the rate of polypeptide yield
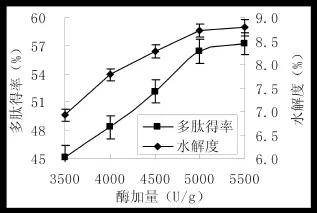
图4 加酶量对水解度和多肽得率的影响Fig.4 The effect of enzyme concentration on hydrolysis degree and the rate of polypeptide yield
由图3可知,在超声时间小于180 min前,随着超声时间的延长,水解度及多肽得率逐渐升高。当超声达到180 min后,随着超声时间延长,水解度及多肽得率升高不明显。通过方差分析表明,超声180、210、240 min三者之间差异不显著(P>0.05)。因此,选择180 min为最佳超声时间。
2.5 加酶量对水解度和多肽得率的影响
超声温度50℃、超声功率80 w、超声时间180 min,其他条件不变,研究不同加酶量(3500、4000、4500、5000、5500 U/g)对水解度和多肽得率的影响,结果见图4。
图4表明,加酶量对水解度及多的得率有一定影响,随着加酶量的增加,水解度及多肽得率均呈现逐渐升高趋势。加酶量5000 U/g与5500 U/g对水解度及多肽得率影响差异不明显(P>0.05),故加酶量5000 U/g为最佳加酶量。
2.6pH值对水解度和多肽得率的影响
超声温度50℃、超声功率80 w、超声时间180 min、加酶量5000 U/g,其他条件不变,调整反应体系pH值分别为5.0、5.5、6.0、6.5、7.0、7.5,测定水解度和多肽得率,结果见图5。

图5 pH值对水解度和多肽得率的影响Fig.5 The effect of pH value on hydrolysis degree and the rate of polypeptide yield

图6 底物浓度对水解度和多肽得率的影响Fig.6 The effect of substrate concentration on hydrolysis degree and the rate of polypeptide yield
由图5可以看出,水解度及多肽得率随着pH值升高而升高,当pH值大于6.0,随着pH值得变化呈现下降趋势,因此,山杏仁水解最佳pH值为6.0。
2.7 底物浓度对水解度和多肽得率的影响
固定超声温度为50℃、超声功率为80 w、超声时间为180 min、加酶量为5000 U/g,pH值为6,研究不同底物浓度(30、35、40、45、50、55 g/L)对水解度和多肽得率的影响,结果见图6。
由图6可知,随着底物浓度的增加,水解度及多肽得率逐渐降低。方差分析表明,底物浓度40 g/L与35 g/L之间,水解度及多肽得率差异不明显(P>0.05),与30 g/L相比,水解度及多肽得率差异明显(P<0.05)。结合实际生产效率,选择底物浓度为40 g/L。
3 讨论
制备生物活性肽是杏仁综合利用最为主要的方向之一。相关研究表明杏仁蛋白能够制备抗氧化性肽、ACE抑制肽、血小板聚集活性抑制肽、降血压肽等生物活性肽[1,3,7,14]。而这些生物活性肽制备的前提是首先获得杏仁多糖多肽水解液。以蛋白为原料制备多肽方法主要包括化学水解法、酶水解法及微生物发酵法,其中酶水解法目前是获得食品级生物活性肽最主要的方法[5,6,8]。超声波技术在生物活性物质提取、制备方面表现了巨大的优势[15]。本研究将超声波技术应用于酶法制备山杏仁多肽研究中,取得了良好效果。同时证实低功率超声波能够提高山杏仁多肽制备效率,高功率超声波起到相反作用。这可能是由于低强度超声能够提高酶的活性,高强度超声能够降低酶促反应速度。这一研究结果与吕鹏的研究一致[16]。
4 结论
(1)研究证明,低于100 w的超声波能够有效的提高山杏仁多肽酶法制备效率,超声功率高于120 w反而会降低了山杏仁多肽酶法制备效率;
(2)超声辅助酶制备山杏仁多肽最优工艺参数为:超声功率80 w、超声时间180 min、超声温度50℃、复合蛋白酶加量5000 U/g,pH值6,底物浓度40 g/L。
[1]黄昆,顾欣,王文江,等.山杏仁多肽的制备及清除自由基能力研究[J].食品工业科技,2012,33(18):107-115
[2]杨庆仙.我国山杏种质资源研究现状[J].北方园艺,2008,2:44-47
[3]顾欣,崔洁,李迪,等.山杏仁肽的体外抗氧化活性研究[J].中国油脂,2012,37(9):40-42
[4]谢朝晖,李鑫,李文博,等.超声波法提取山杏仁中苦杏仁苷的单因素试验研究[J].河南城建学院学报,2012,21(2): 31-37
[5]Sharma S,Singh R,Rana S.Bioactive Polypeptides:AReview[J].Int.J.Bioautomation,2011,15(4):223-250
[6]Singha B P,Vij S,Hati S.Functional signif i cance of bioactive polypeptides derived from soybean[J].Polypeptides, 2014,54:171–179
[7]王春艳.杏仁短肽制备及降血压活性研究[D].北京:中国农业科学院,2011
[8]Agyei D,Danquah K.Industrial-scale manufacturing of pharmaceutical-grade bioactive polypeptides[J].Biotechnol Adv,2011,29(3):272–277
[9]Pan G Y,Yu G Y,Zhu C H,et al.Optimization of ultrasound-assisted extraction(UAE)of flavonoids compounds(FC) from hawthorn seed(HS)[J].Ultrasonics Sonochemistry,2012(19):486–490
[10]杜双奎,于修烛,李志西.超声波预处理对鹰嘴豆蛋白制备抗氧化肽的影响[J].中国食品学报,2013,13(1):80-88
[11]Jia J Q,Ma H L,Zhao W R,et al.The use of ultrasound for enzymatic preparation of ACE-inhibitory polypeptides from wheat germ protein[J].Food Chemistry,2010,119(1):336-342
[12]顾欣,李莉,侯雅坤,等.响应面法优化山杏仁蛋白提取工艺研究[J].河北林果研究,2010,25(2):162-168
[13]Jang A,Lee M.Purification and identification of angiotensin I converting enzyme inhibitory polypeptides from beef hydrolysates[J].Meat Seienee,2005,69:653-661
[14]孔令明,劳斐,朱正兰.响应面法优化杏仁ACE抑制肽的酶解工艺研究[J].中国食品添加剂,2013,1:130-136
[15]Shirsat S R h,Sonawane S H,Gogate P R.Intensification of extraction of natural products using ultrasonic irradiations—A review of current status[J].Chemical Engineering and Processing:Process Intensification,2012, 53:10-23
[16]吕鹏,庄重,凌建亚,等.超声对酶的影响[J].生物技术通讯,2004,15(5):534-536
Preparation ofApricot Kernel Polypeptide by Ultrasonic-assisted Enzymatic Hydrolysis
YU Guo-yong1,GUO Peng2,SUN Deng-yue2,FAN Jun-feng1*
1.College of Biological Sciences and Biotechnology,Beijing Forestry University,Beijing 100083,China 2.College of Food Science and Engineering,Shandong Agricultural University,Taian 271018,China
In the paper,the effect of the protease type,ultrasonic power,ultrasound temperature,ultrasonic time, enzyme concentration,pH value and substrate concentration on hydrolysis degree and the rate of polypeptide yield form apricot kernel was investigated.The optimal preparation technology of apricot kernel polypeptide was ultrasonic power 80 w, ultrasonic time 180 min,ultrasound temperature 50℃,Protamex concentration 5000 U/g,pH value 6.0 and substrate concentration 40 g/L.Under the optimum condition,the rate of polypeptide yield was 56.68±0.99%.
Apricot kernel;ultrasonic-assisted;protease;polypeptide
TS255.6
A
1000-2324(2014)03-0377-05
2013-01-22
2013-02-11
于国泳(1989-),男,汉族,硕士研究生,主要从事保健及功能食品研究.
*通讯作者:Author for correspondence.E-mail:fanjunfeng@bjfu.edu.cn
