新型多孔Ti/BDD薄膜电极电化学氧化降解低浓度茜素红
2014-07-05周如彬冉二燕孙见蕊张德文张宝昌
周如彬,冉二燕,孙见蕊,张德文,张宝昌
(1长春工业大学化学与生命科学学院,吉林 长春 130022;2长春工业大学化学工程学院,吉林 长春 130022)
新型多孔Ti/BDD薄膜电极电化学氧化降解低浓度茜素红
周如彬1,冉二燕2,孙见蕊1,张德文1,张宝昌1
(1长春工业大学化学与生命科学学院,吉林 长春 130022;2长春工业大学化学工程学院,吉林 长春 130022)
运用热丝化学气相沉积(HFCVD)的方法制备了以多孔钛为基体的掺杂硼金刚石(porous Ti/BDD)薄膜电极,并测试了它的主要物理性质,SEM表明金刚石相生长良好并且能均匀地分布在基体表面和孔内,Raman光谱表明电极的金刚石相纯而且质量很高。采用循环伏安法研究了酸性条件下茜素红在多孔Ti/BDD电极上的电氧化行为。通过改变阳极电流密度、支持电解质Na2SO4的浓度来研究茜素红在多孔Ti/BDD电极上的电化学氧化降解的效果影响。结果表明:电流密度40 mA/cm2、支持电解质浓度0.5 mol/L为较理想的工艺参数,总电流效率达到30.2%。在相同条件下,发现多孔Ti/BDD薄膜电极氧化降解茜素红与平板Ti/BDD薄膜电极相比具有更高的电流效率。紫外可见光光谱证实了多孔Ti/BDD电极能够有效地电氧化降解茜素红。
多孔钛;掺杂硼金刚石薄膜电极;茜素红;电化学氧化
目前有机染料废水的处理是比较困难的。它具有色度高、成分复杂、难生化降解、毒性大以及无机盐含量高的特点,若直接将它排入水中会导致生态系统破坏,不过常规的处理方法很难将它完全降解[1-2]。茜素红属于蒽醌类化合物,被广泛应用在染料、酸碱指示剂中,由于其难以用化学方法将其氧化降解,也难以用物理方法彻底去除,因此常被人们拿来当作染料废水降解研究的典型代表[3]。
电化学氧化法因具有清洁无污染、设备体积小、能耗低、降解效率高等特点到而受到人们的关注。它的工作原理是有机污染物在电极表面直接发生了电化学氧化降解,或者是电极的表面产生了强氧化性的物质从而将有机污染物氧化使其降解,但是其中最关键的就是阳极材料的选择。硼掺杂金刚石(BBD)薄膜电极作为一种新型的阳极材料由于其低背景电流、宽的电势窗口以及电化学性能稳定等特点[4],在污水处理领域受到了广泛关注[5]。
目前人们制备金刚石薄膜主要研究的基体材料有Ti、Si、Ta、W、Mo等金属材料[6-7],不过以上述材料为基体的电极大多是平面结构,而平板电极具有有效面积小、传质效果不好的特点,若能通过改变形状等方法将平板电极改为三维电极,那么其有效面积、传质效果等将会得到极大改善,而多孔电极就是三维电极的一种[8]。多孔掺硼金刚石薄膜电极能够增大电极的比表面积从而能够获得更高的电流密度和电化学氧化活性,因此能大范围地应用在电催化和电化学能量存储领域[9-10]。但是,目前对多孔钛基体上沉积金刚石薄膜的研究还较少,一些研究者已经探索出掺硼金刚石薄膜沉积在多孔钛基体上的工艺条件[11]。
本实验用热丝化学气相(HFCVD)法制备了多孔钛基底沉积掺硼金刚石薄膜电极,并且以染料茜素红为有机污染物代表,研究了多孔Ti/BDD电极对有机废水的电化学催化氧化作用及影响因素进行的实验研究。
1 实验部分
1.1 仪器和试剂
(1)实验仪器 EA-HFCVD 沉积装置,由热丝500改装而成;恒流/恒压电源,HYL-A 型,永恒化学仪器厂;电化学工作站2273,USA Princeton Applied Research;化学需氧量测试仪,COD-571型号,上海精密仪器有限公司;电解槽,自组装。
(2)试剂 硼酸三甲酯,无水硫酸钠、茜素红、硫酸,均为AR级。
1.2 实验方法
1.2.1 多孔Ti/BDD电极的制备
本实验中的多孔钛基体购自于陕西宝鸡金凯科工贸有限公司,多孔钛片长15 mm,宽10 mm,沉积前对多孔钛片进行如下预处理:首先在4 mol/L盐酸溶液中煮沸15 min去除表面氧化物,然后再用去离子水冲洗干净,在金刚石粉悬浊液中超声40 min,然后依次在丙酮、乙醇、去离子水中超声5 min,最后在氮气气氛下干燥。采用EA-HFCVD系统,用甲烷当作碳源气体,含量为1%,B(OCH3)3作为硼源,将H2通入硼酸三甲酯中对金刚石进行掺杂,标准状态下在开始的1 h保持B(OCH3)3/H2流量为8 mL/min,而在反应后的3 h中保持B(OCH3)3/H2流量为3 mL/min 。在反应过程中,CH4的流量为3 mL/min,氢气的流量为300 mL/min,腔体的总压强为4 kPa,样品的生长时间为4 h。运用SEM (JSM-6480LV)及Raman(Renishaw in via Raman,激发波长514 nm)方法对电极进行了物理表征。
1.2 .2 多孔Ti/BDD电极的循环伏安曲线测定
不锈钢电极为对电极,工作电极为多孔Ti/BDD电级,它们的面积都为1.5 cm2,饱和甘汞电极(SCE)为参比电极,循环伏安法的测试条件为:电解液为0.5 mol/L的H2SO4溶液,扫描的范围是-1.4~2.7 V,扫描的速率是100 mV/s。为了测试茜素红在多孔Ti/BDD电极上的电化学行为,以1 mmol/L的茜素红和0.5 mol/L的H2SO4溶液为电解液,采用100 mV/s 的扫描速率,连续扫描多次。在测试之前通高纯氮气20 min以排除溶液中氧气的干扰。
1.2.3 茜素红电催化氧化降解
选用100 mL单室无隔膜的电解槽,保持溶液温度20 ℃。配置以Na2SO4为支持电解质,浓度为1 mmol/L的茜素红100 mL的电解液,调节两电极间的距离为1 cm,电解之前用1 mol/L的硫酸调节电解液的pH值至2。电解过程中每隔1 h取样1 mL溶液,用来做COD和UV测试,并且随时记录电解槽电压的变化。COD采用重铬酸钾标准方法(GB11914—89),总电流效率(GCE)公式如式(1)。
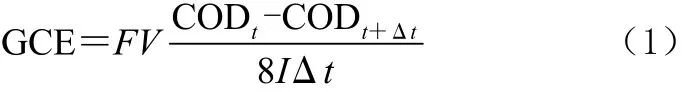
2 结果与讨论
2.1 多孔Ti/BDD电极材料的表征
图1所示为多孔Ti/BDD电极的Raman图。由图1可以看出,位于1333 cm-1处有一峰形很尖锐而且强度很高的峰,这是碳的sp3键的碳原子结构的特征峰,因此属于金刚石的特征拉曼峰,表面在多孔钛衬底上已经形成了明显的金刚石相;而在1510 cm-1处出现的一个较小峰,是碳的sp2键属于石墨的碳原子结构的特征峰。因为石墨的特征峰的拉曼散射效应强度是金刚石的特征峰强度的50倍,说明所制备的金刚石中含有的石墨相非常少,这也同时说明金刚石相较纯并且质量较高。
图2为多孔钛基体上制备的BDD薄膜的SEM图。图2(a)为预处理之后的多孔Ti基体,如图所示多孔钛基体是由较大的钛颗粒组成的。图2(b)是多孔Ti/ BDD电极,可以看出金刚石生长的比较均匀并且完全覆盖了基体,还包括了孔的内部,而且金刚石结晶状况良好,说明已经形成了质量良好的金刚石薄膜。
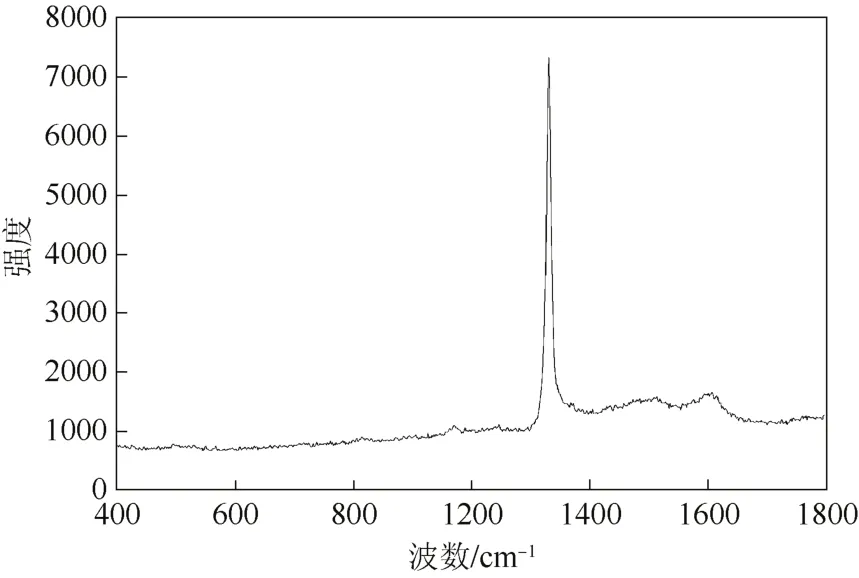
图1 多孔Ti/BDD电极的Raman光谱图

图2 金刚石薄膜电极的SEM图
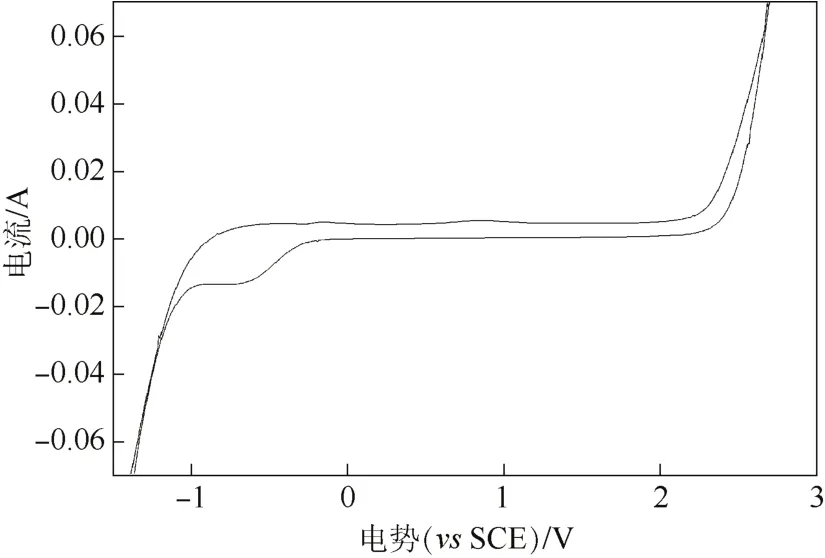
图3 多孔Ti/BDD电极在0.5 mol/L的H2SO4溶液中的循环伏安曲线
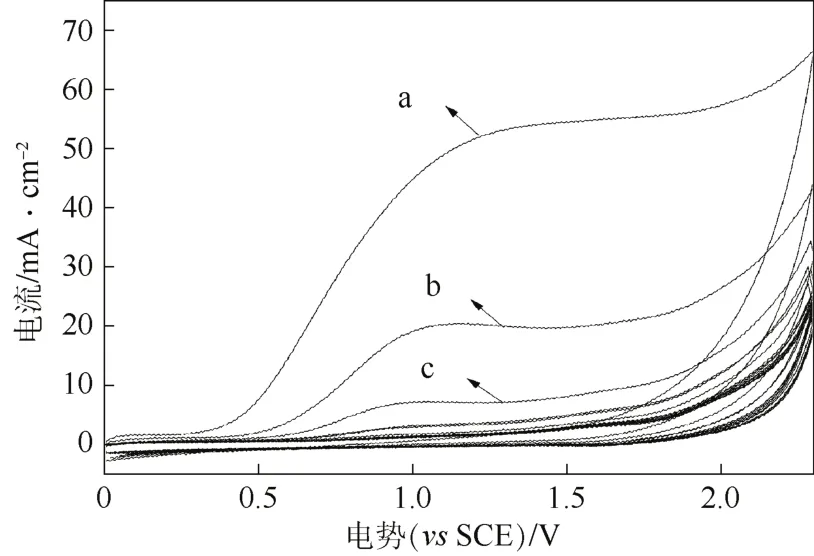
图4 多孔Ti/BDD电极在含有1mmol/L茜素红的0.5 mol/L H2SO4溶液中的循环伏安曲线
2.2 多孔Ti/BDD电极材料的电氧化行为
图3是多孔Ti/BDD电极在0.5M H2SO4溶液的循环伏安曲线,表明了多孔Ti/BDD电极具有较宽的电位窗口和较低的背景电流,析氧电位达到2.2 V(vs.SCE)。电化学势窗口的宽度是电化学性质的一个重要参数,较宽的电势窗口导致副反应电解水析出氧气和氢气变得困难。如果有机物的氧化电位小于电极的析氧电位,可以使茜素红在阳极达到析氧电位前,先被阳极电催化氧化降解,从而获得更高的电流效率。
图4为1 mmol/L茜素红在0.5 mol/L的H2SO4溶液中的循环伏安曲线,扫速为100 mV/s,a﹑b﹑c分别表示扫描的第一、第二和第三圈。由图4中可以看出,茜素红在多孔Ti/BDD电极上的氧化峰在1.2 V左右。不过在0.5 mol/L的H2SO4溶液中,在1.2 V的位置没有明显的氧化峰电流。因此,多孔Ti/BDD电极在茜素红溶液在1.2 V出现的氧化峰电流对应于茜素红的直接电氧化反应。随着扫描次数的不断增加,氧化峰电流逐渐减小,最后消失。氧化峰电流逐渐减小甚至消失的原因可能是由于电流密度很低的情况下生成了聚合物膜覆盖在电极的表面,致使电极钝化,进而阻碍了电氧化降解茜素红反应的进行。但是聚合物膜的组成目前人们还没有检测出来,类似的伏安性质也可以在BDD电极氧化其他芳香族类化合物中观察到[12]。
将电极在0.5 mol/L的H2SO4溶液中极化,调节电流密度为20 mA/cm2,时间为10 min,再进行测试时溶液的氧化峰位置又回到与a曲线相近处,这表明覆盖在电极表面的氧化层被完全氧化了。因此,多孔Ti/BDD电极不仅具有自清洁的特性,而且还有良好的稳定性,不会发生被有机物吸附污染而导致电极失活的现象。从文献[13]得知,多孔Ti/BDD电极在高电流密度下能够去除掉聚合物膜,是由于电极产生了·OH,其具有强氧化性,也同时说明在适当的电流密度下电解茜素红时不会生成聚合物膜覆盖在电极表面。综上所述,多孔Ti/BDD电极电氧化处理茜素红是通过直接及间接的电氧化过程来共同实现的,因此只要通过对电极施加上合适的电流密度,多孔Ti/BDD电极就能以较高的电流效率来对茜素红进行降解。
2.3 降解过程中不同反应条件对茜素红降解的影响
2.3.1 阳极电流密度的影响
图5为在阳极施加不同电流密度降解茜素红的实验结果。由图5可见,在降解过程中,随着阳极的电流密度不断增大,单位时间内溶液的COD(化学需氧量)去除率增大,尤其以20 mA/cm2和40 mA/cm2明显看出之间差别很大,而当增大到60 mA/cm2时溶液的COD去除率就没有太大的变化。通过计算得知,他们的平均电流效率依次为36.4%、30.2%、27.1%,可以看出40 mA·cm2和60 mA/cm2的平均电流效率相差不大。这是因为在电化学氧化降解茜素红的过程中,电流过大会使其受到扩散传质步骤的控制,而且由于阳极电流密度的增大,其表面生成的·OH的速率也同时增加。因此增加电流密度有利于电化学氧化降解茜素红,但同时也增加了析氧和析氢的副反应,导致电流效率的降低。而当调节电流密度较低时,电化学降解茜素红的过程主要是受到电荷传递的步骤影响,此时电流效率较高,但是需要完全降解茜素红时间较长。因此选择的阳极电流密度为40 mA/cm2。
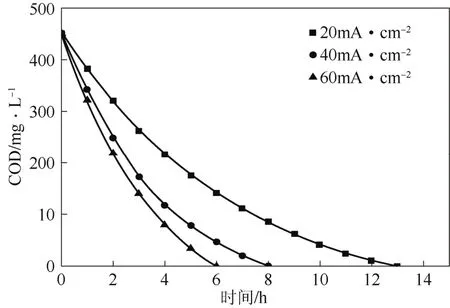
图5 电流密度对多孔Ti/BDD电化学催化降解茜素红的影响
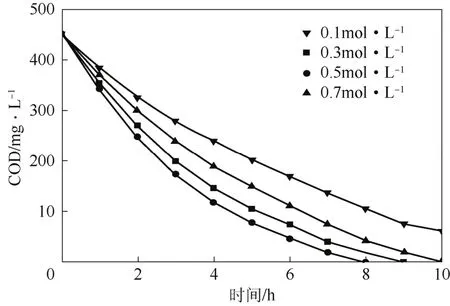
图6 不同支持电解液对多孔Ti/BDD电化学催化降解茜素红的影响
2.3.2 电解液中支持电解质浓度的影响
图6为不同Na2SO4浓度对降解茜素红的影响。由图6可知,在一定的浓度范围内,随着支持电解质浓度的增大,在相同时间内茜素红废水COD去除率先降后升,当Na2SO4浓度为0.7 mol/L时,降解效率反而较0.5 mol/L时有所降低。这是由于电解液中Na2SO4的浓度对电解液的导电能力,电极施加电压以及电能消耗有很大的影响。当Na2SO4浓度较低时茜素红溶液的离子浓度低,因此导电能力较差,电解反应难以进行,而浓度增大时增强了溶液的导电能力,加强了传质过程,使降解茜素红的效率提高;但是当Na2SO4浓度增加到0.7 mol/L后,通过电解液的电流超过了极限电流,导致离子扩散效应由于支持电解质浓度的增大而减小,使得茜素红降解效率降低。所以在多孔Ti/BDD电化学氧化茜素红过程中必须选择合适的Na2SO4浓度,增强茜素红溶液的导电能力、提高传质,从而减小槽压、降低能耗,因此支持电解质Na2SO4的浓度应该选为0.5 mol/L。
2.4 多孔Ti/BDD与平板Ti/BDD电极降解茜素红的比较
根据以上多孔Ti/BDD电极电氧化降解茜素红染料废水工艺条件,将以平板Ti与多孔Ti为基体所制备的电极进行降解茜素红的对比,它们的制备工艺相同。选取阳极电流密度40 mA/cm,支持电解质Na2SO4浓度为0.5 mol/L,电解液初始pH值为2,恒电流电解8 h。图7为多孔Ti/BDD电极与平板Ti/BDD电极对降解茜素红的COD效果图。由图7可知,多孔Ti/BDD电极降解茜素红在8 h时溶液的COD的去除率达到100%,已经降解完全,而平板Ti/BDD电极降解的COD去除率仅达到69.2%。以上分析证明,多孔Ti/BDD电极具有更好的电氧化降解效果,可以在降解有机污染物作为一种新型电极得到广泛应用。
2.5 染料废水降解过程UV分析
为了解更多的茜素红在多孔Ti/BDD电极降解反应的信息,同时对定时取的样品进行紫外光可见光谱分析。如图8所示,茜素红溶液在吸收波长为420 nm和260 nm处都会有峰出现,并且再没有出现其他的吸收峰,在波长为420 nm处的吸收峰为羧基基团的特征吸收峰,而在260 nm处的吸收峰为蒽环或者苯环类有机物的特征吸收峰,并且随着电解时间的增加,吸收峰强度逐渐减弱,表明随着电解的进行茜素红分子上的蒽环、羧基被逐渐破坏达到氧化降解脱色的目的,直至茜素红被完全降解。茜素红降解的主要中间产物为邻苯二甲酸以及小分子羧基化合物等,然后再进一步降解为CO2,这一结果与文献[14]一致。
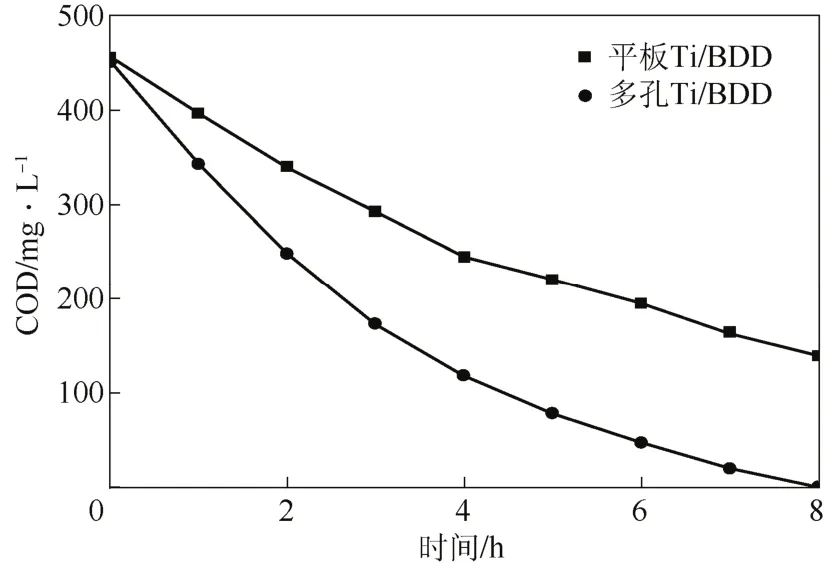
图7 基底对BDD电极电化学催化降解茜素红的影响
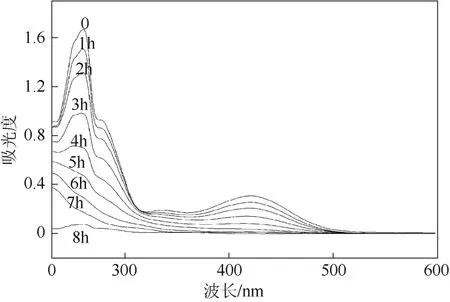
图8 在茜素红降解过程中UV-光谱随电解时间的变化
3 结 论
(1)在多孔钛基底上上成功沉积金刚石薄膜电极,生长在多孔Ti基体的上的薄膜已经完全覆盖了基体,包括孔的内部。
(2)循环伏安测试表明多孔Ti/BDD电极具有较宽的电势窗口和较低的背景电流,并且电极电氧化降解茜素红是通过直接电氧化过程和间接电氧化过程共同实现的,因此能够高效率地电氧化降解茜素红。
(3)在降解过程中电流密度及支持电解液浓度对于茜素红在多孔Ti/BDD电极电氧化降解有重要的影响,并且通过与平板Ti/BDD电极对比,多孔Ti/BDD电极降解茜素红具有更高的效率。
符 号 说 明
F——法拉第常数(96487 C/mol)
I——电流,A
Δt——取样时间差,s
V——电解液体积,L
[1] Chen Xueming,Chen Guohua. Anodic oxidation of Orange Ⅱ on Ti/BDD electrode:Variable effects[J]. Separation and Purification Technology,2006,48(1);45-49.
[2] 王宏洋,管运涛. 臭氧氧化法深度处理印染废水二级出水[J]. 化工环保,2009,29(6):530-533.
[3] Lorimer J P,Platees M,Phull S S,et al. Degradation of dye effluent[J]. Pure Appl. Chem.,2001,73(12):1957-1968.
[4] Zhao Guohua,Li Mingli,Wu Weiwei,et al. Electrocatalytic behavior of diamond electrode for organic pollutant[J]. Environmental Science,2004,25(5):163-167.
[5] Weiss Elsa,Groenen-Serrano Karine,Savall Andre. A comparison of electrochemical degradation of phenol on boron doped diamond and lead dioxide anodes[J]. Journal of Applied Electrochemistry,2008,38(3):329-336.
[6] 高成耀,常明. Ta/BDD 薄膜电极电化学催化氧化硝基酚[J]. 物理化学学报,2008,24(11):1988-1994.
[7] 陈光华,张阳. 金刚石薄膜的制备与应用[M]. 北京:化学工业出版社,2004.
[8] Braga N A,Cairo C A A,Baldan M R,et al. Optimal parameters to produce high quality diamond films on 3D porous titanium substrates[J]. Diamond and Related Materials,2011,20(1):31-35.
[9] Braga N A,Baldan M R,Ferreira N G. From micro to nanocrystalline diamond grown on 3D porous titanium matrix[J]. Journal of Materials Science,2012,47(1);23-40.
[10] Honda K,Rao Tata N,Tryk D A,et al. Impedance characteristics of the nanoporous honeycomb diamond electrodes for electrical double-layer capacitor applications[J]. Journal of the Electrochemical Society,2001,148(7):A668-A678.
[11] 孙见蕊. 钛基掺硼金刚石薄膜电极的制备、性质及其在废水处理中的应用[D]. 长春:吉林大学,2012.
[12] Ahmadi Mohamed Faouzi,Bensalah Nasr,Gadri Abdellatif. Electrochemical degradation of anthraquinone dye Alizarin Red S by anodic oxidation on boron-doped diamond[J]. Dyes and Pigments,2007,73(1):86-89.
[13] Marselli B,Garcia-Gomez J,Michaud P A,et a1. Electrogeneration of hydroxyl radicals on boron-doped diamond electrodes[J]. Journal of the Electrochemical of Soeiety,2003,150(3):D80-D83.
[14] Sun Jianrui,Lu Haiyan,Du Lili,et al. Anodic oxidation of anthraquinone dye Alizarin Red S at Ti/BDD electrodes[J]. Applied Surface Science,2011,257(15):6667-6671.
New porous Ti/BDD film electrode for electrochemical oxidation Alizarin Red at a low concentration
ZHOU Rubin1,RAN Eryan2,SUN Jianrui1,ZHANG Dewen1,ZHANG Baochang1
(1School of Chemistry and Life Science,Changchun University of Technology,Changchun 130022,Jilin,China;2School of Chemical Engineering,Changchun University of Technology,Changchun 130022,Jilin,China)
Boron doped diamond films on porous Ti substrates were prepared by hot-filament chemical vapor deposition (HFCVD) and its main physical behaviors were studied. SEM analysis showed that diamond phase can grow well and distributed on the surface and the hole of the substrate. Ramen spectroscopy showed that the electrode had a pure and high quality diamond phase. The Alizarin Red electrochemical oxidation behavior had been studied with porous Ti/BDD electrode under acidic conditions by cyclic voltammetry. The effects of electrochemical oxidation degradation were investigated by change the anodic current density and the concentration of supporting electrolyte. The results showed that the anodic current density 40 mA/cm2,supporting electrolyte concentration was the ideal technological parameters and the general current efficiency was 30.2%. The results also showed that the porous Ti/BDD film electrode electrochemical oxidation Alizarin Red had a higher current efficiency compared with flat Ti/BDD film electrode in the same condition. The results of UV-visible spectroscopy detection confirmed that Alizarin Red can be degraded efficiently by electrochemical oxidation.
porous Ti;BDD film electrode;Alizarin Red;elcctrochemical oxidation
O 646.51
A
1000-6613(2014)01-0233-06
10.3969/j.issn.1000-6613.2014.01.042
2013-07-05;修改稿日期:2013-08-09。
周如彬(1989—),男,硕士研究生,研究方向为掺硼金刚石的制备与应用。联系人:张德文,副教授,研究方向为无机材料的制备与应用。E-mail zhourubin29@126.com。
