温和条件下水合肼催化分解制氢研究进展
2014-07-05贺雷黄延强王爱琴王晓东张涛
贺雷,黄延强,王爱琴,王晓东,张涛
(中国科学院大连化学物理研究所,辽宁 大连 116023)
温和条件下水合肼催化分解制氢研究进展
贺雷,黄延强,王爱琴,王晓东,张涛
(中国科学院大连化学物理研究所,辽宁 大连 116023)
水合肼(N2H4·H2O)的氢质量分数高达8.0%,完全分解时副产物仅为N2,且在温和条件下物理化学性质较为稳定,因此可以作为一种理想的移动氢源,在一些特殊场合为燃料电池提供氢气。本文概述了温和条件下水合肼分解制氢反应所使用的催化体系,具体包括金属纳米粒子、复合氧化物及负载型催化剂。简要介绍了肼分解过程的机理,并分析了影响水合肼分解制氢选择性的因素,包括催化剂中活性金属的特性、反应条件及助剂的性质对催化剂选择性的影响。总结了现阶段水合肼分解制氢催化剂的优缺点,为进一步开发高效、高选择性的水合肼分解制氢催化剂提供借鉴,并为涉及N—H键及N—N键断裂的其他反应催化剂设计提供参考。
水合肼;制氢;催化剂;选择性
能源短缺、环境污染和全球气候变暖给人类社会的可持续发展带来了前所未有的挑战。优化能源结构和开发利用高效转化技术是解决当前危机的重要途径。氢气具有来源广泛、能量密度高、无毒无害等优点,且燃烧产物仅为水蒸气,没有任何温室气体的产生,因而被认为是最有希望替代化石能源的新型能源,一直以来受到全世界范围的广泛关注[1-4]。特别是随着燃料电池技术的发展,利用氢气作为燃料为移动设备提供动力成为可能[5-7]。但是氢气的运输和储存是尚未攻克的技术难题,成为制约氢能利用的瓶颈,因此开发更加高效、安全的储氢材料仍是全世界科学家努力的方向[8]。根据不同的充放氢方式,储氢材料可大致分为物理储氢材料和化学储氢材料[9]。其中,化学储氢材料的氢含量远远高于物理储氢材料,有希望成为实现高效存储氢气的介质。但是化学储氢材料性质比较稳定,充放氢过程需要跨越相应的能垒,在温和条件下不易实现。利用催化转化的方法能够有效降低化学储氢材料充放氢过程所需的活化能,实现氢气的高效存储。因此,新型催化剂的开发成为实现化学储氢的关键。
在众多的化学储氢材料中,氮氢化合物和硼氢化合物具有氢含量高、副产物少、室温下易于运输等优点,近年来受到广泛的关注[10-11]。肼(N2H4)作为一种重要的氮氢化合物,氢质量分数高达12.5%,完全分解产物为H2和N2,是一种理想的液体氢源[12]。但是肼与金属催化剂接触时易发生爆炸,存在一定的安全隐患。水合肼(N2H4·H2O)为肼的水合物,完全分解产物与肼相同,可释氢质量分数为8.0%,其中的水分子不参与反应,化学性质较为稳定,因而更适合作为液体氢源进行研究。本文将简要介绍肼分解反应并详细综述温和条件下水合肼分解制氢的研究现状。
1 肼分解反应简介
肼,分子式为N2H4,化学性质活泼,响应迅速,在催化剂存在的条件下能够迅速分解[13],产生大量的气体并放出大量的热,实现化学能向动能的转变,因此可以作为小型姿态控制发动机的推进剂,广泛应用于航空航天领域[13-16]。针对这样的应用背景,对催化剂的低温启动活性和高温稳定性提出了很高的要求。在众多的催化体系中,以Shell 405为代表的贵金属Ir基催化剂表现出最好的综合性能[14,17]。但是金属Ir资源稀少、价格昂贵,为了降低催化剂成本,非贵金属催化剂的开发也是科学家们一直努力的方向。大量的研究表明,一些过渡金属的碳化物[18-21]、氮化物[22-24]或磷化物[25-26]能表现出类贵金属的性质,应用于肼分解反应也取得了很好的效果。
具体来看,肼可以按照式(1)、式(2)两种途径进行分解[13]:
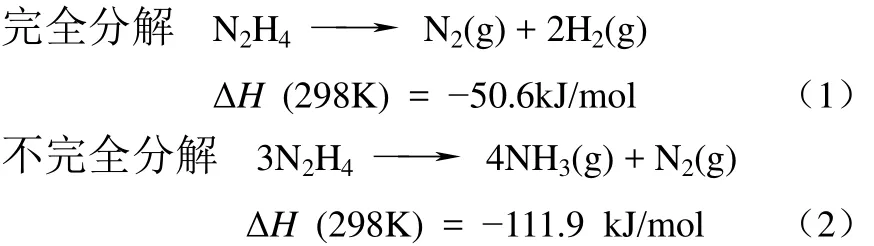
上述两个反应可以同时进行,但在高温条件下生成的中间产物NH3能够进一步分解生成N2和H2,肼也能够与H2反应生成NH3。因此,肼的分解并不是严格按照上述的化学计量式进行,而是受到催化剂种类及反应条件(温度、压力)的影响[13]。Zheng 等[27]系统研究了SiO2负载的金属催化剂在低浓度气相肼分解反应中的性能。其中,Ru、Co、Rh及 Ir金属催化剂均能在低温迅速使肼发生分解,产物主要是N2和NH3;当温度高于350℃后发生氨分解反应,开始有H2的生成。Ni、Pd、Pt催化剂在30~80℃区间内的分解产物主要为N2和H2,升高温度后则以N2和NH3为主。上述结果表明,催化剂中的金属种类以及反应温度的不同都会影响肼分解的最终产物。
2 温和条件下水合肼分解制氢催化剂
无水肼的氢质量分数高达12.5%,远远高于一般的物理储氢材料,而且完全分解后的副产物仅为氮气,无需进一步的回收利用。如果能够在温和条件下实现肼的完全分解,则可以在无需外加能源的条件下快速制备氢气,为燃料电池提供所需的原料,以备不时之需,因此在一些特殊场合具有非常重要的应用价值。但是无水肼(>98%)与金属催化剂接触时反应太过剧烈,易发生爆炸,从而带来安全隐患。
肼的水合物,水合肼(N2H4·H2O),为无色液体,理论氢质量分数为8.0%,仍高于美国能源部(department of energy,DOE)的车载氢源标准(≥5.5%),且化学性质较为稳定,因而更适合作为液体氢源加以利用。水合肼中存在肼分子与水的氢键,使其在温和条件下分解的难度增加;在反应过程中,水的不断积累也会使催化剂的活性不断降低[28-29]。此外,要想实现水合肼在温和条件下的完全分解,需要使得反应完全按照式(1)进行,而阻止式(2)的发生,这对催化剂的选择性也提出了很高的要求。在前人的工作中,大量关于肼分解催化剂的开发更关注的是催化剂的活性和稳定性,而对催化剂的选择性并没有特别强调。一些传统的高活性肼分解催化剂,如Ir/Al2O3,在100℃以下的温度区间更容易促进肼分解生成氨而不是生成氢气[28]。因此,要想在温和条件下同时实现高效、高选择性的水合肼分解制氢气,对催化剂的设计和开发提出了新的挑战。
目前,水合肼分解制氢使用的催化剂可分为金属纳米粒子、复合氧化物及负载型金属催化剂。
2.1 金属纳米粒子
随着纳米技术的发展,对金属纳米粒子已经能够实现可控制备,得到尺寸均一、组分均匀的纳米粒子。部分新型金属纳米粒子能够有效促进水合肼的分解制氢,如表1。
2009年,日本的Xu研究组[30]采用液相还原法制备了一系列金属纳米粒子,并考察了其在室温下对水合肼分解制氢反应的性能。在众多的过渡金属中,Rh纳米粒子表现出最高的水合肼分解制氢选择性(44%),Co、Ru和Ir等金属纳米粒子的H2选择性仅为7%,Fe、Cu、Ni、Pt及Pd等纳米粒子则完全没有肼分解活性。
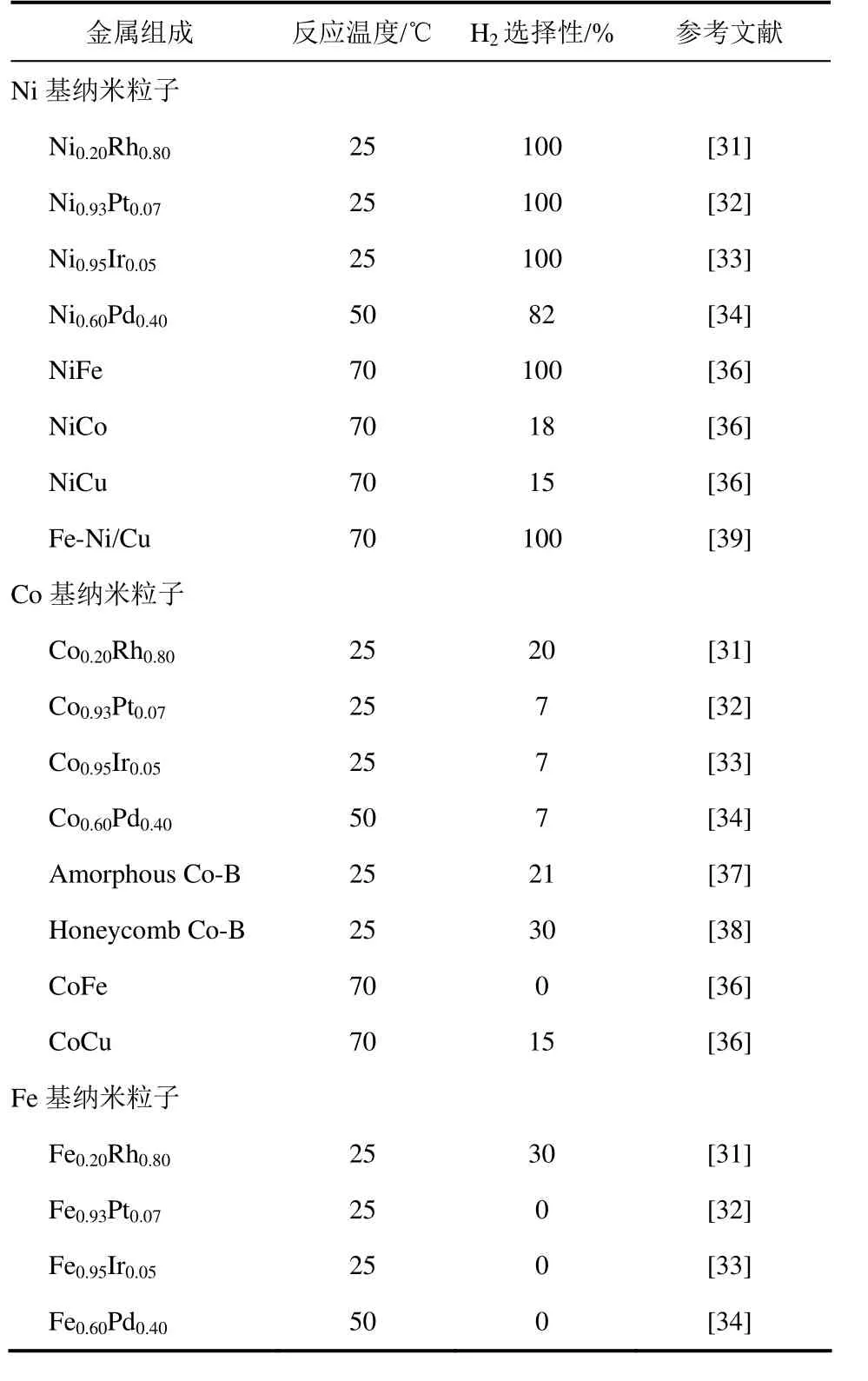
表1 不同纳米粒子在水合肼分解制氢中的催化性能对比
在单金属纳米粒子研究的基础上,他们[31-34]考察了不同双金属纳米粒子在水合肼分解反应中的性能。结果表明,双金属纳米粒子中两种金属的组分、比例以及结构均会对反应的活性和选择性产生很大影响。首先,不同金属对水合肼分解表现出不同的催化性能。例如,与Co基和Fe基的双金属相比,Ni基双金属催化剂(Ni-Rh、Ni-Pt及Ni-Ir)能够得到高达100%的制氢选择性[31-33]。其次,两种金属的比例会影响纳米粒子的选择性。以Ni-Rh双金属纳米粒子为例,当Rh/Ni=4∶1时,水合肼完全分解的制氢选择性可达到100%,而Rh/Ni=1∶4时制氢选择性仅为71%[31]。此外,纳米粒子的结构特征也是影响反应选择性的关键因素,如Ni-Pt合金纳米粒子可以高选择性地促进水合肼分解制氢,而核壳结构的Ni@Pt纳米粒子或简单混合的Ni和Pt纳米粒子则无法得到很高的制氢选择性[32]。Liu等[35]制备了不同形貌的PdIr双金属纳米粒子,发现在室温下,PdIr纳米笼表现出66%的制氢选择性,高于PdIr纳米花29%的选择性,说明纳米粒子的形貌对其催化性能有重要的影响。
虽然上述纳米粒子表现出非常高的制氢选择性,但所使用的Rh、Ir、Pt等金属价格昂贵,因此对于非贵金属纳米粒子的研究受到研究者的普遍关注。Xu小组[36]选择非贵金属Fe、Co、Ni之间组合的双金属纳米粒子进行水合肼分解测试。结果发现,在70℃下并加入适量的NaOH助剂后,NiFe合金纳米粒子表现出高达100%的制氢选择性。Tong 等[37-38]采用液相等离子过程制备了无定形Co-B纳米球以及蜂窝状的纯相Co-B,在室温下分别取得21%和30%的制氢选择性。Manukyan等[39]制备了Fe-Ni/Cu三元纳米粒子,并进行了水合肼分解制氢测试,结果表明该粒子的活性和选择性随反应温度的升高而升高,当温度为70℃时,Fe-Ni/Cu纳米粒子的制氢选择性可达到100%。
金属纳米粒子虽然能够高选择性地分解水合肼制氢,但是在制备以及反应过程中都容易发生团聚,催化活性相对较低。虽然在制备过程中加入表面活性剂可以降低金属的粒径,但是保护剂同样会覆盖金属活性位,而不能从根本上提高催化剂的活性。此外,保护剂的加入使得催化剂的分离更加困难,影响其循环利用。
2.2 复合氧化物
钙钛矿型复合氧化物常用作固体氧化物燃料电池中的阳极材料,Shao等[40]使用溶胶凝胶法(EDTA-柠檬酸共络合)制备了Ba0.5Sr0.5Co0.8Fe0.2O3-δ(BSCF),将其作为液态肼分解的催化剂。研究发现,BSCF在室温具有很好的催化液态纯肼分解活性,但反应产物以NH3为主。随着反应温度的升高,产物生成氢气的选择性有所提高,在60℃时达到10%的制氢选择性。当加入大量的KOH作为助剂时,催化剂的室温制氢选择性显著提高,最高可达到100%,但同时反应速率显著降低。在此基础上,他们开发了La0.2Sr0.8CoO3-δ(LSC2)复合氧化物催化剂[41],在加入强碱作助剂时同样实现了温和条件下的肼分解制氢,并应用在质子膜燃料电池(PEMFC)中,得到了与纯氢气操作条件下相近的结果。
复合氧化物的优点是常作为燃料电池中的电极材料,因而能够更好地与实际应用相结合;缺点是强度不高,在操作之后易发生粉化剥离,影响其使用寿命。此外,水合肼具有一定的还原性,复合氧化物中的金属阳离子在水合肼存在时容易被还原到低价态,因此该材料在反应过程中的稳定性也有待考察。
2.3 负载型金属催化剂
负载型催化剂是最常用的工业催化剂之一,制备过程较为简单,可以通过调节活性组分的负载量、载体的种类及结构、助剂的加入量等因素,调变催化剂的活性和选择性。目前报道的用于水合肼分解制氢的负载型催化剂列于表2。
2.3.1 贵金属催化剂
贵金属催化体系中,Ir/Al2O3在传统肼分解催化剂中表现出最好的综合性能。Cho等[28-29]采用多次浸渍法制备了高负载量的Ir/Al2O3催化剂,并用于水合肼分解制氢反应。研究发现,在室温条件下,反应生成的水会不断降低催化剂的活性,且分解产物以氨为主,只有采用较高的反应温度(200℃)时,该催化剂才能够表现出较高的水合肼分解制氢选择性。在贵金属与第Ⅷ族过渡金属(Fe、Co、Ni)复合双金属体系中,Ni基催化剂表现出最高的低温制氢选择性。张义煌等[54]采用溶胶凝胶法制备了Ni基复合氧化物作为载体,负载活性金属组分(Pt、Rh、Pd)后得到催化剂,能够在常温下催化肼或者水合肼高效分解制取氢气。与Ni基双金属催化剂相比,Co基催化剂的选择性并不高,Song-Ⅱ等[47]使用NaBH4共还原的方法制备了非晶态的PtCo/CeOx催化剂,在室温下仅得到60%的制氢选择性。
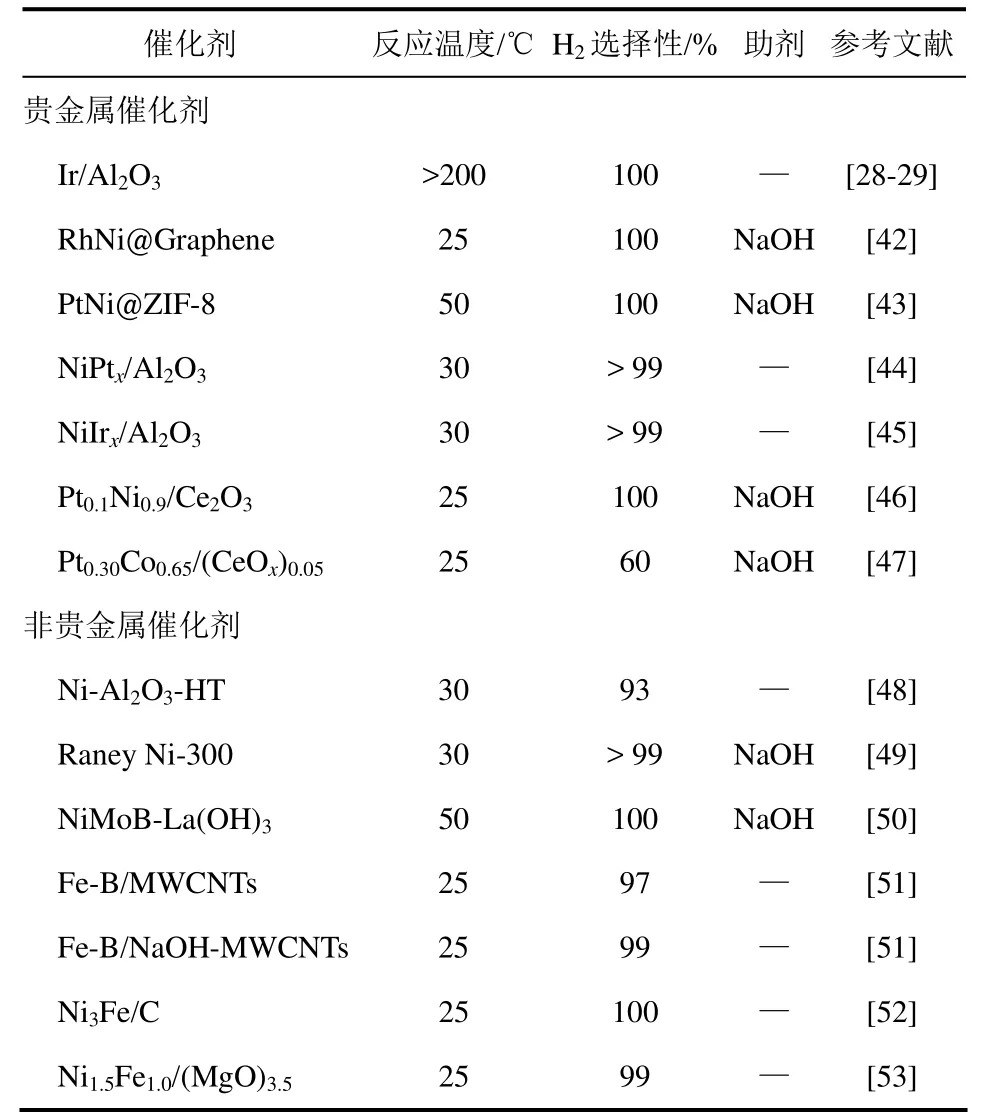
表2 不同负载型催化剂在水合肼分解制氢中的催化性能对比
近年来,随着新型材料的不断发展,负载型催化剂的载体范围也扩展到炭材料、金属有机框架(metal organic framework,MOF)等领域。Wang 等[42]利用石墨烯作为载体制备了RhNi@graphene催化剂,Singh等[43]采用MOF为载体制备了Pt-Ni@MOF双金属催化剂,上述两种催化剂在加入一定量的强碱助剂后,均可以实现低温下的水合肼分解制氢。张涛研究组[44-45]开发了Ni基双金属催化剂,以Ni-Al水滑石前体为载体,分别负载少量Pt和Ir得到NiPtx/Al2O3和NiIrx/Al2O3双金属催化剂。这两种催化剂在30℃下均能够实现水合肼分解制氢,选择性高于99%,且无须另外添加碱金属助剂。Wang等[46]利用NaBH4共还原的方法向Ni-Pt纳米粒子中引入Ce2O3,制备的PtNi/Ce2O3非晶催化剂能够在室温下催化水合肼完全分解制氢。
2.3.2 非贵金属催化剂
虽然贵金属合金催化剂的水合肼制氢选择性很高,但是价格昂贵,因此非贵金属催化体系的开发更符合实际应用的需要。在众多的非贵金属催化剂中,Ni和Fe基催化剂表现出最好的水合肼分解制氢性能。
单独的Ni基催化剂对于水合肼分解制氢选择性较差,但是通过改进制备方法或添加助剂能够有效提高Ni基催化剂的制氢选择性。张涛研究组[48]利用Ni-Al水滑石为前体,经过直接高温还原得到Ni-Al2O3-HT催化剂。该催化剂中Ni的质量分数高达78%,Ni的粒子大小仅有4nm左右,实现了Ni的高度分散。同时,水滑石结构的存在也为还原后的催化剂提供了大量强碱性位,调变了催化剂表面活性金属Ni的性质。该催化剂在30℃的条件下实现了水合肼的完全转化,并得到93%的制氢选择性。随后,他们将商品化的Raney Ni催化剂用于水合肼分解制氢[49],通过加入一定量的NaOH作为助剂,使得催化剂的制氢选择性提高到99%以上。由于Raney Ni催化剂具有良好的磁性,催化剂的分离回收非常容易。Zhang等[50]在NiB中掺入定量的Mo 和La得到NiMoB-La(OH)3催化剂,在50℃时能够实现水合肼完全分解,氢气选择性达到100%。
对于Fe基催化剂来讲,单独的Fe催化剂并不能促进水合肼的室温分解制氢,但是Fe-B粒子表现出较好的催化性能。Tong等[51]制备了单分散的Fe-B纳米粒子,并将其负载于多壁碳纳米管上作为催化剂,实现了室温下水合肼分解,得到97%的制氢选择性。在此基础上,他们利用NaOH对多壁碳纳米管进行处理后负载Fe-B纳米粒子,催化剂的制氢选择性可以提高到99%。
此外,Ni-Fe双金属催化体系表现出非常高的水合肼分解制氢选择性。Tong等[52]在有机溶液中制备了单分散的Ni3Fe合金纳米粒子,并将其负载于炭载体上,得到了室温下100%的制氢选择性。Gao 等[53]利用水滑石前体制备得到了不同比例的NiFe-alloy/(MgO)催化剂并考察了其在水合肼分解反应中的活性,通过调变组分的比例,发现Ni1.5Fe1.0/(MgO)3.5在室温条件下能够实现99%的制氢选择性。
3 制氢选择性的影响因素
前文中提到,肼分解可以通过两种途径进行,包括完全分解和不完全分解。但是肼的分解并不是严格按照化学计量式进行,而是受到催化剂种类及反应条件(温度、压力)的影响[13,54]。不同反应途经包括多步基元反应,涉及N2Hx及NHx等多种中间体,要想准确刻画每一个过程非常困难,因此肼分解机理仍存在很多争议。概括来讲,肼分子中N—N键和N—H键的断裂顺序是影响最终产物分布的关键。而活性金属与肼分子间作用力的强弱不同会改变N—N键及N—H键的断裂顺序,进而影响反应进行的方向,最终影响水合肼分解的选择性。
肼分子中的N—N键断裂所需的键能为286 kJ/mol,N—H键断裂需要360kJ/mol,因此肼在热分解过程中N—N键的断裂更为容易[16]。但是在不同的金属催化剂表面,肼分子中的断键情况则不尽相同。如在Ir/Al2O3催化剂上[55-56],吸附于催化剂表面的N2H4首先发生N—N键断裂,得到吸附于表面的物种。NH2能够继续分解得到吸附态的氮原子和氢原子,但是由于氮原子的复合所需能量很高,在温和条件下难以实现[57]。因此更容易获取一个氢原子生成NH3,使得水合肼分解的最终产物为N2和NH3。
如果肼分子中的N—H键优先断裂,而不发生N—N键断裂,则更有利于直接生成N2和H2。Maurel
等[58]通过同位素标记的手段,考察了15N标记的肼分子在氧化铝负载的金属催化剂上的分解过程,结果表明,在60~300℃的区间范围内,Co、Ni、Cu、Ru、Rh、Pd、Ir及Pt等催化剂上分解后生成的N2均来自同一个肼分子。Block等[59]也通过15N同位素标记的手段研究了Fe/MgO催化剂上肼分解反应,发现催化剂表面并没有形成酰胺、亚酰胺或氮化物的中间体,也表明肼分解在该催化剂上是以N—H键优先断裂的机理发生的。根据以上结果,研究者提出以下机理:肼分子在催化剂上会优先发生N—H键断裂,得到吸附态的N2H3、N2H2、N2H 及H等物种,最终产物中的N2不经过N—N键的断裂,而是通过分子内反应直接脱附形成,来源于同一个肼分子,见图1。
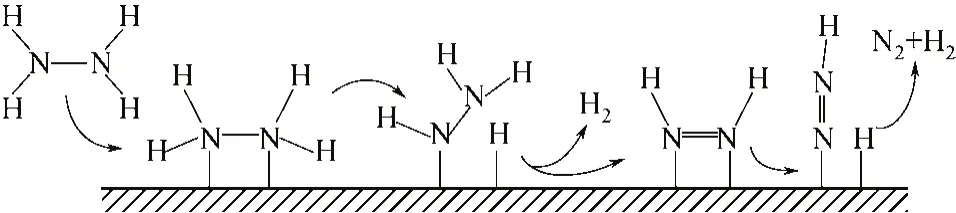
图1 催化剂表面肼分解制氢示意图
除了催化剂中活性金属的种类以及反应条件会对水合肼分解制氢的选择性有影响之外,助剂的添加也能够对催化剂性质进行调变,是提高催化剂制氢选择性的重要方法。在众多的金属催化剂中,Ni基催化剂表现出最高的水合肼分解制氢选择性。但是传统的单金属Ni催化剂制氢选择性仅为60%左右[48],通过添加第二种金属组分能够对Ni的电子性质进行有效调变,是提高水合肼分解制氢选择性的有效手段。例如,与单独的Ni或Fe催化剂相比,双金属Ni-Fe催化剂的制氢选择性有明显的提高[52-53],其主要原因为Ni-Fe合金的协同作用。以水滑石为前体制备的Ni-Pt[44]和Ni-Ir[45]双金属催化剂中,少量贵金属的加入与Ni形成了表面合金,有效调变了Ni的性质,改变了催化剂对N—N键和N—H键的断裂能力,从而将催化剂选择性提高到99%以上。同时由于合金的形成,产物H2和中间物种在催化剂表面的吸附变弱,从而使得Ni催化剂的活性和稳定性有显著的提高。
此外,强碱性助剂在水合肼分解制氢反应中也表现出显著的促进作用。由于水合肼不完全分解的产物为NH3,添加强碱助剂后会使得副反应的活化能升高[49],有效抑制副反应的发生,因此大量文献中报道的水合肼分解反应均需添加适量的强碱性助剂,如NaOH或KOH[40-43,46]。催化剂载体中强碱性位的存在也能够起到提高水合肼分解制氢选择性的作用。例如,利用水滑石前体制备的Ni-Al2O3-HT催化剂中存在大量的强碱性位,NiMoB-La(OH)3催化剂[50]中的La(OH)3及Ni1.5Fe1.0/(MgO)3.5催化剂[53]中的MgO也提供了大量的强碱性位。这些强碱性位的存在也调变了催化剂表面的电子性能,改变了反应进行的方向,从而有效提高了催化剂的制氢选择性。
综上所述,温和条件下水合肼在不同的金属催化剂表面可按照不同的机理进行分解,但N—N键或N—H键的断裂顺序是影响催化剂制氢选择性的关键。通过添加第二种金属或强碱性助剂的方法对催化剂表面性质进行调变,可以有效调控肼分解的反应路径,提高催化剂的制氢选择性。
4 结语与展望
水合肼作为一种液体氢源,受到越来越广泛的关注。在温和条件下,通过催化转化的方式能够实现水合肼的完全分解,快速生产大量的氢气,副产物仅为氮气,因而水合肼能够作为应急氢源发挥独特的作用。目前,能够有效促进水合肼分解制氢的催化剂可分为金属纳米粒子、复合氧化物及负载型催化剂。其中,负载型Ni基催化剂表现出最高的制氢选择性,通过添加第二种金属或添加强碱性助剂的方式,能够进一步提高催化剂在温和条件下的制氢选择性,最高可达到100%。同时,Ni催化剂具有较好的磁性,容易进行分离回收,因而是最有希望实现工业化的催化剂。
尽管负载型Ni基催化剂表现出较高的水合肼分解制氢选择性和活性,但要想真正实现工业化应用还需解决以下两方面的问题:一方面,Ni基催化剂易被氧化而失活,通过添加助剂进一步提高催化剂的抗氧化能力,能够有效延长催化剂的使用寿命;另一方面,水合肼分解是放热反应,现有的催化剂随着反应温度升高其制氢选择性会下降,通过添加第二组分金属等手段对催化剂性能进行调变,可能会进一步拓宽反应的温度区间,使其更具有应用前景。此外,肼分解过程的机理研究仍存在诸多争议,随着实验技术的提高和理论计算的发展,如果对肼分解制氢过程的机理进行更深入的认识,能够对N—N键和N—H键的断裂过程进行更加系统性的描述,那么不仅对于肼分解反应,对于氨分解等其他涉及N—H键和N—N键断裂的反应催化剂设计和研发都具有重要的指导意义。
[1] Blagojević V A,Minić D M,Minić D G. et al. Hydrogen Economy:Modern Concepts,Challenges and Perspectives [M]. New York:Intech.,2012.
[2] Chu S,Majumdar A. Opportunities and challenges for a sustainable energy future[J].Nature,2012,488(7411):294-303.
[3] Mazloomi K,Gomes C. Hydrogen as an energy carrier:Prospects and challenges[J].Renewable and Sustainable Energy Reviews,2012,16 (5):3024-3033.
[4] Wells S A,Sartbaeva A,Kuznetsov V L,et al. Hydrogen Economy:Encyclopedia of Inorganic and Bioinorganic Chemistry[M]. New York:John Wiley & Sons,Ltd.,2011.
[5] Schlapbach L,Zuttel A. Hydrogen-storage materials for mobile applications[J].Nature,2001,414(6861):353-358.
[6] Von Helmolt R,Eberle U. Fuel cell vehicles:Status 2007[J].Journal of Power Sources,2007,165(2):833-843.
[7] Fayaz H,Saidur R,Razali N,et al. An overview of hydrogen as a vehicle fuel[J].Renewable and Sustainable Energy Reviews,2012,16(8):5511-5528.
[8] Züttel A,Hirscher M,Panella B,et al. Hydrogen as a Future Energy Carrier[M]. Hydrogen Storage. Weinheim:Wiley-VCH Verlag GmbH & Co. KGaA.,2008.
[9] Eberle U,Felderhoff M,Schüth F. Chemical and physical solutions for hydrogen storage[J].Angewandte Chemie International Edition,2009,48(36):6608-6630.
[10] Yadav M,Xu Q. Liquid-phase chemical hydrogen storage materials[J].Energy & Environmental Science,2012,5(12):9698-9725.
[11] 王玉晓. 硼氢化钠制氢技术在质子交换膜燃料电池中的研究进展[J]. 化工进展,2009,28(12):2122-2128.
[12] Singh S K,Xu Q. Nanocatalysts for hydrogen generation from hydrazine[J].Catalysis Science & Technology,2013,3(8):1889-1900.
[13] Schmidt E W. Hydrazine and Its Derivatives:Preparation,Properties,Applications[M]. 2nd ed. New York:John Wiley & Sons,2001.
[14] Armstrong W E,Ryland L B,Voge H H. Catalyst comprising Ir or Ir and Ru for hydrazine decomposition:US,4124538[P]. 1978-11-07.
[15] 李令成,蓝蕴基. 肼分解催化剂进展[J] 工业催化,1994(1):3-7.
[16] Batonneau Y,Kappenstein C J,Keim W. Handbook of Heterogeneous Catalysis. Catalytic decomposition of energetic compounds:Gas generators and propulsion[M]. Weinheim:Wiley-VCH Verlag GmbH & Co. KGaA,2008.
[17] Neto T G S,Cobo A J G,Cruz G M. Textural properties evolution of Ir and Ru supported on alumina catalysts during hydrazine decomposition in satellite thruster[J].Applied Catalysis A:General,2003,250(2):331-340.
[18] Chen X,Zhang T,Zheng M,et al. Catalytic decomposition of hydrazine over α-Mo2C/γ-Al2O3Catalysts[J].Industrial & Engineering Chemistry Research,2004,43(19):6040-6047.
[19] Sun J,Zheng M. Y,Wang X D,et al. Catalytic performance of activated carbon supported tungsten carbide for hydrazine decomposition[J].Catalysis Letters,2008,123(1-2):150-155.
[20] Liang C,Ding L,Wang A,et al. Microwave-assisted preparation and hydrazine decomposition properties of nanostructured tungstencarbides on carbon nanotubes[J].Industrial & Engineering Chemistry Research,2009,48(6):3244-3248.
[21] Wang H,Zhang H,Wang A Q,et al. Preparation of metal carbide imbedded ordered mesoporous carbon and its catalytic properties for N2H4decomposition[J].Chinese Journal of Catalysis,2010,31(9):1172-1176.
[22] Chen X,Zhang T,Xia L,et al. Catalytic decomposition of hydrazine over supported molybdenum nitride catalysts in a monopropellant thruster[J].Catalysis Letters,2002,79(1-4):21-25.
[23] Chen X,Zhang T,Zheng M,et al. The reaction route and active site of catalytic decomposition of hydrazine over molybdenum nitride catalyst[J].Journal of Catalysis,2004,224(2):473-478.
[24] 郑明远. 程序升温反应法制备氮化铁及催化肼分解研究[D]. 大连:中国科学院大连化学物理研究所,2005.
[25] Cheng R,Shu Y,Zheng M,et al. Molybdenum phosphide,a new hydrazine decomposition catalyst:Microcalorimetry and FTIR studies[J].Journal of Catalysis,2007,249(2):397-400.
[26] Ding L N,Shu Y Y,Wang A. Q,et al. Preparation and catalytic performances of ternary phosphides NiCoP for hydrazine decomposition[J].Applied Catalysis A:General,2010,385(1-2):232-237.
[27] Zheng M,Cheng R,Chen X,et al. A novel approach for CO-free H productionviacatalytic decomposition of hydrazine[J].International Journal of Hydrogen Energy,2005,30(10):1081-1089.
[28] Cho S,Lee J,Lee Y,et al. Characterization of iridium catalyst for decomposition of hydrazine hydrate for hydrogen generation[J].Catalysis Letters,2006,109(3-4):181-186.
[29] Jang Y B,Kim T H,Sun M H,et al. Preparation of iridium catalyst and its catalytic activity over hydrazine hydrate decomposition for hydrogen production and storage[J].Catalysis Today,2009,146 (1–2):196-201.
[30] Singh S K,Zhang X B,Xu Q. Room-temperature hydrogen generation from hydrous hydrazine for chemical hydrogen storage[J].Journal of the American Chemical Society,2009,131(29):9894-9895.
[31] Singh S K,Xu Q. Complete conversion of hydrous hydrazine to hydrogen at room temperature for chemical hydrogen storage[J].Journal of the American Chemical Society,2009,131(50):18032-18033.
[32] Singh S K,Xu Q. Bimetallic Ni-Pt nanocatalysts for selective decomposition of hydrazine in aqueous solution to hydrogen at room temperature for chemical hydrogen storage[J].Inorganic Chemistry,2010,49(13):6148-6152.
[33] Singh S K,Xu Q A. Bimetallic nickel-iridium nanocatalysts for hydrogen generation by decomposition of hydrous hydrazine[J].Chemical Communications,2010,46(35):6545-6547.
[34] Singh S K,Iizuka Y,Xu Q. Nickel-palladium nanoparticle catalyzed hydrogen generation from hydrous hydrazine for chemical hydrogen storage[J].International Journal of Hydrogen Energy,2011,36(18):11794-11801.
[35] Liu M,Zheng Y,Xie S,et al. Facile synthesis of Pd-Ir bimetallic octapods and nanocages through galvanic replacement andco-reduction,and their use for hydrazine decomposition[J].Physical Chemistry Chemical Physics,2013,15(28):11822-11829.
[36] Singh S K,Singh A K,Aranishi K,et al. Noble-metal-free bimetallic nanoparticle-catalyzed selective hydrogen generation from hydrous hydrazine for chemical hydrogen storage[J].Journal of the American Chemical Society,2011,133(49):19638-19641.
[37] Tong D G,Zeng X L,Chu W,et al. Preparation of monodispersed cobalt–boron spherical nanoparticles and their behavior during the catalytic decomposition of hydrous hydrazine[J].Materials Research Bulletin,2010,45(4):442-447.
[38] Tong D G,Chu W,Wu P,et al. Honeycomb-like Co-B amorphous alloy catalysts assembled by a solution plasma process show enhanced catalytic hydrolysis activity for hydrogen generation[J].RSCAdvances,2012,2(6):2369-2376.
[39] Manukyan K V,Cross A,Rouvimov S,et al. Low temperature decomposition of hydrous hydrazine over FeNi/Cu nanoparticles[J].Applied Catalysis A:General,2014,476:47-53.
[40] Song J,Ran R,Shao Z. Hydrazine as efficient fuel for low-temperature SOFC throughex-situcatalytic decomposition with high selectivity toward hydrogen[J].International Journal of Hydrogen Energy,2010,35(15):7919-7924.
[41] Zhao B,Song J,Ran R,et al. Catalytic decomposition of hydrous hydrazine to hydrogen over oxide catalysts at ambient conditions for PEMFCs[J].International Journal of Hydrogen Energy,2012,37 (1):1133-1139.
[42] Wang J,Zhang X B,Wang Z L,et al. Rhodium-nickel nanoparticles grown on graphene as highly efficient catalyst for complete decomposition of hydrous hydrazine at room temperature for chemical hydrogen storage[J].Energy & Environmental Science,2012,5(5):6885-6888.
[43] Singh A K,Xu Q. Metal-organic framework supported bimetallic Ni-Pt nanoparticles as high-performance catalysts for hydrogen generation from hydrazine in aqueous solution[J].Chem. Cat. Chem.,2013,5(10):3000-3004.
[44] He L,Huang Y,Wang A,et al. Surface modification of Ni/Al2O3with Pt:Highly efficient catalysts for H2generationviaselective decomposition of hydrous hydrazine[J].Journal of Catalysis,2013,298:1-9.
[45] He L,Huang Y,Liu X Y,et al. Structural and catalytic properties of supported Ni–Ir alloy catalysts for H2generationviahydrous hydrazine decomposition[J].Applied Catalysis B:Environmental,2014,147:779-788.
[46] Wang H L,Yan J M,Wang Z L,et al. Highly efficient hydrogen generation from hydrous hydrazine over amorphous Ni0.9Pt0.1/Ce2O3nanocatalyst at room temperature[J].Journal of Materials Chemistry A,2013,1(47):14957-14962.
[47] Song-Il O,Yan J M,Wang H L,et al. High catalytic kinetic performance of amorphous CoPt NPs induced on CeOxfor H2generation from hydrous hydrazine[J].International Journal of Hydrogen Energy,2014,39(8):3755-3761.
[48] He L,Huang Y,Wang A,et al. A noble-metal-free catalyst derived from Ni-Al hydrotalcite for hydrogen generation from N2H4·H2O decomposition[J].Angewandte Chemie International Edition,2012,51(25):6191-6194.
[49] He L,Huang Y,Wang A,et al. H2production by selective decomposition of hydrous hydrazine over Raney Ni catalyst under ambient conditions[J].AIChE Journal,2013,59(11):4297-4302.
[50] Zhang J,Kang Q,Yang Z,et al. A cost-effective NiMoB-La(OH)3catalyst for hydrogen generation from decomposition of alkaline hydrous hydrazine solution[J].Journal of Materials Chemistry A,2013,1(38):11623-11628.
[51] Tong D G,Chu W,Wu P,et al. Mesoporous multiwalled carbon nanotubes as supports for monodispersed iron-boron catalysts:Improved hydrogen generation from hydrous hydrazine decomposition[J].Journal of Materials Chemistry A,2013,1(2):358-366.
[52] Tong D G,Tang D M,Chu W,et al. Monodisperse Ni3Fe single-crystalline nanospheres as a highly efficient catalyst for the complete conversion of hydrous hydrazine to hydrogen at room temperature[J].Journal of Materials Chemistry A,2013,1(21):6425-6432.
[53] Gao W,Li C,Chen H,et al. Supported nickel–iron nanocomposites as a bifunctional catalyst towards hydrogen generation from N2H4·H2O[J].Green Chemistry,2014,16(3):1560.
[54] 张义煌,董辉,田丙伦,等. 一种用于肼分解催化剂制备及应用:中国,1348835A[P]. 2002-05-15.
[55] Zhang P X,Wang Y G,Huang Y Q,et al. Density functional theory investigations on the catalytic mechanisms of hydrazine decompositions on Ir(111)[J].Catalysis Today,2011,165(1):80-88.
[56] Falconer J L,Wise H. Temperature programmed desorption spectroscopy of N2H4decomposition on Al2O3-supported Ir catalyst[J].Journal of Catalysis,1976,43(1-3):220-233.
[57] 倪平,储伟,王立楠,等. 氨催化分解制备无COx的氢气催化剂研究进展[J]. 化工进展,2006,25(7):739-743.
[58] Maurel R,Menezo J C. Catalytic decomposition of15N-labeled hydrazine on alumina-supported metals[J].Journal of Catalysis,1978,51(2):293-295.
[59] Block J,Schulz-Ekloff G. The catalytic decomposition of nitrogen-15-labeled hydrazine on MgO-supported iron[J].Journal of Catalysis,1973,30(2):327-329.
Progress in the catalytic decomposition of hydrous hydrazine for hydrogen production at mild conditions
HE Lei,HUANG Yanqiang,WANG Aiqin,WANG Xiaodong,ZHANG Tao
(Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,Liaoning,China)
:Hydrous hydrazine,N2H4·H2O,could be a promising hydrogen storage material due to its high hydrogen content (8.0wt%) and safe handling at mild conditions,with N2as the only by-product. In this paper,the development of catalytic systems in hydrous hydrazine decomposition for H2production was reviewed,including metallic nanoparticles,complex oxides,and supported catalysts. The mechanism of hydrazine decomposition was briefly introduced. The influencing factors for promoting H2selectivity were discussed,including metal property,reaction conditions,and promoters. Also,the advantages and disadvantages of the reported catalysts were summarized,and performance development in hydrous hydrazine decomposition and other related reactions was also included.
hydrous hydrazine;hydrogen production;catalyst;selectivity
TQ 246
A
1000-6613(2014)11-2956-08
10.3969/j.issn.1000-6613.2014.11.022
2014-04-25;修改稿日期:2014-06-03。
国家自然科学基金(21103173)及大连化学物理研究所洁净能源基础研究专项基金(DICP M201307)项目。
贺雷(1986—),女,博士联系人:黄延强,副研究员。E-mail yqhuang@dicp.ac.cn。
