表达microRNA-203 tough decoy的慢病毒载体构建及应用
2014-07-05王玉亮宋红丽付楠楠吴本娟沈中阳
刘 涛 王玉亮 宋红丽 付楠楠 吴本娟 沈中阳△
细胞与分子生物学
表达microRNA-203 tough decoy的慢病毒载体构建及应用
刘 涛1,2王玉亮1宋红丽2付楠楠3吴本娟3沈中阳2△
目的 建立表达microRNA(miRNA)tough decoy(TuD)的慢病毒载体构建方法,并检测其对细胞内miRNA表达水平及细胞表型的影响。方法在慢病毒表达质粒pSIH1-H1-copGFP中通过两步克隆,首先构建miRNA TuD通用骨架质粒,进一步构建特异性针对大鼠miR-203的TuD表达载体。在293T细胞中包装成慢病毒后,感染大鼠骨髓间充质干细胞(BM-MSCs),同时用pSIH1-H1-copGFP空质粒包装慢病毒,感染BM-MSCs作为对照。定量RT-PCR检测细胞中miR-203的水平变化,并用CCK-8法和Annexin V-PI双标记法分别检测BMMSCs的活性和凋亡。结果成功构建了基于pSIH1-H1-copGFP质粒的miR-203 TuD表达载体,并对其序列进行了验证。用表达miR-203 TuD的重组慢病毒感染BM-MSCs后第3、6、9天检测细胞内源性miR-203表达水平降低,同时细胞活性增高,凋亡比例降低,与对照组相比差异有统计学意义。结论两步克隆法构建miRNA TuD表达载体是一种简便高效的方法,其表达产物能够有效抑制细胞内源性miRNA水平,同时影响细胞表型。
间质干细胞;慢病毒属;遗传载体;质粒;细胞凋亡;微RNAs;细胞活性;miRNA-203 tough decoy
微RNA(microRNA,miRNA)是一类细胞内源性生成的、18~25个核苷酸长度的非编码RNA家族,与其靶基因mRNA的3′非翻译区(3′untranslated region,3′UTR)结合,对靶基因的表达进行转录后水平的负性调控,是重要的细胞内源性基因表达调控因子[1]。在miRNA功能研究中,常需要将细胞内miRNA的水平降低。目前应用较多的方法是针对目的miRNA设计反向互补核苷酸序列,使其靶向结合目的miRNA,阻止miRNA发挥对靶基因的抑制作用。但这些方法对miRNA抑制作用维持的时间较短且不稳定。近年来,一种名为miRNA tough decoy (TuD)[2]的技术较好地解决了这一问题,特别是经Haraguchi等[3]改进后的miRNA TuD分子结构,明显优化了对miRNA的抑制效果。但在实际应用中,由于miRNA TuD分子结构较为复杂,并且大多数识别RNA聚合酶Ⅲ的真核表达载体仅提供2个限制性内切酶位点用于克隆,这使得表达miRNA TuD的质粒载体构建过程较困难。为简化过程,本研究探索了一种基于重组慢病毒载体pSIH1-H1-copGFP的miRNA TuD表达载体构建方式,并用这一方法构建针对大鼠miR-203的miRNA TuD表达载体,并检测miR-203 TuD对miR-203的抑制效果。
1 材料与方法
1.1 材料 寡核苷酸链由北京天润奥科生物科技有限公司合成,所用的寡核苷酸序列见表1。清洁级Wistar大鼠,雌雄不拘,100~120 g,购于解放军军事医学科学院实验动物中心。System Biosciences公司的慢病毒表达质粒pSIH1-H1-copGFP及3种包装质粒pPACKH1-GAG、pPACKH1-REV和pVSV-G由本实验室保存。293T细胞由本实验室保存。胎牛血清(PAA公司),HyClone DMEM及DMEM-F12培养液、T4 DNA连接酶和Taq DNA聚合酶(Thermo公司),限制性内切酶、PrimeScriptII cDNA第一链合成试剂盒及SYBR Premix Ex TaqⅡ荧光定量PCR试剂盒(TaKaRa公司),转染试剂Lipofectamine 2000、Alexa Fluor 488 Annexin V细胞凋亡检测试剂盒(Invitrogen公司),感染增强剂Polybrene(Sigma-aldrich公司),CCK-8细胞活性检测试剂(Dojindo公司)。
1.2 方法
1.2.1 大鼠骨髓间充质干细胞(BM-MSCs)的提取和鉴定 按照本实验室前期建立的方法进行[4]。
1.2.2 pSIH1∕TuD骨架质粒的构建和鉴定 将合成的2条寡核苷酸TuD-Top和TuD-Bottom退火形成双链DNA,克隆插入慢病毒表达载体pSIH1-H1-copGFP的BamHⅠ和EcoRⅠ中。重组质粒用XbaⅠ单酶切,若出现1.75 kb左右的片段,表明重组子正确。重组正确的质粒命名为pSIH1∕TuD。
1.2.3 miR-203 TuD表达质粒pSIH1∕TuD203的构建和鉴定 将2条寡核苷酸TuD203-Top和TuD203-Bottom退火成双链DNA。将pSIH1∕TuD质粒用BamHⅠ单酶切后,与退火形成的双链DNA连接。以重组质粒为模板,FwdH和RvsH(表1)为引物进行PCR,产物进行2%琼脂糖凝胶电泳,若产物为233 bp,则片段连接成功。重组正确的质粒经测序确定后,命名为pSIH1∕TuD203。

Tab.1 Sequence of the oligonucleotides and primers used in this study表1 寡核苷酸及引物序列
1.2.4 表达miR-203 TuD的重组慢病毒包装和感染大鼠BM-MSCs 将pSIH1∕TuD203慢病毒表达质粒及3种包装质粒pPACKH1-GAG、pPACKH1-REV和pVSV-G按摩尔比1∶3∶1∶1的比例用Lipofectamine 2000转染293T细胞,48 h后离心收集细胞上清,即得到表达miR-203 TuD的慢病毒产物。同时用pSIH1-H1-copGFP空质粒与上述3种包装质粒进行慢病毒包装,作对照组。提取Wistar大鼠的BM-MSCs,按照感染复数(multiplicity of infection,MOI)=5的比例感染BMMSCs,分别于感染后第3、6、9天时收集细胞,提取总RNA,检测miR-203 TuD组及对照组中miR-203的表达水平。
1.2.5 BM-MSCs中miR-203表达水平的检测 提取BMMSCs的总RNA,RT-PCR方法检测miRNA水平。(1)分别以203-RT和U6-RT为引物,对RNA进行反转录,合成cDNA第一链。(2)以cDNA为模板,用特异性上游引物203-Fwd或U6-Fwd以及通用下游引物Reverse(表1)分别对目的基因miR-203及内参基因U6 snRNA进行扩增,反应体系按照SYBR Premix Ex TaqⅡ荧光定量PCR试剂盒说明进行,用ABI 7300荧光定量PCR系统进行检测。采用相对定量方法进行miRNA水平分析,miR-203表达水平用2-ΔCt表示,其中ΔCt=CtmiR-203-CtU6。将对照组的miR-203表达水平设为1,计算实验组miR-203的相对表达水平。
1.2.6 BM-MSCs细胞活性检测 在96孔细胞培养板中接种BM-MSCs,并进行慢病毒感染。分别于感染后第3、6、9天时,在相应的孔中加入每孔10 μL的CCK-8细胞活性检测试剂。继续培养2 h后,酶标仪测定各孔在450 nm波长的吸光度(A450)值,以A450的大小评估细胞活性。
1.2.7 BM-MSCs细胞凋亡检测 将慢病毒感染后的BMMSCs消化成细胞悬液,按照Alexa Fluor 488 Annexin V细胞凋亡检测试剂盒说明的步骤,用荧光标记的Annexin V和PI与细胞孵育,流式细胞术检测细胞荧光标记的情况,以Annexin V阳性且PI染色阴性的细胞作为凋亡细胞。
1.3 统计学方法 应用GraphPad Prism 5.0软件进行数据分析和统计图制作。每个时间点的两组间检测指标的比较用Student’s t检验,P<0.05认为差异有统计学意义。
2 结果
2.1 pSIH1∕TuD203重组质粒的鉴定 经电泳鉴定,pSIH1∕TuD203重组质粒的PCR扩增产物大小为233 bp,与预期相符,见图1。进一步DNA测序表明序列完全正确。
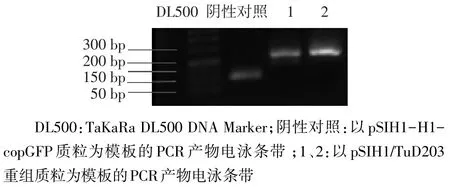
Fig.1 PCR and electrophoresis identification of the pSIH1∕TuD203 plasmid图1 pSIH1∕TuD203质粒的PCR电泳鉴定
2.2 TuD203对BM-MSCs内源性miR-203的抑制作用 miR-203 TuD的慢病毒感染大鼠BM-MSCs后第3、6和9天时,miR-203的表达水平均被明显抑制,与对照组相比差异有统计学意义,见图2。表明该方法构建的miR-203 TuD表达载体能够在感染后较长时间内有效抑制细胞内miR-203的水平。
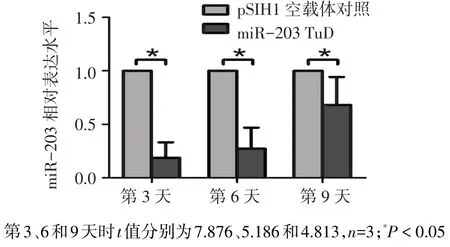
Fig.2 Suppression of miR-203 TuD on endogenous miR-203 of BM-MSCs图2 miR-203 TuD对BM-MSCs内源性miR-203水平的抑制作用
2.3 miR-203 TuD对BM-MSCs生存能力的影响 用表达miR-203 TuD的慢病毒载体感染BMMSCs,感染后第3、6、9天时细胞活性较对照组明显增强,见图3。而在感染后第3天和6天时miR-203 TuD组细胞凋亡水平无显著变化,感染后第9天时,miR-203 TuD组细胞凋亡水平明显降低,见图4。表明miR-203在BM-MSCs中起到抑制细胞活性和促进细胞凋亡的作用,封闭miR-203后,BM-MSCs的生存能力提高。
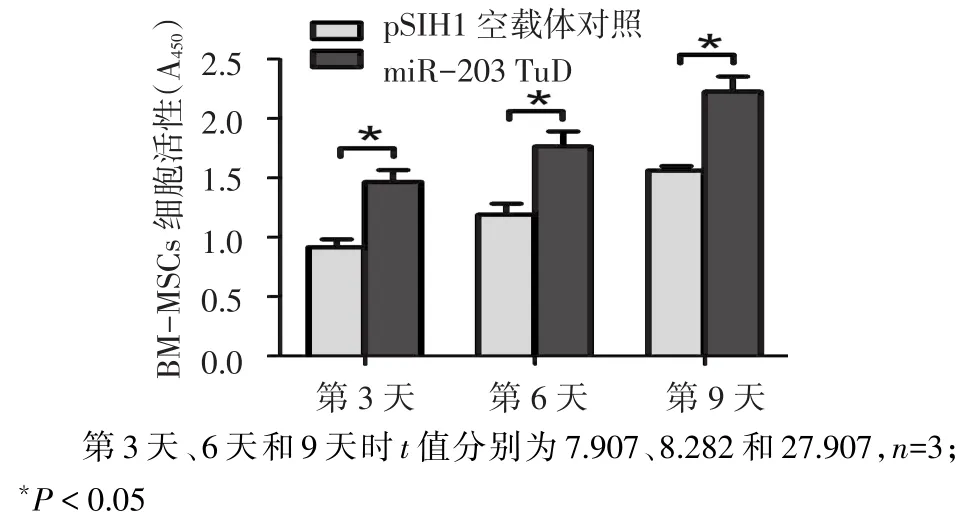
Fig.3 Effect of miR-203 TuD on BM-MSCs viability图3 miR-203 TuD对BM-MSCs细胞活性的影响
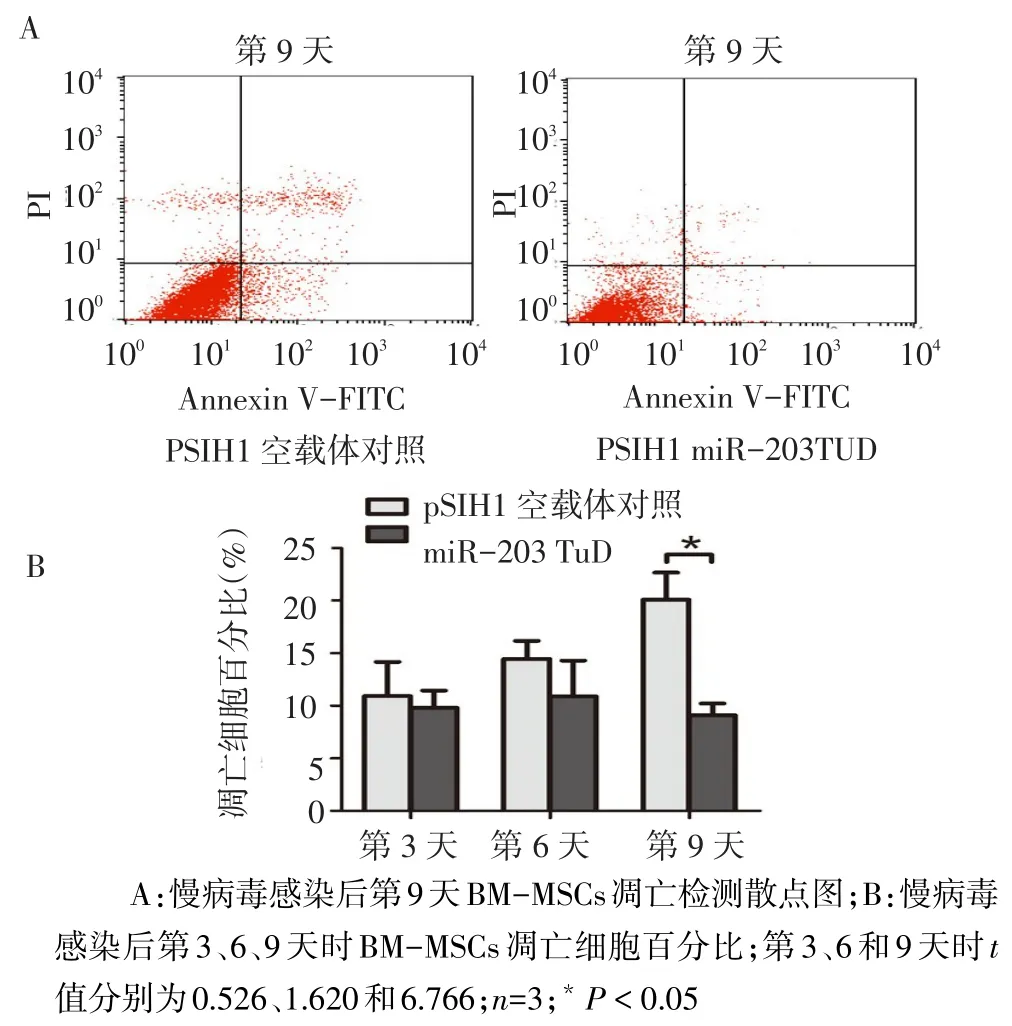
Fig.4 Effect of miR-203 TuD on BM-MSCs apoptosis图4 miR-203 TuD对BM-MSCs细胞凋亡的影响
3 讨论
3.1 miRNA TuD对miR-203水平的抑制 随着miRNA研究的不断深入,对其表达水平的干预方法也在改进,其中Haraguchi等[3]报道了一种具有特定结构的miRNA TuD,能够与目的miRNA特异性结合,在较长时间内对目的miRNA的水平起到稳定的抑制作用。本文按照miRNA TuD的结构,成功构建了大鼠miR-203 TuD表达载体,并包装生成慢病毒,感染大鼠BM-MSCs。由于miRNA TuD与其他miRNA抑制剂如锁核酸(locked nucleic acid,LNA)形式的miRNA反义核酸类似,都是基于反向互补序列与miRNA发生稳定结合的作用机制,这种情况下,miRNA的抑制可被定量RT-PCR方法所检测到[2]。结果显示,基于重组慢病毒的miR-203 TuD表达载体能够对大鼠BM-MSCs的内源性miR-203进行明显和有效的抑制作用。
3.2 miR-203 TuD增强BM-MSCs的生存能力 间充质干细胞(mesenchymal stem cells,MSCs)是来源于中胚层的具有多向分化潜能的成体干细胞[5],以骨髓中含量最多,即BM-MSCs。由于BM-MSCs表达较低的MHCⅠ类分子,不表达MHCⅡ类分子,这使其能够免受免疫系统的杀伤。这些优点使得BMMSCs在多种疾病的治疗方面起到积极的作用[6]。然而,BM-MSCs的缺点主要是其潜在的致瘤风险,包括其本身发生的恶性转化以及诱导其他细胞发生恶变[5-7]。另外,BM-MSCs的生存能力有限,也是影响其发挥疗效的因素之一。移植到病灶部位后,大多数MSCs会在数小时内发生死亡,大大影响了其对损伤组织支持和保护作用的发挥。例如,有研究者观察到,MSCs移植至心肌梗死部位后,其生存能力很低,这导致其对受损心肌细胞的支持和保护作用非常有限[8]。
为克服BM-MSCs的缺点,已有研究应用基因工程的方法,针对其本身特定基因水平进行干预,进而改变细胞的表型,包括增强其生存能力、向损伤部位趋化和定植能力、分化能力,并减低其致瘤风险等[9]。miRNA是广泛参与基因表达调控的小分子RNA,本文以miR-203为研究对象,发现miR-203是一种抑制BM-MSCs生存能力的因子,而应用miR-203 TuD对miR-203的水平进行抑制后,能够显著提高BM-MSCs的活性,减轻其凋亡。这些结果表明,通过抑制细胞内源性miR-203的水平,能够使BMMSCs的生存能力提高,并进一步增强其对受损组织和细胞的支持作用。人类miR-203序列与大鼠miR-203完全同源,对人类miR-203的研究表明,其在多种细胞中都具有抑制细胞生长的活性[10-11]。例如,在横纹肌肉瘤细胞中,miR-203的表达水平由于其启动子的高度甲基化而被抑制,导致细胞的生长抑制作用减轻,促进肿瘤发生[10]。在U251人胶质瘤细胞中,miR-203能够通过靶定磷脂酶D2(phospholipase D2,PLD2)抑制细胞的增殖和侵袭能力[11]。这些事实从另一方面提示,需要防止可能由于miR-203过度抑制而引发的细胞增殖过度和恶性转化。需要注意的是,miR-203被抑制后,细胞活性的增强出现较早且持续发生,而在感染miR-203抑制物后第3和6天时,细胞凋亡程度虽有所减轻,但与对照组细胞相比差异无统计学意义,直到第9天时才能检测到明显的差异,其具体原因有待进一步探索。解决这些问题需要在后续研究中对BM-MSCs中miR-203发挥作用的靶基因进行筛选和验证,以阐明miR-203对BM-MSCs调控作用的具体机制。
[1]Gurtan AM,Sharp PA.The role of miRNAs in regulating gene expression networks[J].J Mol Biol,2013,425(19):3582-3600.doi: 10.1016∕j.jmb.2013.03.007.
[2]Bak RO,Hollensen AK,Primo MN,et al.Potent microRNA suppression by RNA Pol II-transcribed'Tough Decoy'inhibitors[J]. RNA,2013,19(2):280-293.doi:10.1261∕rna.034850.112.
[3]Haraguchi T,Ozaki Y,Iba H.Vectors expressing efficient RNA decoys achieve the long-term suppression of specific microRNA activity in mammalian cells[J].Nucleic Acids Res,2009,37(6):e43. doi:10.1093∕nar∕gkp040.
[4]Liu T,Fu NN,Song HL,et al.Suppression of microRNA-203 improves survival of rat bone marrow mesenchymal stem cells through enhancing PI3K-induced cellular activation[J].IUBMB Life,2014,66(3):220-227.doi:10.1002∕iub.1259.
[5]Wong RS.Mesenchymal stem cells:angels or demons[J]?J Biomed Biotechnol,2011,2011:459510.doi:10.1155∕2011∕459510.
[6]Motaln H,Schichor C,Lah TT.Human mesenchymal stem cells and their use in cell-based therapies[J].Cancer,2010,116(11):2519-2530.doi:10.1002∕cncr.25056.
[7]Mishra PJ,Mishra PJ,Glod JW,et al.Mesenchymal stem cells:flip side of the coin[J].Cancer Res,2009,69(4):1255-1258.doi: 10.1158∕0008-5472.CAN-08-3562.
[8]Toma C,Pittenger MF,Cahill KS,et al.Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart[J].Circulation,2002,105(1):93-98.doi:10.1161∕hc0102.101442.
[9]Hodgkinson CP,Gomez JA,Mirotsou M,et al.Genetic engineering of mesenchymal stem cells and its application in human disease therapy[J].Hum Gene Ther,2010,21(11):1513-1526.doi: 10.1089∕hum.2010.165.
[10]Diao Y,Guo X,Jiang L,et al.miR-203,a tumor suppressor frequently down-regulated by promoter hypermethylation in rhabdomyosarcoma[J].J Biol Chem,2014,289(1):529-539.doi:10.1074∕jbc.M113.494716.
[11]Chen Z,Li D,Cheng Q,et al.MicroRNA-203 inhibits the proliferation and invasion of U251 glioblastoma cells by directly targeting PLD2[J].Mol Med Rep,2014,9(2):503-508.doi:10.3892∕mmr.2013.1814.
(2014-02-23收稿 2014-06-19修回)
(本文编辑 李鹏)
Construction and Application of Lentiviral Vectors Expressing microRNA-203 Tough Decoy
LIU Tao1,2,WANG Yuliang1,SONG Hongli2,FU Nannan3,WU Benjuan3,SHEN Zhongyang2△
1 Key Laboratory for Critical Care Medicine of the Ministry of Health,Tianjin First Center Hospital,Tianjin 300384,China;2 The Organ Transplant Center,Tianjin First Center Hospital;3 The First Center Clinical College,Tianjin Medical University
△
E-mail:shenzy_2014@163.com
ObjectiveTo establish method of constructing lentiviral vectors to express microRNA(miRNA)''tough decoy''(TuD)and to detect the effects of the TuD on cellular endogenous miRNA level and cellular phenotypes.MethodsTwo-step cloning strategy was utilized to first generate a universal miRNA TuD frame vector,followed by constructing the TuD expression vector specially targeting miR-203.The package of the recombinant lentivirus was performed in 293T cells.Then the rat bone marrow mesenchymal stem cells(BM-MSCs)were infected by the miR-203 TuD expression lentivirus.The pSIH1-H1-copGFP vector was also packaged and the BM-MSCs infected by this lentivirus were served as control.Endogenous miR-203 level in BM-MSCs was measured by quantitative RT-PCR,and cellular viability and apoptosis were detected by CCK-8 test and Annexin V-PI staining respectively.ResultsThe miR-203 TuD expression vector was successfully constructed and inserted sequence was validated.At the 3rd,6th and 9th days after infected by the miR-203 TuD expression lentivirus,rat BM-MSCs exhibited a repressed endogenous miR-203 level.The miR-203 TuD also promoted viability and inhibited apoptosis of BM-MSCs.All these differences between miR-203 TuD group and control group were statistically significant.ConclusionThe two-step cloning method for the construction of miRNA TuD expression vector is simple and efficient.The miRNA TuD can effectively suppress the level of the target miRNA and affect cellular phenotypes.
mesenchymal stem cells;lentivirus;genetic vectors;plasmids;apoptosis;microRNAs;cellular viability;miRNA-203 tough decoy
Q78
A
10.3969∕j.issn.0253-9896.2014.10.001
国家自然科学基金资助项目(81270528);中国博士后科学基金资助项目(2013M541185);天津市应用基础与前沿技术研究计划资助项目(08JCYBJC08400、12JCZDJC25200、11JCZDJC27800)
1天津市第一中心医院卫生部危重病急救医学重点实验室(邮编300384),2器官移植中心;3天津医科大学一中心临床学院
△通讯作者 E-mail:shenzy_2014@163.com
