碳族三原子16电子化合物结构的变化规律探讨
2014-07-02许兵
许兵
(同济大学化学系 上海200092)
碳族三原子16电子化合物结构的变化规律探讨
许兵
(同济大学化学系 上海200092)
针对碳族三原子16电子化合物的结构进行计算和讨论,揭示了两种构型之间的相互稳定性,进一步讨论了影响其相互稳定性的原因,并在此基础上提出了相应的教学建议。
大学化学 碳族重原子化合物 杂化轨道理论相对论效应
1953年Walsh提出,一些价层电子总数为16的三原子化合物AB2、BAC都是直线构型,如CO2, N2O等[1]。这些化合物的中心原子A为sp杂化,是形成直线型化合物的最主要原因。之后随着科学的发展,人们逐渐在实验中观察到碳族重原子化合物SiS2
[2]和PbO2[3]的折线结构(三角环状结构)与Walsh规则不相符合。深入的研究还发现,随着碳族原子由轻变重,折线结构也随之更稳定。因此,本文就EX2(E=C,Si,Ge,Sn,Pb;X=O,S,Se,Te)类化合物进行讨论和量化计算,挖掘其中的基本规律和成键原因,并对杂化轨道理论给出一些教学上的建议。
1 结构和能量
CO2的分子结构是直线型(图1A上),其中C原子采取sp杂化,形成两个sp杂化轨道,分别与两个O原子形成σ键。C上未参与杂化的两个p电子则与两个O原子的p电子形成π键,这两个π键互相垂直。量子化学计算表明,除了直线结构的CO2分子,折线结构的CO2分子(图1A下)也是势能面上的一种稳定结构,但由于它的能量比直线型CO2高约144kJ·mol-1,因此几乎不可能观察到这种CO2分子。与此类似,与C处于同一族的另一个重原子氧化物PbO2也有直线型(图1B上)和三角环状(图1B下)两种稳定构型,但与CO2不同的是,三角环状的PbO2分子比直线型的PbO2分子稳定,有将近17.5kJ·mol-1的稳定化能。实验表明,当用激光溅射金属Pb与O2反应,能够形成环状结构的PbO2分子,同时可观察到它的特征红外吸收光谱[3]。
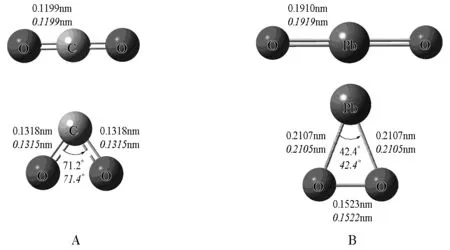
图1 CO2(A)和PbO2(B)的直线结构和折线结构(环状结构)B3LYP/6-311++G(3df,3pd)/SDD,斜体为使用CCSD方法计算。
为了寻找其中的变化规律,我们系统地优化了EX2类型化合物(E=C,Si,Ge,Sn,Pb;X=O,S)的直线结构和折线结构(环状结构)构型,获得了其能量差别和折线结构(环状结构)数据(表1)。对于氧化物,从碳到铅,能量差别分别为144.0、58.4、20.8、1.3和-17.5kJ·mol-1,折线结构的O—E—O夹角则从大变小,依次为71.2°、56.3°、49.7°、44.9°、42.4°,表明重原子形成折线结构的趋势越来越大,当夹角小到一定程度,实际上两个O原子之间已经成键,形成环状结构(PbO2)。而对于硫化物,能量差别由大变小,能量反转的趋势同样存在。从碳到铅,能量差别分别为74.4、20.0、-1.1、-10.6和-24.9 kJ·mol-1,S—E—S夹角不断减小。结果表明,碳族轻原子化合物容易形成直线结构,而重原子化合物则容易形成折线结构(或环状结构)。表1中硫化物与氧化物不同之处主要有两点:一是硫化物中能量反转在GeS2就开始实现,而氧化物要到PbO2才实现;二是对于相同碳族元素,硫化物的X—E—X夹角均大于氧化物的夹角。

表1 折线结构和直线结构的能量差别和折线结构数据
2 成键原因分析
在碳族基态原子中,价层s轨道和p轨道的能量差别分别是191.4kJ·mol-1(C)、167.5kJ·mol-1(Si)、190.8kJ·mol-1(Ge)、168.8kJ·mol-1(Sn)、217.7 kJ·mol-1(Pb)[4]。从能量来看,基态碳原子并不是最容易被激发发生sp杂化,形成直线化合物的原子。更进一步,从碳到锡,能量差别呈现锯齿状变化,与我们前面计算的两种结构能量的单一方向变化趋势不一致。
图2是碳族元素价层s电子和p电子电子密度最大处的半径示意图[4-5]。p电子轨道半径随着主量子数增大而增大,而s电子半径有些反常,Ge元素的4s电子半径比Si的3s半径小,这是由于Ge的3d电子填满,3d电子收缩,屏蔽效应比较小的缘故。Pb原子的6s电子半径反常主要受相对论效应[6-7]影响,由于Pb原子的原子核较重,导致1s电子更加靠近原子核运动,速度接近光速,1s电子收缩,造成了邻近其他s轨道也要有相应的收缩,所以Pb原子6s电子的半径比Sn 5s电子的半径还要小。相反,s轨道收缩,增加了对核的屏蔽效应,而Pb原子p等轨道受相对论效应较小,使p电子有效核电荷减小,和无相对论效应情况对比,p轨道径向分布出现膨胀,能量升高。
从图2可看到,碳原子是比较特殊的,由于它的价层电子s和p轨道电子半径几乎重合,s电子和p电子容易发生杂化,形成sp杂化轨道,因此在两个系列中碳化合物均以直线结构最稳定。随着碳族元素由轻变重,价层s电子和p电子轨道的半径差别越来越大,Si的3s和3p轨道的半径差别为0.039nm, Ge的4s和4p轨道的半径差别为0.048nm,Sn的5s和5p轨道的半径差别为0.057nm,Pb的6s和6p轨道的半径差别为0.079nm,由碳元素到铅元素,s电子和p电子发生杂化的趋势越来越小,它们实际上更容易形成另一种电子结构,即保持s轨道的孤对电子不变,而用两个单独的未成对的p电子成键,形成折线结构化合物。因此,随着碳族原子增大,形成直线结构的趋势越来越小,而形成折线结构的趋势不断增大,此消彼涨到一定程度后,折线结构化合物的稳定性将高于直线结构化合物。
在折线结构中,如果没有外力作用,碳族元素两个成键p电子轨道应互成90°夹角;然而,由于价层s轨道上一对孤对电子和配体X原子上两对p电子的相互挤压排斥,所以到达平衡时这个夹角(θ)小于90°(图3)。对于硫化合物,由于E—S键长较长(与E—O比),上述的相互挤压排斥力比氧化物弱,因此S—E—S夹角要比相应的O—E—O大。进一步推测可得出,对相同的碳族中心原子来说,硫化物比氧化物更容易达到稳定结构,所以我们看到硫化物从GeS2开始,折线结构比直线结构的能量低,而氧化物要到PbO2才能实现稳定的折线结构。
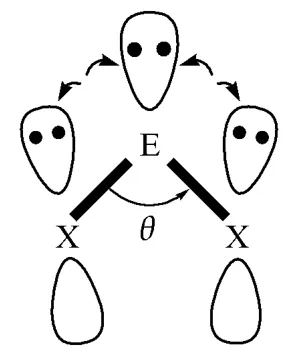
图3 碳族元素s孤对电子和配体p孤对电子相互挤压排斥示意图
3 教学上的建议
南京大学化学系主编的《物理化学词典》[8]对杂化轨道的定义是:分子中属于同一个原子的一组不同类型的原子轨道ψ1,ψ2……ψn与系数组C1,C2……Cn所确定的量Ψ,量Ψ称为原子轨道ψ1,ψ2……ψn的杂化轨道。
Ψ=C1ψ1+C2ψ2+……+Cnψn原子轨道波函数ψ1,ψ2……ψn包括两部分,角度波函数和径向波函数,原子轨道线性组合形成杂化轨道,波函数Ψ不仅体现了每个原子轨道波函数的形状,而且还包含了电子离核距离的信息(上述对三原子16电子化合物的探究正好说明了这个问题)。然而在目前大学化学课堂上普遍采用的无机化学或普通化学教材中,对形成杂化轨道的原子轨道强调较多的是“同一原子中几个能量相近的不同类型的原子轨道”[8]。从前面的分析可知,单纯从能量相近的角度来理解16电子EX2化合物的两种结构有些牵强,但从电子密度最大处轨道半径的相近因素考虑,解释此类碳族三元化合物两种构型的相对稳定性就比较合理。希望藉此能使大学化学的课堂上对杂化轨道理论的讲解更为深入,使教师、学生都能更好地理解和掌握杂化轨道理论,并利用这个理论对相关化合物的结构进行更合理的解释。
4 结语
本文对EX2类化合物进行结构计算和讨论,针对碳族轻原子容易形成直线结构,而碳族重原子容易形成折线结构(环状结构)的特点进行了分析,重点分析形成不同结构的原因。并就此对杂化轨道理论引入了补充性的、希望能在大学化学教学中加以介绍的有关重原子的相对论效应,以引领学生对杂化轨道理论有更加深刻的理解。
[1] Walsh A D.JChem Soc,1953,2266
[2] Leonie A M,Valerio L,Sven T,et al.Angew Chem Int Ed,2012,51(15):3695
[3] Chertihin G V,Andrews L.JChem Phys,1996,105(7):2561
[4] Desclaux JP.At Data Nucl Data Tables,1973,12(4):311
[5] Nagase S,Kobayashi K,Takagi N.Organomet Chem,2000,611(1-2):264
[6] 周公度.大学化学,2005,20(6):50
[7] 冯平义,王岩,廖沐真.化学通报,1998(5):25
[8] 南京大学化学系.物理化学词典.北京:科学出版社,1988
[9] 宋天佑,程鹏,王杏乔.无机化学.北京:高等教育出版社,2004
