四羧基苯基卟啉的NADH 光电化学生物传感器性能研究
2014-07-02王琨琦杨焕欣朱起凡
王琨琦,杨焕欣,朱起凡
(长春工程学院理学院,长春130012)
0 前言
光电化学生物传感器是将能够产生光电化学过程的光电活性材料(用来产生检测信号)与生物识别原件(与电极紧密相连)相结合,以确定待测物含量的一类检测装置。该传感器具有灵敏度高、设备简单、易于微型化等优势,在分析检测和识别生物分子方面展现出了独特的优越性和广阔的应用前景[1-5]。众所周知,自然界生物细胞中有300多种脱氢酶使用辅酶——烟酰胺腺嘌呤二核苷酸(NADH)作为生物催化反应中氢和电子的传递体,因此,NADH在酶参与的生化反应和能量转换方面起着至关重要的作用,而且,目前已有大量NADH电化学生物传感器的研究报道[6-10]。但是,这种电化学生物传感器在分析实际样品的过程中易受到多种因素的干扰,导致电极污染、灵敏度降低、重现性变差以及使用寿命短等问题[11],尝试开发新型NADH生物传感器是科研工作者面临的重要任务。如今,我国南京大学陈洪渊院士研究组较早开始NADH光电化学生物传感器的研究工作[12]。本文以四羧基苯基卟啉(结构如图1)为修饰电极的光敏染料,成功构建NADH光电化学传感器。其原因是激发态TCPP分子存在时间比较长(>1ns),TCPP分子的HOMO能级和LUMO能级与TiO2的导带匹配良好,而且TCPP上带有的羧基更有助于电子从激发态的卟啉转移到TiO2的导带。
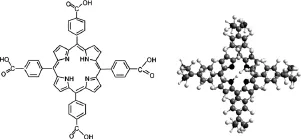
图1 TCPP分子结构示意图
1 实验部分
1.1 仪器与试剂
四羧基苯基卟啉(TCPP)、tris-三羟基-甲基-氨基-甲烷和脱氧胆酸购买于百灵威化学试剂公司。NADH购买于Sigma-Aldrich公司,其他所有试剂均为分析纯。光源紫外灯(型号HQL 125W,深圳市喜万年科技有限公司)。电化学工作站(CHI602A,上海辰华仪器有限公司)。TiO2/FTO电极(长春应用化学研究所王鹏组)Perkin-Elmer Lambda 900分光光度计、FT-IR吸收光谱仪(Shimadzu 4200FT-IR分光仪)。电化学测试采用叁电极体系,TCPP/TiO2/FTO电极为工作电极,铂片为对电极,饱和甘汞电极为参比电极。所有实验均在室温下完成。
1.2 TCPP/TiO2/FTO电极的制备
0.593 mg TCPP溶于5mL乙醇形成溶液。1.963mg脱氧胆酸溶于5mL乙醇形成溶液。将上述2mL TCPP溶液和1mL脱氧胆酸溶液于小烧杯中混合,磁力搅拌10h以上备用(小烧杯避光)。TiO2/FTO电极于500℃下高温炉中灼烧30min,炉中冷却至100℃,取出电极立即放入TCPP和脱氧胆酸的混合溶液中浸泡24h(避光),于是,TCPP/TiO2/FTO工作电极成功制备。
1.3 TCPP/TiO2/FTO电极光电化学氧化 NADH过程
TCPP/TiO2/FTO电极光电化学氧化NADH过程如图2所示。紫外光照射到光敏染料TCPP分子,TCPP分子被激发形成电子-空穴对;电子与空穴不断分离,电子直接注入到二氧化钛导带中,TCPP形成激发态正离子(TCPP*+);TCPP*+接受溶液中NADH的电子被还原成基态TCPP,同时NADH被氧化成(NAD+);这样,TCPP不断被激发,NADH连续提供电子,光电流因此持续产生。

2 TCPP/TiO2/FTO电极光电化学氧化NADH过程
2 结果与讨论
2.1 红外光谱表征
图3是TCPP和TCPP敏化TiO2纳米晶在波数为600~1 800cm-1范围内的红外吸收光谱图。由图3可知:TCPP在717cm-1和799cm-1处有很强的吸收,这是由于苯和吡咯环上C—H的伸缩振动引起;965cm-1处的吸收峰源于吡咯环上C—H弯曲振动引起;C—O的伸缩振动出现在1 225cm-1处,而在1 691cm-1处出现═C O吸收峰(图3中曲线a)。当有染料TCPP吸附在TiO2纳米晶上,═C O吸收峰的强度减小,并在1 639cm-1和1 399cm-1处分别出现羧基不对称振动峰和对称振动峰,(图3中曲线b),而且其羧基伸缩键的劈裂能为240cm-1,表明TCPP的羧基与TiO2纳米晶的连接方式是桥连或螯合作用[13]。

图3 TCPP和TCPP敏化TiO2纳米晶于波数600~1 800cm-1范围内的红外吸收光谱
2.2 TCPP/TiO2/FTO电极对NADH的电化学响应
图4是 TCPP/TiO2/FTO电极对不同含量NADH的循环伏安图。当电解质溶液(0.25Mtris缓冲溶液 &0.1M-1KCl溶液)中不含有NADH时,-0.2V至1.0V电位范围内,没有明显的氧化还原峰(曲线a),而将6μL NADH溶液加入到电解质溶液中后,0.2V处开始有NADH的电化学氧化,于0.75V处NADH氧化电流快速增大,到1.0V出现最明显的氧化峰(曲线b)。表明:NADH的电化学氧化比较缓慢,彻底氧化NADH需要很高的电势,就这一点来讲,安培型NADH电化学生物传感器的应用受到一定限制。
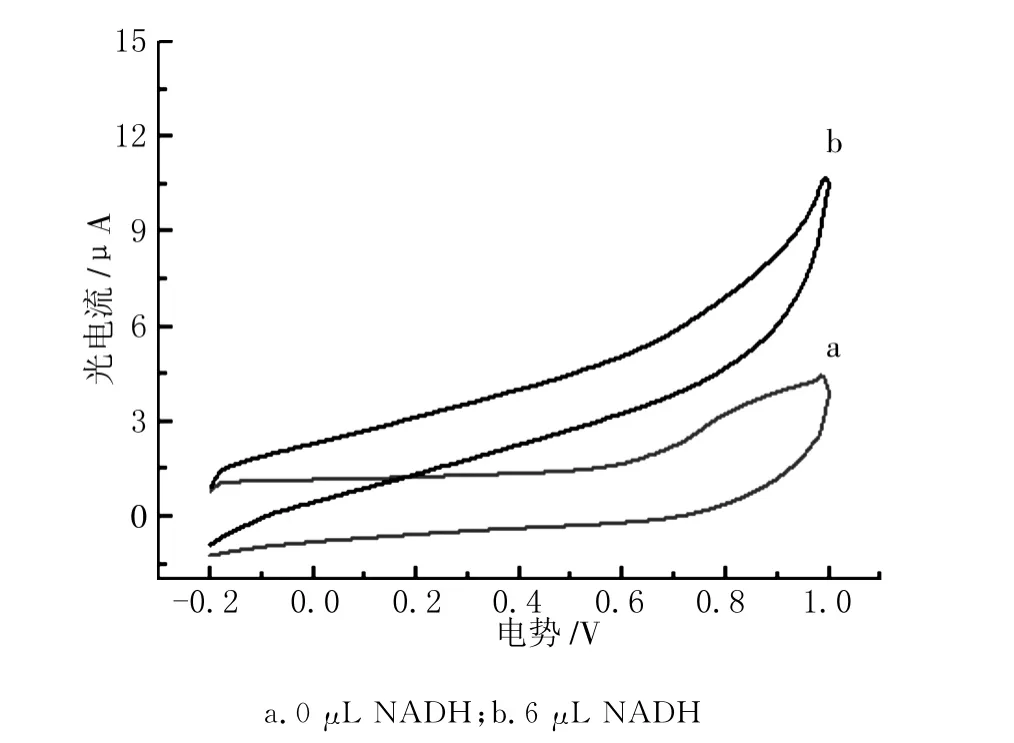
图4 TCPP/TiO2/FTO电极循环伏安图
2.3 TCPP/TiO2/FTO电极的光电化学响应
图5 是 TiO2/FTO 电极和 TCPP/TiO2/FTO电极在380nm光激发下的光电流响应图。由图可知:TCPP/TiO2/FTO 电 极 的 光 电 流 明 显 高 于TiO2/FTO电极,表明激发态的TCPP能将电子注入TiO2导带,从而产生光电流。图6是TCPP/TiO2/FTO电极对不同摩尔浓度NADH的光电响应曲线(电位:0.25V,380nm 光照)。如图所示:随着体系中NADH摩尔浓度的增加(0~8.0μM)光电流明显增大,同时将光电流与NADH的摩尔浓度关系绘制于图7中。由图可知:在0~8.0μM NADH范围内,光电流与NADH摩尔浓度线性相关。(线性相关方程为:y=0.000 106 871+0.000 010 1607x,线性相关性系数为0.958 1),在信噪比为3的条件下,检出限0.359 2μM低于目前报道 NADH 的电化学生物传感器[8,14-15],灵敏度为3.603×10-2μAM-1cm-2。因此,由 TCPP/TiO2/FTO电极构成的光电化学生物传感器能够对NADH进行有效检测,在含6μL NADH tris缓冲溶液中,进行TCPP/TiO2/FTO电极光电流响应重现性检测,其相对标准偏差为5%,表明上述电极有较好的重现性。
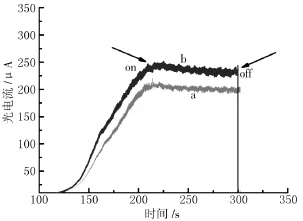
图5 TiO2/FTO电极(a)与TCPP/TiO2/FTO电极(b)的光电流响应

图6 TCPP/TiO2/FTO电极对不同摩尔浓度NADH的光电响应—时间曲线,从下至上NADH的摩尔浓度依次为0、1.6、3.2、4.8、6.4、8.0μM

图7 TCPP/TiO2/FTO电极对不同含量NADH的线性关系曲线
3 结语
利用光敏染料TCPP与TiO2纳米晶间的强烈相互作用,成功制备了有光电化学响应的修饰电极TCPP/TiO2/FTO,利用该电极获得了低检出限的NADH光电化学生物传感器,该研究为光电化学生物传感器电极的构建提供了新参考。
[1]Zhang X R,Guo Y S,Liu M S,etc.Photoelectro chemically active species and photoelectrochemical biosensors[J].Rsc Adv,2013,3(9):2846-2857.
[2]Li H X,Hao W L,Hu J C,etc.A photoelectrochemical sensor based on nickel hydroxyl-oxide modified n-silicon electrode for hydrogen peroxide detection in an alkaline solution[J].Biosens Bioelectron,2013,47:225-230.
[3]Zhang X R,Xu Y P,Zhao Y Q,etc.A new photoelectrochemical biosensors based on DNA conformational changes and isothermal circular strand-displacement polymerization reaction[J].Biosens Bioelectron,2013,39(1):338-341.
[4]Guan H N,Chi D F,Yu J.Photoelectrochemical acetylcholinesterase biosensor incorporating zinc oxide nanoparticles[J].Environmental Biotechnology and Materials Engineering Pts 1-3,2011,183-185:1701-1706.
[5]Li H B,Li J,Yang Z J,etc.A novel photoelectrochemical sensor for the organophosphorus pesticide dichlofenthion based on nanometer-sized titania coupled with a screenprinted electrode[J].Anal Chem,2011,83 (13):5290-5295.
[6]Arvinte A,Valentini F,Radoi A,etc.The NADH electrochemical detection performed at carbon nanofibers modified glassy carbon electrode[J].Electroanal,2007,19(14):1455-1459.
[7]Li Z,Huang Y,Chen L,etc.Amperometric biosensor for NADH and ethanol based on electroreduced graphene oxide-polythionine nanocomposite film[J].Sensor Actuat B-Chem,2013,181:280-287.
[8]Liu Y,Zhang H L,Lai G S,etc.Amperometric NADH Biosensor Based on Magnetic Chitosan Microspheres/Poly(thionine)Modified Glassy Carbon Electrode[J].Electroanal,2010,22(15):1725-1732.
[9]Gurban A M,Noguer T,Bala C,etc.Improvement of NADH detection using prussian blue modified screenprinted electrodes and different strategies of immobilisation[J].Sensor Actuat B-Chem,2008,128 (2):536-544.
[10]杜攀,石彦茂,吴萍,等.1,2—萘醌修饰的碳纳米管对β-烟酰胺腺嘌呤二核苷酸电化学氧化的催化作用[J].分析化学,2006,34(12):1688-1692.
[11]Jaegfeldt H.Adsorption and electrochemical oxidation behavior of nadh at a clean platinum-electrode[J].J Electroanal Chem,1980,110(1/3):295-302.
[12]Wang G L,Xu J J,Chen H Y.Dopamine sensitized nanoporous TiO2film on electrodes:Photoelectrochemical sensing of NADH under visible irradiation[J].Biosens Bioelectron,2009,24 (8):2494-2498.
[13]Wang K Q,Yang J,Feng L G,etc.Photoelectrochemical biofuel cell using porphyrin-sensitized nanocrystalline titanium dioxide mesoporous film as photoanode[J].Biosens Bioelectron,2012,32(1):177-182.
[14]Huang M,Jiang H,Zhai J,etc.A simple route to incorporate redox mediator into carbon nanotubes/Nafion composite film and its application to determine NADH at low potential[J].Talanta,2007,74(1):132-139.
[15]Lawrence N S,Wang J.Chemical adsorption of phenothiazine dyes onto carbon nanotubes:Toward the low potential detection of NADH [J].Electrochem Commun,2006,8 (1):71-76.
