龙眼体胚发生过程中tRNA怀丁苷合成蛋白基因(Dltyw1)的克隆及表达分析
2014-07-01林玉玲赖钟雄
叶 炜, 林玉玲, 赖钟雄
(1.福建农林大学园艺植物生物工程研究所,福建 福州 350002;2.福建省三明市农业科学研究院,福建 三明 365509)
龙眼体胚发生过程中tRNA怀丁苷合成蛋白基因(Dltyw1)的克隆及表达分析
叶 炜1,2, 林玉玲1, 赖钟雄1
(1.福建农林大学园艺植物生物工程研究所,福建 福州 350002;2.福建省三明市农业科学研究院,福建 三明 365509)
根据龙眼胚性愈伤组织转录组数据库信息,进行龙眼胚性愈伤组织tRNA怀丁苷合成蛋白基因(Dltyw1)cDNA全长克隆及其在体胚发生过程中的定量表达分析.结果表明:Dltyw1基因全长2273 bp,包含1920 bp ORF,编码640个氨基酸,将此基因登录GenBank,登录号为JF733783;Dltyw1含有flavodoxin 1、Radical SAM及Wyosine form功能域,进化树分析显示,Dltyw1与其他物种twy1基因具有较高同源性.荧光定量PCR技术分析表明,Dltyw1基因在龙眼体细胞心形胚时期呈现表达高峰,并在子叶形胚阶段迅速下降至最低点,由于心形胚是体细胞胚胎发生由球形胚向各组织器官发育的关键阶段,表明twy1基因在体胚发生过程中的组织器官发育及形态建成阶段的转录后调控方面起重要作用.
龙眼; 体细胞胚胎发生; tRNA怀丁苷合成蛋白基因; 克隆; qPCR
RNA的转录后修饰在基因、酶、物质及能量之间的转换起重要作用[1,2].在已发现的100多种RNA修饰中,tRNA的修饰占75种[3].tRNA在mRNA的引导下参与蛋白合成,tRNA的修饰对密码子识别的正确性有重要作用[4],tRNA修饰的缺失将导致一系列蛋白翻译的错误码及生理缺陷的产生[1-3,5].
tRNA怀丁苷合成蛋白(tRNA-wybutosine synthesizing enzyme, twy)参与怀丁苷合成[6].怀丁苷(wybutosine, yW),是一种三环大分子化合物,参与tRNA G37不稳定位点(wobble site)的修饰,在密码子—反义密码子的识别、翻译框的稳定性方面起重要作用[6].虽然yW早在1973年就被发现[7,8],但其合成的途径直到近年才为人所知[9,10].yW的生物合成是多酶过程,位于tRNAPheG37位点的鸟嘌呤先在tRNA甲基酶(tRNA methyltransferase, TRM5)的作用下形成m1G[11],进而在twy1的作用下形成三环结构,最后在twy2-4蛋白复合体的作用下,合成yW[6,9,12,13].twy1基因含有[Fe-S]簇结合位点GGE基序,位于S-腺苷甲硫氨酸Radical SAM(S-adenosyl-L-methionine)功能域内, Radical SAM功能域的缺失及GGE点突变均能造成tRNA的巯基化修饰受到抑制[14],而这种维持巯基化修饰在植物的胚胎发生过程中起重要作用,在拟南芥(Arabidopsisthaliana)中,AE7与CIA1、NAR1及MET18构成复合体参与胞质与核[Fe-S]簇的合成,ae7突变株可使的含[4Fe-4S]的顺头乌酸酶(aconitases, ACOse)及含[2Fe-2S]的乙醛氧化酶(aldehyde oxidases, AOs)活性降低,并导致胚胎败育或者产生大量的基因变异[15].
龙眼(DimocarpuslonganLour.)的体胚发生(somatic embryogenesis, SE)有着与合子胚发生类似的过程[16],由于龙眼胚性愈伤组织(embryogenic callus, EC)体胚发生可以通过生长调节剂实现同步化调控,快速获得大量均一的不同胚胎发育阶段的材料,龙眼的EC系统是用于研究木本植物胚胎发育模式的良好材料[17].此前,在龙眼EC转录组研究中,亦发现twy1基因的大量表达[18].本试验通过cDNA末端快速克隆(rapid-amplification of cDNA ends, RACE)克隆龙眼tRNA怀丁苷合成蛋白基因(Dltwy1)并进行相应生物信息学分析,利用荧光定量PCR(quantitative Realtime-PCR, qPCR)分析此基因在龙眼SE过程中不同阶段的表达规律,为揭示龙眼tyw1基因及tRNA修饰在胚胎发育中的生理功能提供依据.
1 材料与方法
1.1 材料
“红核子”龙眼体细胞胚性愈伤组织(somatic embryogenic callus, SEC)长期继代于MS+1.0 mg·L-12,4-D培养基[16],取继代培养约18 d的松散愈伤组织用于Dltyw1基因RACE克隆.根据本实验室的研究方法[17]进行龙眼体胚同步化调控,所获9个阶段SE材料,分别为EC:松散型胚性愈伤组织;ECⅡ:胚性愈伤组织Ⅱ;ICpEC:不完全胚性紧实结构;CpECGE:胚性紧实球形结构;GE:球形胚;HE:心形胚;TE:鱼雷形胚;CE:子叶形胚;ME:成熟胚.
1.2 方法
1.2.1 总RNA提取与cDNA合成 利用TrizolTM试剂盒(Ivitrogen)提取龙眼SEC和SE不同发生阶段材料总RNA.利用Gene RacerTM(RLM-RACE) kit (Invitrogen)合成龙眼SEC 5′及3′ RACE cDNA,用于DLtwy1基因cDNA全长克隆.利用RevertAidTMFirst-Strand Synthesis System (Fermantas)试剂盒合成龙眼SE不同发生阶段cDNA,用于qPCR分析.
1.2.2DLtwy1基因cDNA全长克隆及分析 根据龙眼SEC转录组数据库[18]Unigene59767序列,设计3′ RACE引物Dltyw1 F1:5′-CAAGAGAAACAGCAGCGAACTG-3′,Dltyw1 F2:5′-TTGA TGGTCAATGGTTCACATGG-3′;5′ RACE引物:Dltyw1 R1:5′-AGTCTCTCGC CACGGCATTGAA-3′;Dltyw1 R2:5′-TTTCGTTGGGCAGGTCTTCGG-3′.根据Gene RacerTM(RLM-RACE) kit所附说明进行RACE-PCR扩增.所获PCR产物经TA克隆,导入pGEM-T质粒,转化感受态大肠杆菌DH-5α,PCR检测阳性菌株送华大基因测序,拼接全长,并设计ORF引物Dltyw1 ORF F:5′-ATGTCGTCGTCGTTACGTGCTC-3′,Dltyw1 ORF R:5′-TCACTCCTTTGATTTGTGATG-3′,验证ORF全长.利用DNAMAN 6.0推导Dltyw1-like蛋白序列,使用MEGA 5.0构建Bootstrap N-J进化树,Bootstrap replication设为500,以Bootstrap>50%对进化树进行修正.利用pfam在线分析保守功能域(http://pfam.sanger.ac.uk/).利用PSORT(http://psort.hgc.jp/)进行信号肽及亚细胞定位的预测.
1.2.3 荧光定量PCR分析 以eIF4A及EF-1A基因为内参,以稀释5倍的cDNA为模板,采用SYBR Premix Ex TaqTM(TaKaRa)荧光染料,参照Lin et al[19],以20 μL反应体系于Roche Lighcycler 480荧光定量PCR仪进行相对定量分析(表1).qPCR反应程序:95 ℃,5 min;95 ℃,10 s;60 ℃,10 s;设40个循环.溶解曲线分析扩增产物特异性.
2 结果与分析
2.1Dltyw1基因cDNA全长克隆
龙眼EC转录组中所获Unigene 59767片段长为561 bp(48.07 RPTK),为龙眼SE过程中表达较活跃的基因之一[18].NCBI Blast对比分析表明,Unigene59767核酸序列与葡萄(Vitisvinifera)twy1基因(XM_004291831)一致性为87%.为分析龙眼Dltyw1基因的结构与功能,对Dltyw1(Unigene59767)基因进行全长克隆.以龙眼SEC cDNA为模板,一对3′ RACE特异引物获得约300 bp 特异性条带,一对5′ RACE特异引物获得约1400 bp特异性条带,片段大小与预期条带一致,测序结果表明,所获序列与转录组序列Unigene59767有重叠片段,经Blast比对分析,显示所获序列与其他物种twy1基因具有同源性, 显示所获片段为目标片段.将所获序列进行拼接,获得Dltyw1全长2273 bp(图1),含33个“A”形成的poly A 3′未端,DNAMAN 6.0 ORF搜索显示在69-1991 bp位点具有一个连续的ORF,编码640个氨基酸(图2).以一对相应ORF引物PCR验证,得到约1900 bp特异性条带,经测序显示与所预测ORF序列一致,于NBCI Blast比对分析显示与其他物种twy1基因具有同源性,表明所获序列为龙眼twy1基因,将该基因命名为Dltyw1,登录GenBank,登录号为JF733783.

表1 荧光定量PCR引物Table 1 Primers for qPCR
2.2Dltyw1基因的进化树分析 保守功能域分析
为了解龙眼Dltyw1基因与其他物种twy1基因序列差异,本试验将Dltyw1基因推导蛋白序列Blastp得到的16条twy1氨基酸序列导入MEGA 5.0构建进化树(见图2).由图2可知,twy1在多物种中分布,保守性较高,相互差异随着物种间亲缘关系的远近而变化.17条twy1氨基酸序列在遗传距离约为0.13处可分为单、双子叶两个类群,龙眼Dltyw1与可可(Theobromacaocao)、毛果杨(Populustrichosrpa)、蓖麻(Ricinuscommunis)、葡萄(Vitisvinifera)及大豆(Glycinmax)等双子叶植物tyw1聚为一类;高粱(Sorghumbicolor)与大麦(Hordeumvulgare)单子叶植物tyw1聚为一类.
2.3 Dltyw1亚细胞定位预测及保守功能域分析
将龙眼Dltyw1基因推导氨基酸序列导入PSORT进行亚细胞定位预测.结果表明,该蛋白具有长度为16个氨基酸的信号肽,可能定位于内质网膜(55.0%)、过氧化酶物体(27.9%)、溶酶体(19.0%)及内质网腔(10.0%),这与预期的tRNA修饰功能[6]相应位置一致.将Dltyw1基因推导氨基酸序列导入pfam进行保守功能域分析,表明其在50-191位点含有Flavodoxin 1功能域(PF00258,E=2.7e-28);在324-506位点含有Radical SAM功能域(PF04055,E=1.7e-26);在508-572含有1个Wyosine_form功能域(PF08608,E=1.7e-26).其中,Dltyw1基因的Radical SAM功能域含有[CxxxCxxC]的[Fe-S]簇结合位点,被发现参与甲基化、异构化、硫化、环状的形成、厌氧呼吸以及蛋白基团的形成等一系列重要的生化过程[20],此功能域在各物种间呈现高度的一致性.物种间氨基酸序列的差异主要存在于Flavodoxin 1功能域,此功能域含有1个[Fe-S]簇结合位点,并以FMN(黄素单核苷酸)作为辅助因子,参与多种生理过程.
2.4Dltwy1在龙眼SE过程中表达的qPCR分析
为了解Dltyw1基因在龙眼SE过程中的表达情况,进行了Dltyw1基因在龙眼SE 9个发生阶段中的qPCR分析(图3).Dltyw1基因龙眼SE表达可显著地分为2个阶段,第1个阶段的Dltyw1基因呈现相对稳定低水平表达,发生在胚胎发生的初始阶段,即从松散型胚性愈伤组织(EC)期至胚性愈伤组织II(ECⅡ)期,在球形胚(GE)期前,Dltyw1基因还表现明显下调;第2个阶段为GE至子叶形胚(CE)期,Dltyw1基因表达呈现明显上调而后下降的过程,在从GE至心形胚(HE)转变过程中,Dltyw1基因表达上调幅度为GE期的7.30倍,而后,Dltyw1基因表达量呈显著性下调,至CE期,Dltyw1基因表达量降至SE 9个发生阶段的最低点,HE期到CE期的降幅达13.5倍,并保持低表达量至成熟胚(ME),暗示Dltyw1基因可能在龙眼SE的前期与SE的HE阶段有密切的联系.

图1 龙眼Dltyw1基因核苷酸序列及其推导氨基酸序列Fig.1 Longan Dltyw1 gene nucleotide sequence deduced amino-acid sequence
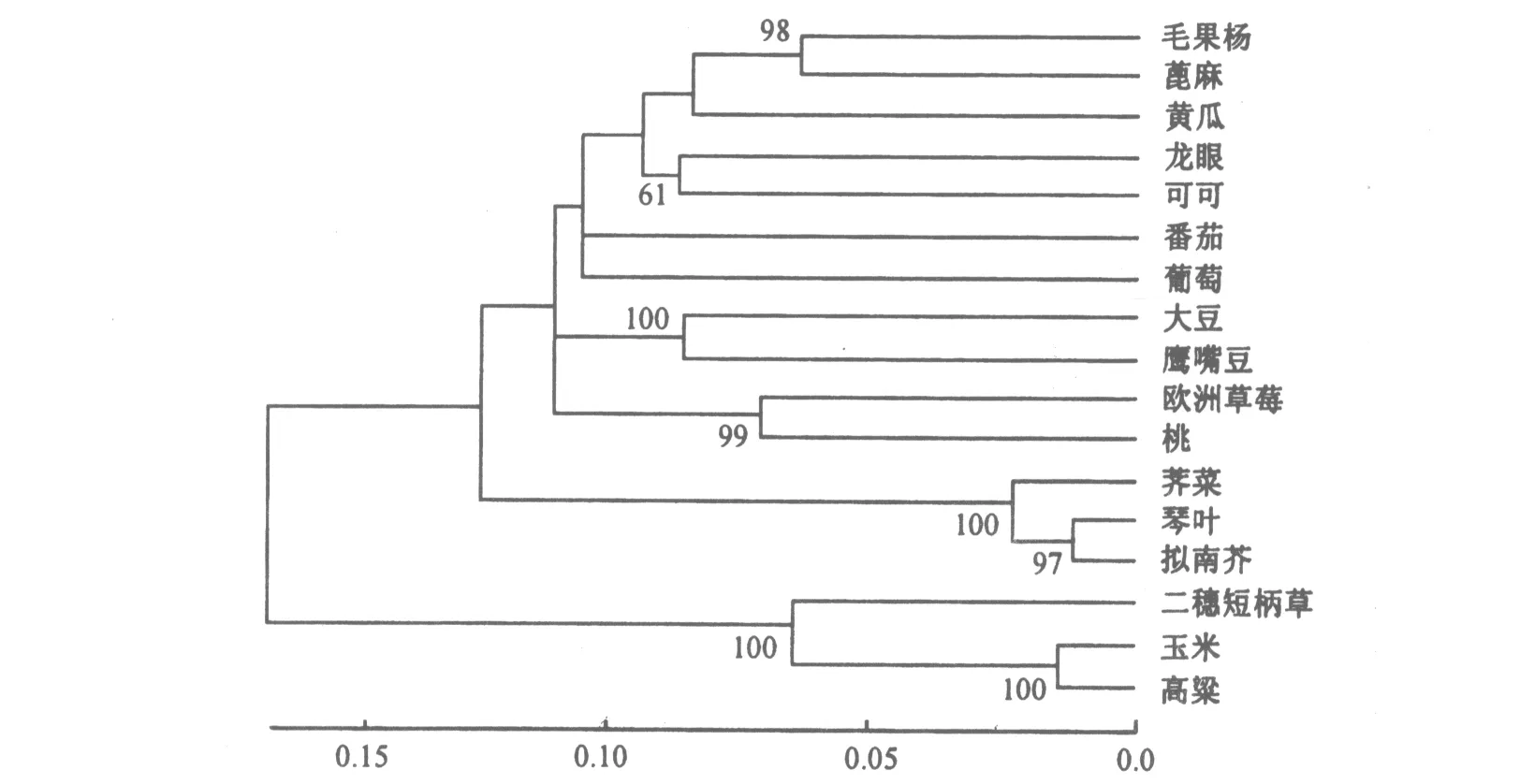
图2 Dltyw1基因推导氨基酸序列进化树分析Fig.2 Polygenetic analysis of Dltyw1 gene deduced amino-acid sequences
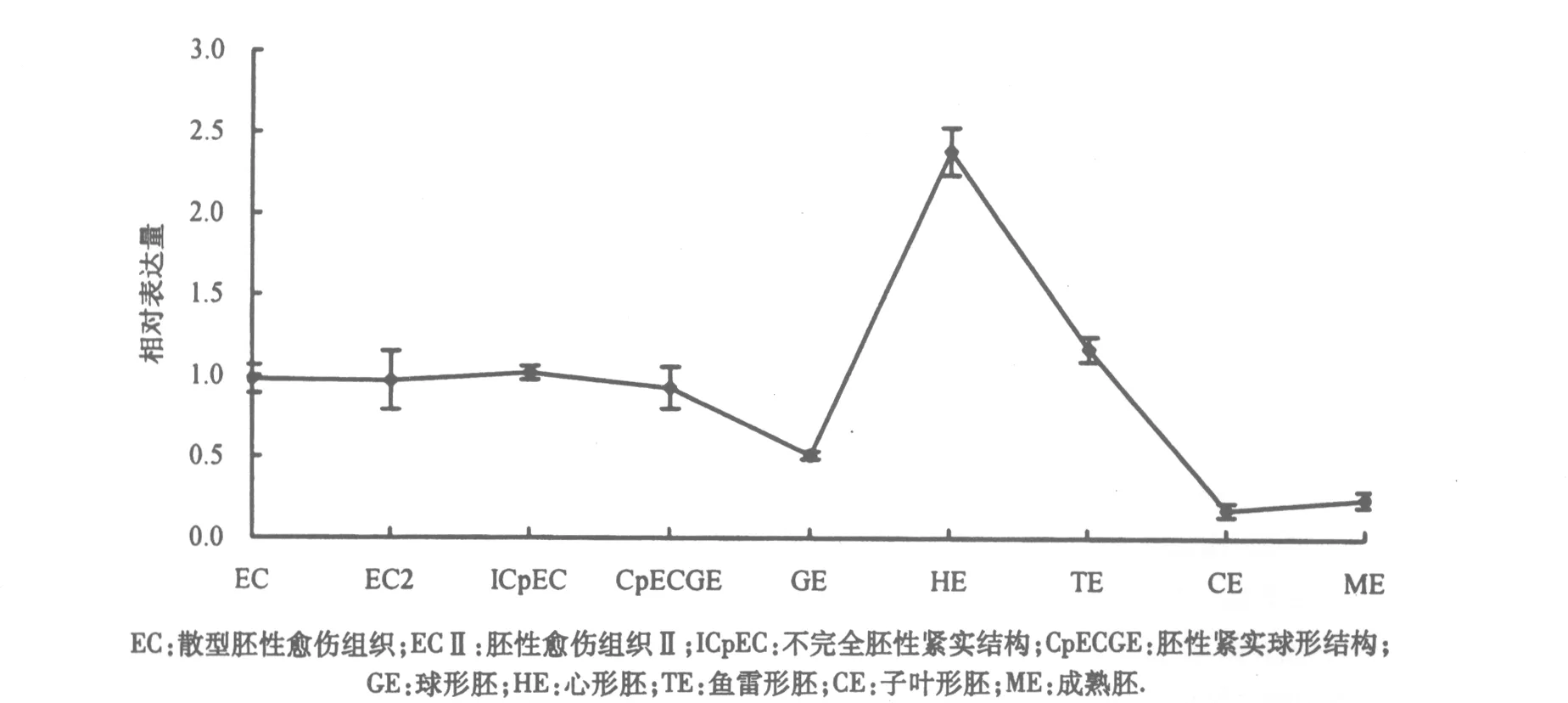
图3 龙眼Dltyw1基因在SE过程中的荧光定量表达分析Fig.3 qPCR expression analysis of Dltyw1 genes during longan SE
3 讨论
3.1twy1基因在物种间呈现较高保守性
twy1基因参与yW合成[6,9],yW通过参与tRNA修饰在基因转录后调控起重要作用,缺少yW将导致移码现象增多,并将导致病变及胚胎发育缺陷[5].twy1最早在啤酒酵母中被鉴定,此前,该类型基因仅被命名为类黄素氧还蛋白家庭(含radical SAM功能域蛋白).2006年,NOMA et al[9]通过反式技术发现,twy1与trm5、twy2、twy3,twy4一并参与yW的合成,并正式将该基因命名为tRNA怀丁苷合成蛋白.
twy1广泛分布于真核生物,在啤酒酵母中,twy1编码810个氨基酸[9],但在拟南芥中,twy1编码647个氨基酸[1],在龙眼中则编码640个.在龙眼胚性愈伤组织中,通过进化树分析表明,Dltwy1与拟南芥较为接近.twy1在单子叶和双子叶中均表现较高的保守性,特别是radical SAM功能域,在单子叶和双子叶及啤酒酵母中均呈现较高的一致性,并且均含有[CxxxCxxC]的基序.此位点通过与[Fe-S]簇结合,参与yW的三环状结构形成[9,21],因此,twy1亦为[Fe-S]簇蛋白.已有试验表明,radical SAM功能域的缺失及[Fe-S]簇结合位点的突变将导致胚胎发育的缺陷产生[15].
3.2Dltwy1在SE过程的心形胚时期起重要作用
植物体细胞胚胎发生过程是复杂的生理过程.目前,关于twy基因在植物SE过程中的生理作用所知甚少[1].在龙眼EC转录组中,检测到Dltwy基因的表达[18],通过进一步qPCR分析表明,Dltwy1在心形胚(HE)时期呈现高的表达峰,并在进入子叶形胚后迅速降至低点,表明Dltwy1基因在心形胚时期具有重要作用.在拟南芥中,CHEN et al[1]研究表明,twy1基因在拟南芥全株中表达最高为茎尖及莲座期,并在种胚发育过程亦表现先升高后降低的趋势,表明twy1基因可能在分裂及生长旺盛部位表达.在龙眼的SE过程中,Dltwy1基因的表达高峰为心形胚阶段,由于心形胚是体细胞胚胎发生过程中器官发育与形态建成的关键阶段,随着体胚发生进入子叶形胚,twy1基因表达也大幅降低,表明twy1基因在SE的组织器官发育及形态构建阶段的转录后调控方面起重要作用,对该基因的研究将为植物体细胞胚胎发生研究提供新线索.
[1] CHEN P, JAGER G, ZHENG B. Transfer RNA modifications and genes for modifying enzymes inArabidopsisthaliana[J]. BMC Plant Biology, 2010,10(1):201.
[2] AGRIS P F, VENDEIX F A, GRAHAM W D. tRNA′s wobble decoding of the genome: 40 years of modification[J]. J Mol Biol, 2007,366(1):1-13.
[3] NOVOA E M, PAVON-ETERNOD M, PAN T, et al. A Role for tRNA Modifications in Genome Structure and Codon Usage[J]. Cell, 2012,149(1):202-213.
[4] GUSTIL E M, VENDEIX F A P, AGRIS P F. tRNA′s modifications bring order to gene expression[J]. Current Opinion in Microbiology, 2008,11(2):134-140.
[5] CARLSON B A, KWON S Y, CHAMORRO M, et al. Transfer RNA modification status influences retroviral ribosomal frame shifting[J]. Virology, 1999,255(1):2-8.
[6] UMITSU M, NISHIMASU H, NOMA A, et al. Structural basis of AdoMet-dependent aminocarboxypropyl transfer reaction catalyzed by tRNA-wybutosine synthesizing enzyme, TYW2[J]. Proceedings of the National Academy of Sciences, 2009,106(37):15616-15621.
[7] LI H J, NAKANISHI K., GRUNBERGER D, et al. Biosynthetic studies of the Y base in yeast phenylalanine tRNA. Incorporation of guanine[J]. Biochem Biophys Res Commun, 1973,55(3):818-823.
[8] THIEBE R, ZACHAN H G. A specific modification next to the anticodon of phenylalanine transfer ribonucleic acid[J]. Eur J Biochem, 1968,5(4):546-555.
[9] NOMA A, KIRINO Y, IKEUCHI Y, et al. Biosynthesis of wybutosine, a hyper-modified nucleoside in eukaryotic phenylalanine tRNA[J]. EMBO J, 2006,25(10):2142-2154.
[10] HIENZSCH A, DEIML C, REITER V, et al. Total synthesis of the hypermodified RNA bases wybutosine and hydroxywybutosine and their quantification together with other modified RNA bases in plant materials[J]. Chemistry, 2013,19(13):4244-4248.
[11] DROOGMANS L, GROSJEAN H. Enzymatic conversion of guanosine 3′ adjacent to the anticodon of yeast tRNAPhe to N1-methylguanosine and the wye nucleoside: dependence on the anticodon sequence[J]. EMBO J, 1987,6(2):477-483.
[12] SUZUKI Y, NOMA A, SUZUKI T, et al. Structural basis of tRNA modification with CO2fixation and methylation by wybutosine synthesizing enzyme TYW4[J]. Nucleic Acids Research, 2009,37(9):2910-2925.
[13] RODEIFUEZ V, VASUDEVAN S, NOMA A, et al. Structure-Function Analysis of Human TYW2 Enzyme Required for the Biosynthesis of a Highly Modified Wybutosine (yW) Base in henylalanine-tRNA[J]. PLoS One, 2012,7(6):e39297.
[14] PIERREL F, DOUKI T, FONTECAVE M, et al. MiaB protein is a bifunctional radical-S- adenosylmethionine enzyme involved in thiolation and methylation of tRNA[J]. J Biol Chem, 2004,279(46):47555-47563.
[15] LUO D, BERNARD D G, BALK J, et al. The DUF59 Family Gene AE7 Acts in the Cytosolic Iron-Sulfur Cluster Assembly Pathway to Maintain Nuclear Genome Integrity inArabidopsis[J]. The Plant Cell, 2012,24(10):4135-4148.
[16] 赖钟雄,潘良镇.龙眼胚性细胞系的建立与保持[J].福建农业大学学报,1997,26(2):160-167.
[17] 陈春玲,赖钟雄.龙眼胚性愈伤组织体胚发生同步化调控及组织细胞学观察[J].福建农林大学学报:自然科学版,2002,31(2):192-194.
[18] LAI Z X, LIN Y L. Analysis of the global transcriptome of longan (DimocarpuslonganLour.) embryogenic callus using Illumina paired-end sequencingz[J]. BMC Genomics, 2013(14):561.
[19] LIN Y L, LAI Z X. Reference gene selection for qPCR analysis during somatic embryogenesis in longan tree[J]. Plant Science, 2010,178(4):359-365.
[20] SOFIA H J, CHEN G, HETZLER B G, et al. Radical SAM, a novel protein superfamily linking unresolved steps in familiar biosynthetic pathways with radical mechanisms: functional characterization using new analysis and information visualization methods[J]. Nucleic Acids Res, 2001,29(5):1097-1106.
[21] PERCHE-LETUVEE P, KATHIRVELU V, BERGGREN G, et al. 4-demethylwyosine synthase fromPyrococcusabyssiis a Radical-SAM enzyme with an additional[4Fe-4S]+2 cluster which interacts with the pyruvate co-substrate[J]. Journal of Biological Chemistry, 2012,287(49):41174-41185.
(责任编辑:吴显达)
Cloning and expression ofDltyw1 Gene during somatic embryogenesis inDimocarpuslonganL.
YE Wei1,2, LIN Yu-ling1, LAI Zhong-xiong1
(1.Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou, Fujia 350002, China; 2.Sanming Institute of Agricultural Sciences, Sanming, Fujian 365509, China)
Based on the transcriptom database of longan embryogenic callus (EC), the cloning and expression analysis of the gene encoding tRNA-wybutosine synthesizing enzyme (tyw) during somatic embryogenesis (SE) inDimocarpusIonganL. were carried out. The results indicated that the full length ofDltyw1 gene was 2273 bp, containing 1920 bp ORF, encoding 640 amino acids, and the accession number was JF733783 in GenBank.Dltyw1 contained flavodoxin 1, Radical SAM and Wyosine form domain, and polygenetic analysis indicated thatDltyw1 gene showed high homology to thetwy1 genes in other species. Using fluorescent quantitative Realtime-PCR, the expression profiles ofDltyw1 during SE were analyzed, and the results indicated thatDltyw1 had a single expression peak at heart embryo (HE) stage and followed by declining to the lowest point at the cotyledonary embryo (CE) stage. The HE was at the key stage for cell development from the globular embryoids to diverse organs during SE, therefore,Dltyw1 could be involved in post-transcriptional controlling at the tissue and organ development and the morphogenesis during SE.
DimocarpuslonganL.; somatic embryogenesis;twy1; cloning; qPCR
2013-07-25
2013-10-15
国家自然科学基金(31071787、31272149);福建省重大农业科技平台建设项目(2008N2001).
叶炜(1980-),男,博士研究生.助理研究员.研究方向:园艺植物生物技术.通迅作者赖钟雄(1966-),男,研究员.博士生导师.研究方向:园艺植物生物技术与遗传资源.Email:laizx01@163.com.
S667.2
A
1671-5470(2014)04-0391-06
