戊二醛90天喂养实验研究
2014-07-01许崇辉刘慧智温巧玲李华燕李妙珍
许崇辉 潘 芳 刘慧智 温巧玲 李华燕 李妙珍
(广东出入境检验检疫局 广东广州 510623)
戊二醛90天喂养实验研究
许崇辉 潘 芳 刘慧智 温巧玲 李华燕 李妙珍
(广东出入境检验检疫局 广东广州 510623)
[目的] 在完成戊二醛毒性检验第1阶段相关实验的基础上,开展第2阶段毒性试验的亚慢性毒性试验,初步探讨戊二醛“最大未观察到有害作用剂量”值范围。[方法] 参考GB 15193.13-2003进行高、中、低剂量经口90 d喂养实验。[结果] 高、中、低3个剂量组动物在生长发育、体重增长趋势、脏器系数和食物利用率与空白对照组动物无明显差异。高、中剂量组在红细胞、血红蛋白、白细胞高于空白对照组,差异有显著意义(P<0.05)或极显著意义(P<0.01),且存在低、中、高3个剂量组的剂量-效应关系。[结论] 戊二醛“最大未观察到有害作用剂量”值初步估计在低剂量组(0.438mg/kg体重)与中剂量组(4.38mg/kg体重)之间;血常规指标检测或可作为发现戊二醛职业接触工人慢性中毒的早期指标。
戊二醛;喂养实验;亚慢性毒性;职业接触;(中毒)指标
1 前言
戊二醛被誉为继甲醛和环氧乙烷之后化学消毒灭菌剂发展史上的第三个里程碑,适用于医疗器械和耐湿忌热的精密仪器的消毒与灭菌,广泛用于消毒灭菌、制药等行业。戊二醛作为一种有机交联剂,也广泛应用于皮革加工行业[1]。由于戊二醛是一种具有挥发性和刺激性的化学试剂,因此,职业接触戊二醛的生产工人和医务工作者的职业接触暴露具有接触暴露途径多(可经皮肤/黏膜、经呼吸道和经口3个途径)、接触暴露时间长(每个工作日数小时和数十年的职业工作)的特点。
为了研究戊二醛长期、低浓度的接触对机体的影响,本研究在对某品牌25%戊二醛溶液进行了急性毒性实验、遗传毒性实验和局部接触毒性等毒理学第1、第2阶段研究的基础上[2-4],开展了90d喂养实验等的毒理学第3阶段研究,以了解长期接触戊二醛对实验动物机体的损害,初步探讨戊二醛“最大未观察到有害作用剂量”(NOAEL)值。
2 材料与方法
2.1 材料
2.1.1 受试物样本和受试物溶液
2.1.1.1 受试物样本
市售戊二醛溶液:分析纯,浓度25%,汕头市西陇化工厂有限公司产品,批号090818。样本无色、有刺激气味、易溶于水。
2.1.1.2 受试物溶液
试验时,根据实验设计用蒸馏水临时稀释成高剂量组的试验用液;中剂量组、低剂量组分别用高剂量组液按比例稀释而成。
2.1.2 实验动物和饲料
实验动物和饲料均由广东省医学实验动物中心(实验动物生产许可证编号:SCXK(粤)2008-0002)提供。实验动物采用KM小鼠,体重10.3-11.9 g,合格证号:NO.0069846。实验动物检疫期为5d,期间每日检查动物1次,未发现不健康的动物。
2.1.3 实验环境、主要设备仪器及试剂
2.1.3.1 实验环境
SPF级动物房(实验动物使用许可证编号:SYXK(粤)2008-0086)。实验期间,室温21℃±2℃,相对湿度60%±5%。
2.1.3.2 仪器设备
7020型号生全自动化分析仪:日立公司;HEMASTAR 3 VET全自动血液细胞分析仪:HEMASTAR公司。
2.1.3.3 试剂
和光生化试剂:和光公司;血液细胞分析试剂:购于法国优德。
2.2 方法[5]
2.2.1 实验动物分组、数量、体重和性别
根据急性经口实验结果,设一个空白对照组和高剂量组(43.8mg/kg体重)、中剂量组(4.38mg/kg体重)和低剂量组(0.438mg/kg体重)3个实验组。80只KM小鼠,随机分成4组,每组20只小鼠,雌、雄各10只。
2.2.2 实验过程
2.2.2.1 日常喂养
通过饮水给予受试物,根据实验动物体重变化,临时配制成高、中、低剂量组溶液,喂养90 d。每天定量给予饲料和饮水,每周称1次体重。记录每天各组动物饮水量、饲料实际消耗量和每周每只动物的体重,计算每周及总的食物利用率。
2.2.2.2 血常规和血清生化学指标检测
喂养90d后通过摘眼球方式采空腹血,检查各组动物试验末期血常规指标及血清生化学指标。血常规指标检查包括:血红蛋白(HGB)、红细胞(RBC)、白细胞(WBC)、血小板(PLT);血液生化学指标包括:血清总蛋白(TP)、白蛋白(ALB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、葡萄糖(GLU)、 肌酐(CRE)、尿素氮(BUN)、胆固醇(CHO)及甘油三酯(TG)。
2.2.2.3 大体解剖检查
对所有动物进行大体解剖,取肝、肾、脾、睾丸/卵巢和食道末段贲门胃前段,对上述前4个器官进行称重,记录绝对重量并计算其相对重量。
2.2.2.4 主要器官组织的病理学检查
根据大体解剖检查和血清生化学指标检测结果,对肝、肾、脾、睾丸/卵巢做针对性组织病理学检查。
3 结果
3.1 生长发育情况和食物利用率
3.1.1 一般情况
整个90d的喂养期间,各组动物整体生长发育过程正常,皮肤毛色正常,各组雄性小鼠在实验开始后第7-8周出现正常发育过程中的打斗,未见其他行为异常。各组动物均未见中毒症状,未见有疾患、消瘦动物。喂养期间各组动物的生长发育过程正常,各组动物体重增长情况见表1。实验组动物的体重增长情况和趋势与空白对照组动物相类似。
表1 戊二醛90d喂养试验对小鼠体重的影响(±SD)

表1 戊二醛90d喂养试验对小鼠体重的影响(±SD)
注:除♂空白对照组第9周-12周、♂低剂量组第7- 12周n=9外,其余时间、其余组别n=10。
性别 组别体重(g)始重 第1周 第2周 第3周 第4周 第5周 第6周 第7周 第8周 第9周 第10周 第11周 末重♂ 空白对照 11.10 ±0.44 48.90 ±3.04低剂量组 11.18 ±0.52 21.26 ±0.76 31.00 ±1.62 30.97 ±1.53 34.28 ±1.80 37.12 ±2.86 41.16 ±2.20 46.10 ±2.01 45.60 ±2.39 46.68 ±2.40 48.42 ±2.58 48.64 ±2.91 47.89 ±4.14中剂量组 11.11 ±0.54 20.53 ±0.65 30.05 ±1.25 29.91 ±1.16 33.87 ±1.96 36.21 ±2.07 42.59 ±5.48 44.56 ±3.44 45.23 ±3.16 46.77 ±3.59 48.23 ±4.07 48.44 ±3.92 46.58 ±4.57♀ 空白对照 10.95 ±0.34 44.54 ±3.32高剂量组 11.04 ±0.37 20.95 ±1.10 30.12 ±2.47 29.96 ±2.29 34.30 ±2.89 36.78 ±1.90 41.20 ±3.73 44.51 ±3.89 43.86 ±3.78 44.14 ±3.89 44.69 ±3.79 43.73 ±3.63 20.61 ±1.03 30.88 ±2.31 30.60 ±2.28 34.32 ±2.92 36.99 ±3.10 41.53 ±3.50 45.97 ±3.96 45.88 ±3.50 46.27 ±4.25 47.40 ±4.22 46.85 ±4.71 39.87 ±5.15低剂量组 11.01 ±0.33 20.54 ±1.28 27.34 ±1.29 28.85 ±1.28 33.07 ±1.90 34.09 ±1.30 35.59 ±2.08 37.39 ±3.44 38.51 ±3.64 37.94 ±4.39 39.39 ±4.54 39.67 ±4.54 40.60 ±4.90中剂量组 10.95 ±0.33 20.75 ±1.34 27.74 ±2.29 28.93 ±2.26 32.44 ±2.32 32.62 ±3.08 36.45 ±3.66 37.69 ±4.13 37.85 ±3.81 38.62 ±3.94 39.68 ±4.48 39.72 ±3.42 40.37 ±3.67 39.53 ±3.19高剂量组 11.12 ±0.34 19.97 ±0.83 27.71 ±2.23 28.93 ±3.07 31.27 ±3.24 33.92 ±3.51 36.05 ±4.03 37.86 ±2.11 37.58 ±2.44 38.79 ±4.03 38.78 ±2.24 40.15 ±2.82 20.61 ±1.02 28.27 ±2.34 29.79 ±2.55 32.55 ±3.27 35.01 ±3.69 37.21 ±3.60 37.83 ±3.80 39.06 ±3.59 39.16 ±4.11 39.41 ±3.66 39.77 ±3.65
3.1.2 食物利用率
食物利用率=期间体重增加值/期间食物消耗量×100g。90d喂养期间各组小鼠每周食物利用率、总食物利用率见表2。在90d喂养期间,3组动物雄性动物总食物利用率为7.86-8.32(空白对照组雄性总食物利用率为8.18);3组动物雌性动物总食物利用率为7.03-7.28(空白对照组雌性总食物利用率为7.11)。各剂量组动物食物利用率与同性别对照组比较差异不大,也未发现存在剂量-效应关系。
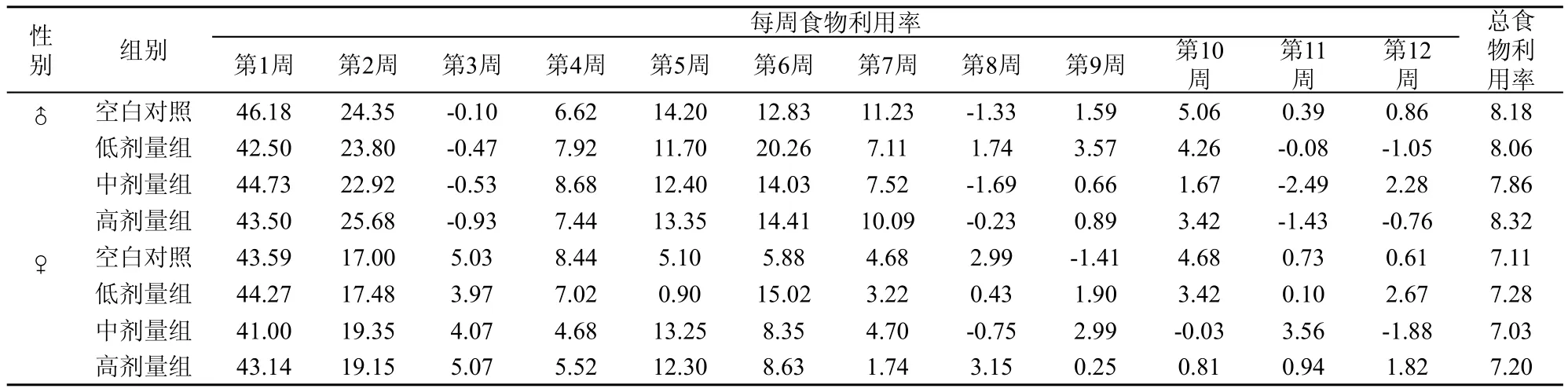
表2 戊二醛90d喂养试验每周及总食物利用率(单位:增长体重g/100g饲料)
3.2 血常规指标检测
各组动物试验末期的HGB、RBC、WBC、PLT见表3。统计分析可见,高剂量组动物的WBC、RBC、HGB都显著高于空白对照组(p <0.01或p<0.05),并且在对照、低、中、高剂量组存在一定的剂量-效应关系。
表3 戊二醛90d喂养试验实验动物血常规统计结果(±SD)(n)
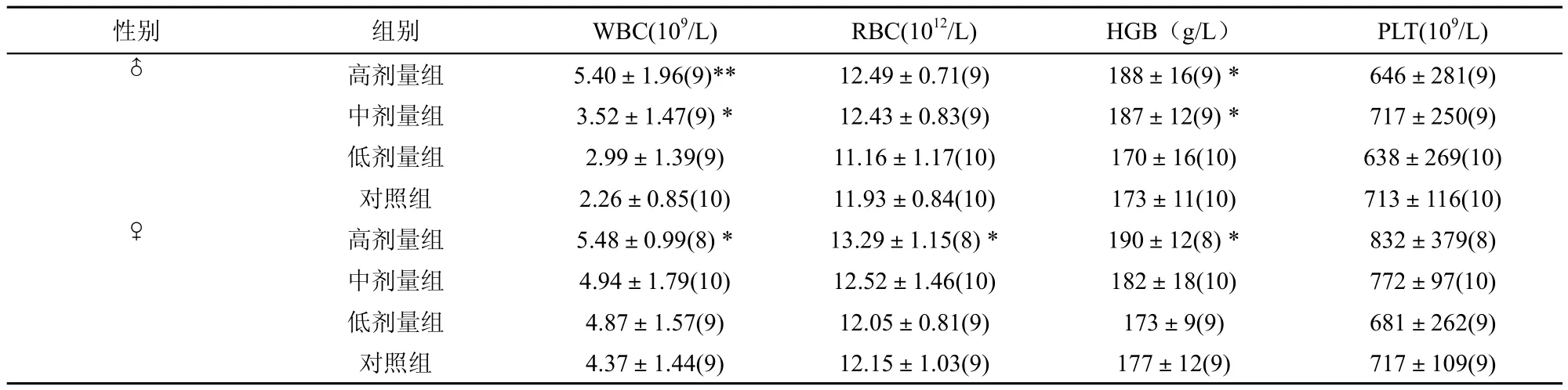
表3 戊二醛90d喂养试验实验动物血常规统计结果(±SD)(n)
注:* p<0.05,有显著性意义 ;** p<0.01,有明显显著性意义
性别 组别 WBC(109/L) RBC(1012/L) HGB(g/L) PLT(109/L)♂高剂量组 5.40±1.96(9)** 12.49±0.71(9) 188±16(9) * 646±281(9)中剂量组 3.52±1.47(9) * 12.43±0.83(9) 187±12(9) * 717±250(9)低剂量组 2.99±1.39(9) 11.16±1.17(10) 170±16(10) 638±269(10)对照组 2.26±0.85(10) 11.93±0.84(10) 173±11(10) 713±116(10)♀高剂量组 5.48±0.99(8) * 13.29±1.15(8) * 190±12(8) * 832±379(8)中剂量组 4.94±1.79(10) 12.52±1.46(10) 182±18(10) 772±97(10)低剂量组 4.87±1.57(9) 12.05±0.81(9) 173±9(9) 681±262(9)对照组 4.37±1.44(9) 12.15±1.03(9) 177±12(9) 717±109(9)
3.3 血清生化检测
各组动物的TP、ALB、ALT、AST、GLU、CRE、BUN、CHO及TG见表4。从表中可见,低剂量组动物的血清生化相应对照组比较,差异无显著性意义(P>0.05)。在中、高剂量组的血清生化与相应对照组比较,则在葡萄糖、尿素氮、肌酐有统计学意义(p <0.01或p<0.05),但低、中、高3个剂量组未发现剂量-效应关系。
表4 戊二醛90d喂养试验末期生化检验结果(±SD)
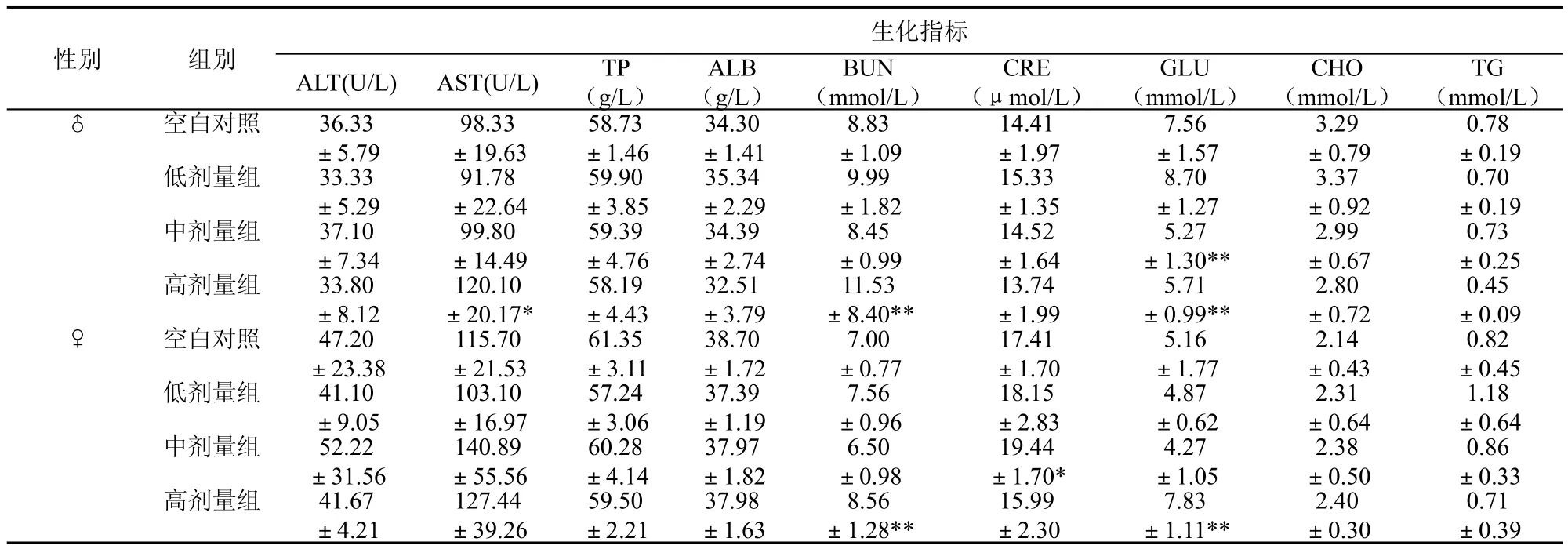
表4 戊二醛90d喂养试验末期生化检验结果(±SD)
注:* p<0.05,有显著性意义 ;** p<0.01,有明显显著性意义除雄性空白对照组、低剂量组,雌性中剂量组、高剂量组 n=9外,其余各组n=10
性别 组别ALB (g/L)TG (mmol/L)♂ 空白对照 36.33 ±5.79生化指标ALT(U/L) AST(U/L) TP (g/L)BUN (mmol/L)CRE (μmol/L)GLU (mmol/L)CHO (mmol/L)0.78 ±0.19低剂量组 33.33 ±5.29 3.29 ±0.79 98.33 ±19.63 0.73 ±0.25高剂量组 33.80 ±8.12 0.70 ±0.19中剂量组 37.10 ±7.34 91.78 ±22.64 59.90 ±3.85 58.73 ±1.46 34.30 ±1.41 8.83 ±1.09 14.41 ±1.97 15.33 ±1.355.27 ±1.30** 34.39 ±2.74 59.39 ±4.76 7.56 ±1.57 9.99 ±1.82 35.34 ±2.29 3.37 ±0.92 0.45 ±0.09♀ 空白对照 47.20 ±23.38 0.82 ±0.45低剂量组 41.10 ±9.05 14.52 ±1.64 120.10 ±20.17* 99.80 ±14.4913.74 ±1.99 8.70 ±1.272.99 ±0.67 32.51 ±3.79 0.71 ±0.39 58.19 ±4.43 8.45 ±0.995.71 ±0.99** 2.80 ±0.72 115.70 ±21.53 1.18 ±0.64中剂量组 52.22 ±31.56 7.00 ±0.77 38.70 ±1.72 17.41 ±1.70 103.10 ±16.97 11.53 ±8.40**5.16 ±1.77 61.35 ±3.11 2.14 ±0.43 0.86 ±0.33高剂量组 41.67 ±4.21 140.89 ±55.56 57.24 ±3.06 2.31 ±0.64 37.39 ±1.19 7.56 ±0.96 59.50 ±2.21 60.28 ±4.14 4.87 ±0.62 37.97 ±1.82 37.98 ±1.63 6.50 ±0.98 127.44 ±39.26 8.56 ±1.28** 19.44 ±1.70* 18.15 ±2.83 15.99 ±2.30 7.83 ±1.11** 4.27 ±1.05 2.38 ±0.50 2.40 ±0.30
3.4 解剖学及病理学检查
3.4.1 大体解剖检查和脏器系数
对各组动物作大体解剖检查未发现明显病变,空白对照组及低、中、高3个剂量组小鼠肝、肾、脾、睾丸/卵巢大体观察未见异常。统计分析,各剂量组与对照组比较,未发现各脏器绝对重量和相对重量的差异有极显著意义(p>0.05),见表5。
表5 戊二醛90d喂养试验实验动物脏器的绝对重量和相对重量(±SD)(n)
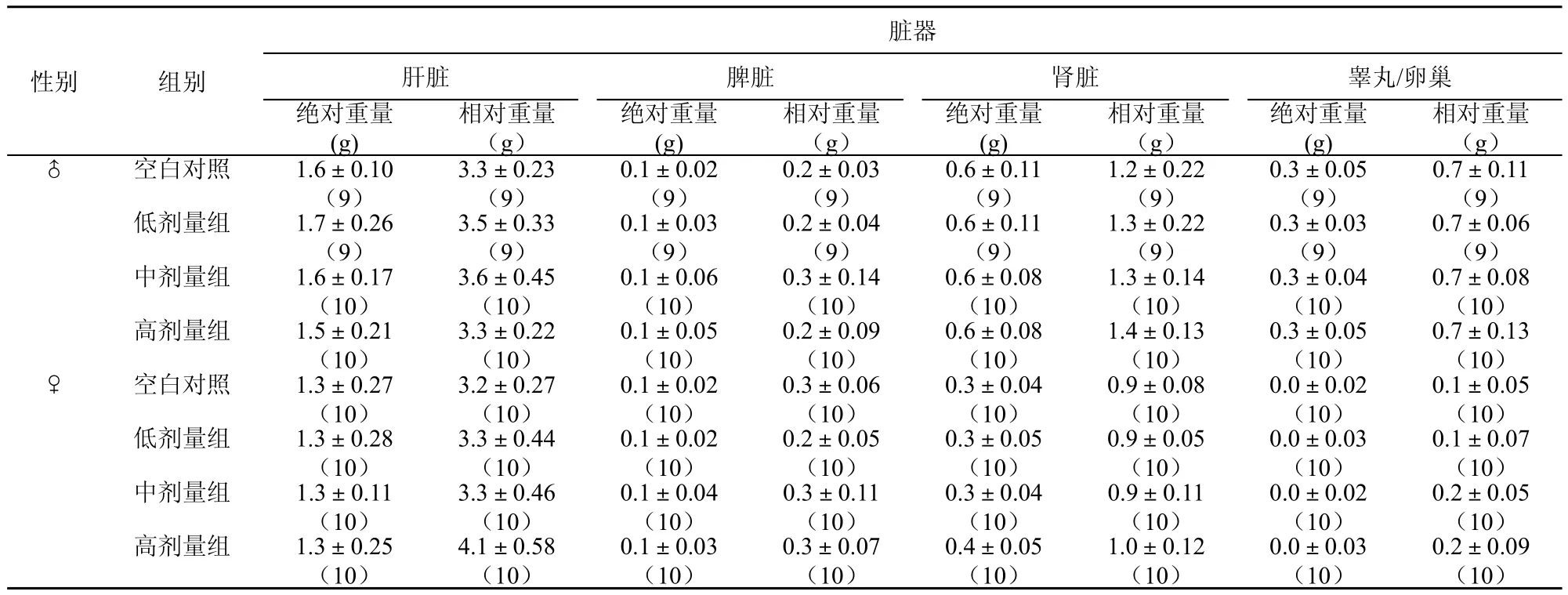
表5 戊二醛90d喂养试验实验动物脏器的绝对重量和相对重量(±SD)(n)
注:* p<0.05,有显著性意义 ;** p<0.01,有明显显著性意义
性别 组别相对重量(g)♂ 空白对照 1.6±0.10 (9)脏器肝脏 脾脏 肾脏 睾丸/卵巢绝对重量(g)相对重量(g)绝对重量(g)相对重量(g)绝对重量(g)相对重量(g)绝对重量(g) 0.7±0.11 (9)低剂量组 1.7±0.26 (9)3.3±0.23 (9)0.1±0.02 (9)0.2±0.03 (9)0.6±0.11 (9)1.2±0.22 (9)0.3±0.05 (9)0.7±0.06 (9)中剂量组 1.6±0.17 (10)3.5±0.33 (9)0.1±0.03 (9)0.2±0.04 (9)0.6±0.11 (9)1.3±0.22 (9)0.3±0.03 (9)0.7±0.13 (10)♀ 空白对照 1.3±0.27 (10)0.7±0.08 (10)高剂量组 1.5±0.21 (10)3.6±0.45 (10)0.1±0.06 (10)0.3±0.14 (10)0.6±0.08 (10)1.3±0.14 (10)0.3±0.04 (10)3.3±0.22 (10)0.1±0.05 (10)0.2±0.09 (10)0.6±0.08 (10)1.4±0.13 (10)0.3±0.05 (10)0.1±0.05 (10)低剂量组 1.3±0.28 (10)3.2±0.27 (10)0.1±0.02 (10)0.3±0.06 (10)0.3±0.04 (10)0.9±0.08 (10)0.0±0.02 (10)0.1±0.07 (10)中剂量组 1.3±0.11 (10)3.3±0.44 (10)0.1±0.02 (10)0.2±0.05 (10)0.3±0.05 (10)0.9±0.05 (10)0.0±0.03 (10)0.2±0.09 (10)0.2±0.05 (10)高剂量组 1.3±0.25 (10)3.3±0.46 (10)0.1±0.04 (10)0.3±0.11 (10)0.3±0.04 (10)0.9±0.11 (10)0.0±0.02 (10)4.1±0.58 (10)0.1±0.03 (10)0.3±0.07 (10)0.4±0.05 (10)1.0±0.12 (10)0.0±0.03 (10)
3.4.2 主要器官组织病理学检查
高、中、低剂量组肝脏、脾脏、胃、肾脏、卵巢组织结构及细胞形态与空白对照组比较无明显差别。高剂量组肝脏肝细胞索排列规则,肝细胞胞浆红染,未见变性、坏死。汇管区未见明显炎症细胞浸润,胆管及纤维结缔组织未见增生;肾脏肾脏结构完整,肾小球未见增大或萎缩,肾小管上皮细胞未见水肿变性;脾脏:红、白髓结构清晰,脾小梁未见增粗。动脉周围淋巴鞘清晰可见,中央动脉未见病变;脾小体分布、形态正常,部分生发中心清晰,脾索未见增粗,脾窦未见充血;胃:粘膜上皮完整,腺体排列整齐,未见出血、坏死、糜烂或溃疡形成。胃壁细胞及主细胞形态正常,未见萎缩、变性或坏死,未见化生或异型增生。
3.5 数据处理
各组数据分别录入SPSS数据库,计算均数和标准差;各剂量组与对照组比较,进行统计学处理,计量资料数据以“均值±标准差(±SD)” 的形式表示。
4 讨论
戊二醛急性经口毒性实验结果显示,LD50为248 mg/kg体重,最小致死剂量在94 mg/kg体重-188 mg/kg体重之间[2],根据GB 15193.13-2003 《30天和90天喂养试验》推荐[5],高剂量设计为10%-25%LD50,本研究高剂量43.8mg/kg体重约为18%LD50剂量。从实验结果来看,在90d的喂养过程中,未观察到高剂量组动物死亡和明显的中毒,高剂量组食物利用率与对照组相比也无差别,这些结果都提示,高剂量组剂量设计偏低。如若高剂量组剂量在25%LD50(约62mg/kg体重),可能能更好、更明显地反映戊二醛长期喂养实验的中毒症状和毒性。
血常规指标和血清生化指标结果显示,低剂量组动物在血常规指标和血清生化指标与对照组动物相比,各指标差别均无显著性(p>0.05),而在中、高剂量组有相当一部分指标与对照组动物相比,差异有极显著意义(p <0.01或p<0.05)。特别是血常规指标中的高剂量组雌性、雄性动物WBC、RBC、HGB都显著高于空白对照组,并且在对照、低、中、高剂量组间存在在一定的剂量-效应关系(见表3),表现出相当的相关性和一致性。对于血清生化指标,虽在中、高剂量组发现葡萄糖、尿素氮、肌酐与对照组动物相比差异有统计学意义,但在低、中、高3个剂量组中未发现剂量-效应关系。
从本实验所有检测指标来看,低剂量组动物在体重、食物利用率、血常规指标、血清生化指标、脏器/体重比值和主要器官组织病理学的检测中,与对照组均无显著性;而在中剂量组则出现在血常规指标和血清生化指标有显著性意义的改变,因此,初步可认为,本实验戊二醛对大鼠的“NOAEL”应在低剂量和中剂量组之间,即0.438-4.38mg/kg体重之间。
毒理动力学认为[6],外源性化学物在机体内的过程,一般需经吸收、代谢、分布和排泄4个阶段。在本实验中,戊二醛首先经胃肠吸收,进入血液。但从结果进行推断,血常规指标的改变可能是戊二醛在机体内引起改变的最早指标之一,因此血常规指标可以作为及早发现戊二醛慢性中毒的检测指标,这在戊二醛中、长期职业性接触工人的体检中具有相当大的意义。
5 结论
戊二醛对大鼠的NOAEL为0.438-4.38mg/kg体重;其作用机理可能是:戊二醛首先经胃肠吸收,进入血液,与血细胞的蛋白质等有机分子结合,引起血液指标的改变。因此血常规指标可以作为及早发现戊二醛慢性中毒的检测指标。
[1] 薛广波,李云先,顾春英,等. 现代消毒学[M]. 北京:人民军医出版社,2002,311-325.
[2] 许崇辉,刘慧智,温巧玲,等. 戊二醛急性毒性研究[J]. 检验检疫学刊,2012,22(4):22-24.
[3] 许崇辉,潘芳,温巧玲,等. 戊二醛遗传毒性研究[J]. 检验检疫学刊,2013,23(1):7-10.
[4] 许崇辉,温巧玲,刘慧智,等. 戊二醛局部接触毒性研究[J]. 检验检疫学刊,2013,23(5):21-23.
[5]GB15193.13-2003 30天和90天喂养试验[S].
[6] 周宗灿,毒理学教程[M].北京:北京大学医学出版社,2006:45-67.
[7] 李临生,张京东,张昌辉. 戊二醛消毒剂的特点与应用[J].日用化学工业, 2004,34(6):385-389.
Glutaraldehyde 90 Days Feeding Experiment
Xu Chonghui, Pan Fang, Liu Huizhi, Wen Qiaoling, Li Huayan, Li Miaozhan
(Guangdong Entry-Exit Inspection and Quarantine Bureau, Guangzhou, Guangdong, 510623)
Based on the relevant experimental glutaraldehyde toxicity testing on the fi rst stage, subchronic toxicity test were carried out on the second phase of toxicity tests, in order to preliminarily probe glutaraldehyde "maximum no observed adverse effect level" (NOAEL) value. Referring to GB 15193.13-2003, three doses oral 90 days feeding experiment were performed. The animal growth, body weight growth and food utilization rate for 3 dose groups were not signifi cantly different from those of control group. The red blood cells, hemoglobin, white blood cells for high, medium dose group were higher than those of the control group. The difference was signifi cant (P<0.05) or extremely significant (P<0.01), and there was a dose-effect relationship for low, middle, high dose groups. The preliminary estimate of glutaraldehyde NOAEL value was between low dose group (0.438mg/kg body weight) and middle dose group (4.38mg/kg body weight); Blood routine indexes might be used as an early indicators of intoxication for workers chronically exposed to glutaraldehyde.
Qlutaraldehyde; Feeding Study; Subchronic Toxicity; Occupation Exposures; Toxicity Index
R3114
