不同浓度幽门螺杆菌对胃癌细胞增殖凋亡及FAF1 mRNA表达的影响
2014-07-01冯洁刘爱群袁燕玲葛莲英
冯洁 刘爱群 袁燕玲 葛莲英
作者单位:530021 南宁 广西医科大学附属肿瘤医院内镜室
临床研究
不同浓度幽门螺杆菌对胃癌细胞增殖凋亡及FAF1 mRNA表达的影响
冯洁 刘爱群 袁燕玲 葛莲英
作者单位:530021 南宁 广西医科大学附属肿瘤医院内镜室
目的 研究不同浓度幽门螺杆菌(helicobacter pylori,Hp)感染对人胃癌细胞HGC-27生长及Fas相关因子1(fasassociated factor 1,FAF1)mRNA表达的影响,探讨Hp致胃癌发生的分子机制。方法 人胃癌细胞HGC-27与不同浓度Hp标准菌株NCTC11637共培养24 h,根据感染复数(细胞/细菌比)分为1∶1共培养组、1∶50共培养组、1∶100共培养组、1∶200共培养组及对照组(未与Hp共培养),采用噻唑蓝(MTT)比色法测定0 h、12 h、24 h、48 h的OD值,绘制细胞生长曲线。共培养24 h后以流式细胞仪检测细胞凋亡率,实时荧光定量逆转录聚合酶链反应(qRT-PCR)技术检测HGC-27细胞FAF1 mRNA的相对表达量,比较不同浓度Hp感染前后FAF1 mRNA表达的变化。结果 经革兰氏染色及生化实验证实培养细菌为Hp。与对照组相比,共培养12 h时,1∶50共培养组细胞增殖活性升高(P<0.05),1∶1共培养组、1∶100共培养组及1∶200共培养组细胞增殖活性低于对照组(P<0.05);共培养24 h、36 h、48 h时,各共培养组细胞增殖活性均低于对照组(P<0.05)。共培养24 h时,1∶1共培养组及1∶50共培养组细胞凋亡率及FAF1 mRNA的相对表达量与对照组比较,差异无统计学意义(P均>0.05);1∶100共培养组及1∶200共培养组细胞凋亡率明显升高,FAF1 mRNA的相对表达量较对照组明显降低(P<0.05)。结论 Hp感染可导致胃癌细胞增殖凋亡失衡,下调胃癌细胞FAF1 mRNA的表达,FAF1 mRNA的表达量与Hp的感染浓度有关,FAF1 mRNA的表达下调可能是Hp致胃癌发生的机制之一。
胃肿瘤;Fas相关因子1;幽门螺杆菌;增殖;凋亡
Fas相关因子1(fas-associated factor 1,FAF1)是Fas死亡信号结合体的成员[1],可以增强Fas介导的细胞凋亡[2],目前被认为是一种肿瘤抑制基因[3]。有报道胃癌的发生与FAF1基因表达的下调有关[4]。幽门螺杆菌(helicobacter pylori,Hp)感染是胃癌发生的重要原因之一,其致胃癌发生的机制目前尚未明确。本课题组前期研究表明,Hp可能通过下调FAF1基因的表达而发挥致癌作用[5]。本研究通过在体外将人胃癌细胞HGC-27与不同浓度Hp共同培养,观察Hp对FAF1基因mRNA表达的影响,为进一步阐明Hp致胃癌发生的分子机制提供实验基础。
1 材料和方法
1.1 材料
Hp标准菌株NCTC11637购自美国标准生物品收藏中心(ATCC)。人胃癌细胞HGC-27购自中国科学院上海生命科学研究院细胞资源中心。SYBR Master Mixture购自Takara公司,噻唑蓝(MTT)购自Amserco公司,哥伦比亚琼脂购自北京陆桥技术有限责任公司,5%脱纤维绵羊血购自大连友康生物科技有限公司。氧化酶试纸购自上海源叶生物科技有限公司,革兰氏染色液试剂盒购自北京陆桥技术有限责任公司,尿素酶试纸购自北京炳洋科技有限公司。RevertAid First Strand cDNA试剂盒购自Fermentas公司。
1.2 方法
1.2.1 Hp菌株的培养与鉴定 将Hp接种于含5%脱纤维绵羊血的哥伦比亚琼脂平板上,置于5%O2、10%CO2、85%N2、37℃培养箱中培养,接种72 h后观察分离效果和菌落形态,革兰氏染色鉴定是否为革兰氏阴性杆菌,尿素酶和氧化酶试纸检测生化反应。
1.2.2 细胞与细菌共培养 将Hp培养72 h后收集细菌,用PBS稀释制成细菌悬液,并在紫外分光光度计上测定细菌浓度(optical delnsity,OD),1 OD660=1× 108CFU/ml。将HGC-27细胞以8×105的密度接种于25 cm2细胞培养瓶中,与不同浓度的Hp在 37℃、5%CO2的CO2培养箱中共培养,按照感染复数(细胞/细菌比)分为对照组(未与Hp共培养)、1∶1共培养组、1∶50共培养组、1∶100共培养组及1∶200共培养组,收集细胞备用。
1.2.3 细胞增殖活性测定 细胞以每孔5×103的密度接种到96孔板中,与不同浓度Hp共培养0 h、12 h、24 h、36 h、48 h后弃去培养液,每孔加入5 g/ml MTT 20 μl,继续孵育4 h,弃孔内培养上清液,每孔加入DMSO 150 μl,振荡10 min后在酶标仪490 nm波长处测量吸光度值。每组均设3个复孔,重复实验3次。
1.2.4 细胞凋亡率测定 各组细胞经PBS清洗后,用不含EDTA胰酶消化,1 000 r/min离心收集细胞,加入结合缓冲液100 μl、Annexin V 2 μl和PI 2 μl孵育15 min,随机选取1×104个细胞以流式细胞仪进行检测,结果以细胞凋亡率表示。每组设3个复孔,重复实验3次。
1.2.5 实时荧光定量PCR检测 所有共培养的细胞用PBS洗涤3次,Trizol提取细胞总RNA。取总RNA 1 μg按照Fermentas试剂说明书的方法逆转录合成cDNA。PCR引物设计:FAF1上游引物为 5′-CTTGCTGAATCAGGGCTCTC-3′,下游引物为5′-TCCACCCCAAATTCTGTAGC-3′,扩增片段长度为164 bp。β-actin上游引物为5′-ACCGAGCGCGGCTACAGC-3′,下游引物为5′-CTCATTGCCAATGGTGAT-3′,扩增片段长度为180 bp。PCR反应体系如下:cDNA 1 μl,SYBR Master Mixture 12.5 μl,上下游引物各0.75 μl,水9 μl。以β-actin作为内参。PCR反应条件:95℃30 s预变性,95℃5 s变性,58℃30 s退火及延伸,循环35次。每份样本均根据β-actin的拷贝数进行校正并计算FAF1 mRNA相对表达量。FAF1 mRNA相对表达量=2-△△Ct,△△Ct值=(样品Ct值-样品内参照Ct值)-(对照样品Ct值-对照样品内参照Ct值)。每组设3个复孔,重复实验3次。
1.3 统计学方法
采用SPSS 16.0统计学软件对数据进行分析。计量资料以均数±标准差(s)表示。多个样本组间的比较采用方差分析,方差齐用LSD-t检验,方差不齐用Dunnett方法。以P<0.05为差异有统计学意义。
2 结果
2.1 Hp鉴定结果
结果观察到划线接种的Hp呈透明针尖样透明菌落,接种菌较多时可见菌苔;革兰氏染色见革兰氏阴性海鸥状、S状弯曲菌和短杆菌;尿素酶试验(尿素酶试纸由黄色转为红色)和氧化酶试验(氧化酶试纸由无色变为蓝黑色)阳性即鉴定为Hp。见图1。
2.2 HGC-27细胞与不同浓度Hp共培养后的细胞增殖活性
HGC-27细胞与Hp共培养0 h时,各培养组细胞增殖活性与对照组相同,各组之间差异无统计学意义(F=6.012,P>0.05)。共培养12 h时,1∶50共培养组细胞增殖活性高于对照组(P<0.05),其余各组细胞增殖活性低于对照组(F=759.642,P>0.05)。共培养24 h、36 h、48 h时,各共培养组细胞增殖活性均低于对照组(F=6181.255、3362.000、600.686,P均<0.05)。见表1、图2。
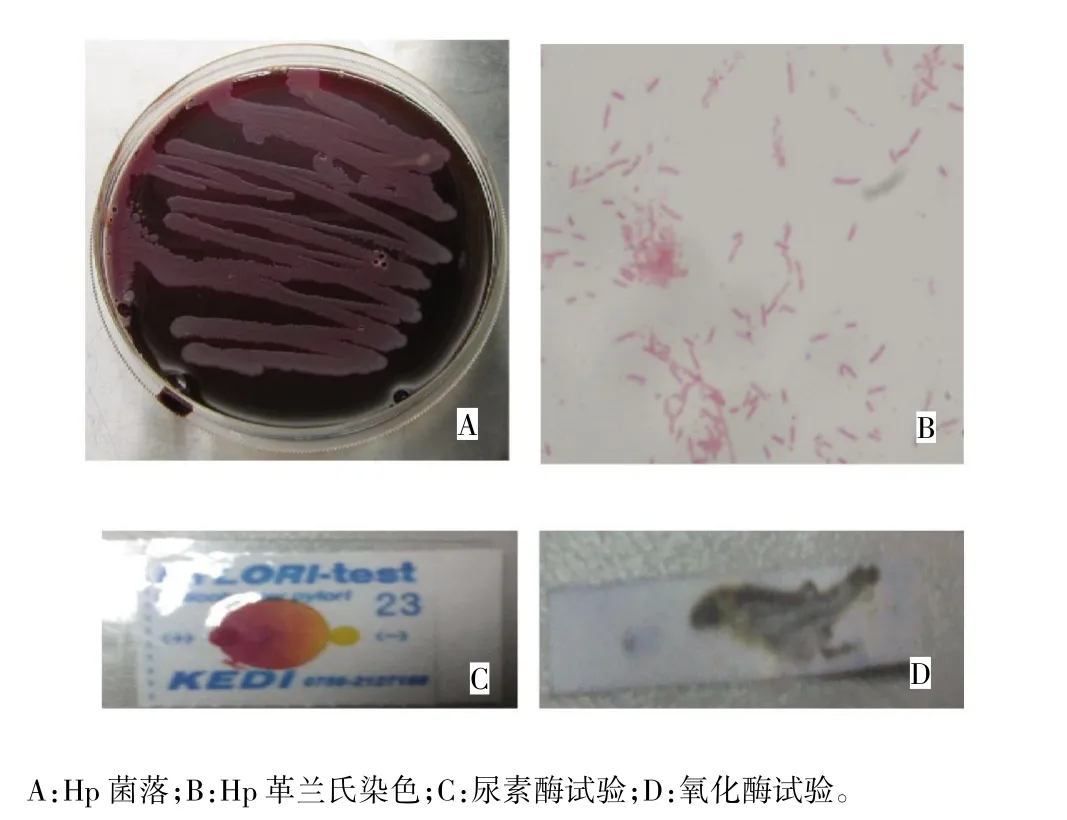
图1 Hp培养及其鉴定结果
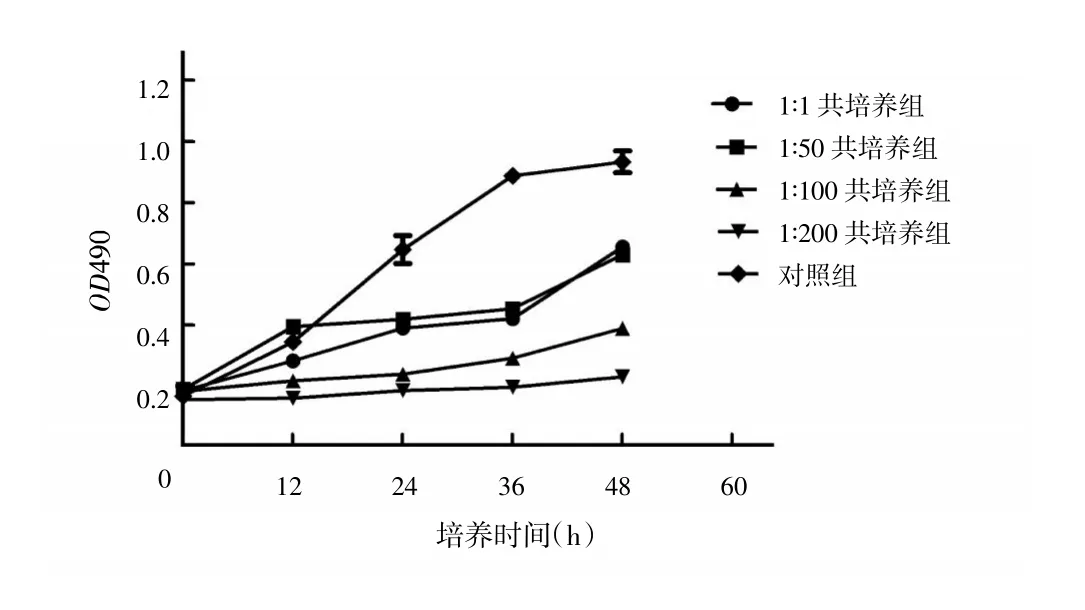
图2 HGC-27细胞与不同浓度Hp共培养后的生长曲线变化
表1 HGC-27细胞与不同浓度Hp共培养后不同时间点的细胞增殖活性(s)
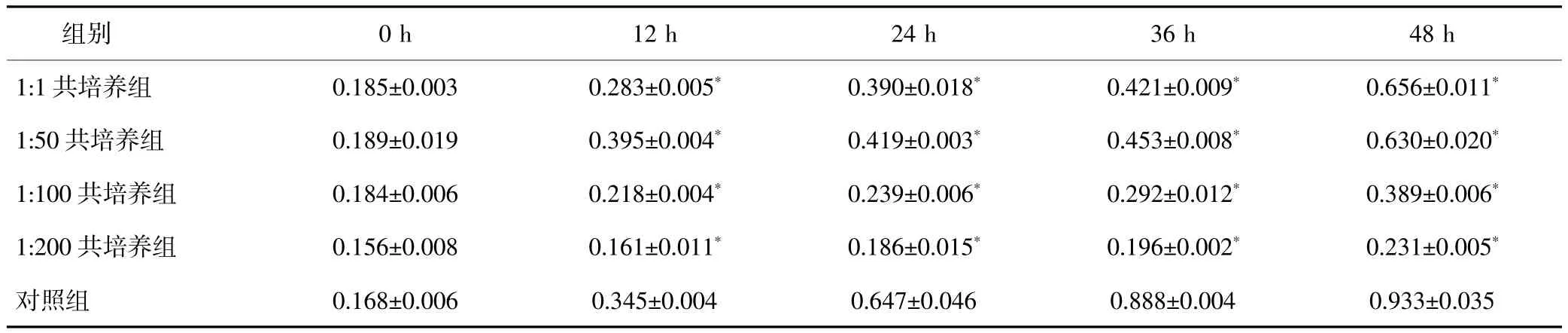
表1 HGC-27细胞与不同浓度Hp共培养后不同时间点的细胞增殖活性(s)
与对照组相比,*P<0.05。
组别 0 h 12 h 24 h 36 h 48 h 1:1共培养组 0.185±0.003 0.283±0.005*0.390±0.018*0.421±0.009*0.656±0.011*1:50共培养组 0.189±0.019 0.395±0.004*0.419±0.003*0.453±0.008*0.630±0.020*1:100共培养组 0.184±0.006 0.218±0.004*0.239±0.006*0.292±0.012*0.389±0.006*1:200共培养组 0.156±0.008 0.161±0.011*0.186±0.015*0.196±0.002*0.231±0.005*对照组 0.168±0.006 0.345±0.004 0.647±0.046 0.888±0.004 0.933±0.035
2.3 HGC-27细胞与不同浓度Hp共培养24 h后细胞凋亡率情况
HGC-27细胞与Hp共培养24 h时,1∶1共培养组及1∶50共培养组细胞凋亡率分别为(2.667±1.518)%和(7.300±1.664)%,与对照组的(1.867±0.577)%比较,差异均无统计学意义(F=32.141,P均>0.05);1∶100共培养组和1∶200共培养组细胞凋亡率分别为(11.267±4.671)%和(30.067±5.907)%,均高于对照组(P均<0.05)。见图3。
2.4 HGC-27细胞与不同浓度Hp共培养 24 h后FAF1 mRNA的表达
Hp感染浓度为1∶1时,FAF1 mRNA的相对表达量为0.63±0.41,与对照组的表达量0.97±0.19比较,差异无统计学意义(P>0.05)。感染浓度为1∶50时,FAF1 mRNA的相对表达量为2.39±1.61,较对照组有所上调,但差异无统计学意义(P>0.05)。当Hp感染浓度为1∶100及1∶200时,FAF1 mRNA的相对表达量分别为0.50±0.20和0.17±0.14,均较对照组降低(P均<0.05)。见图4。
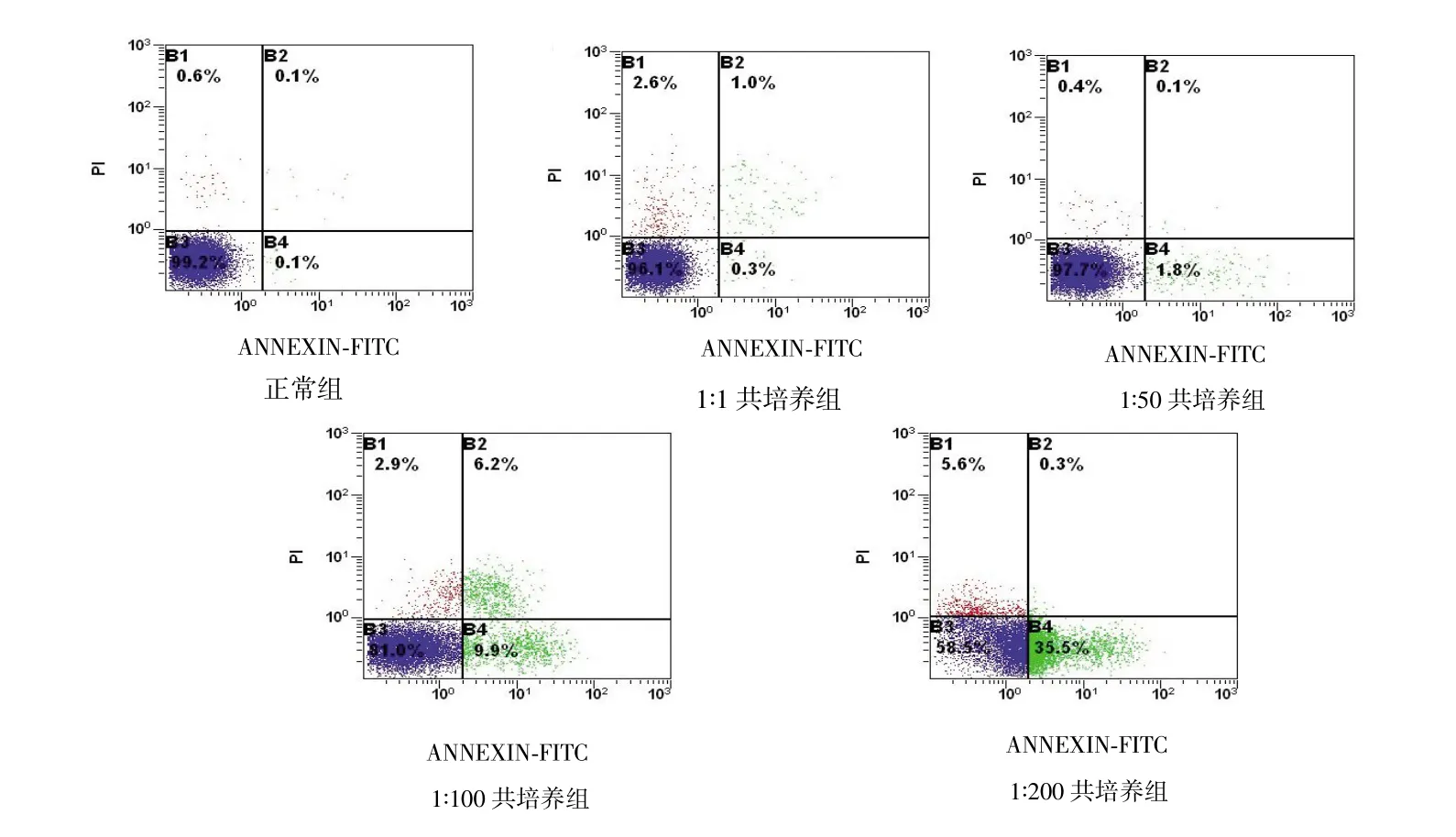
图3 HGC-27细胞与不同浓度Hp共培养24 h后的细胞凋亡率
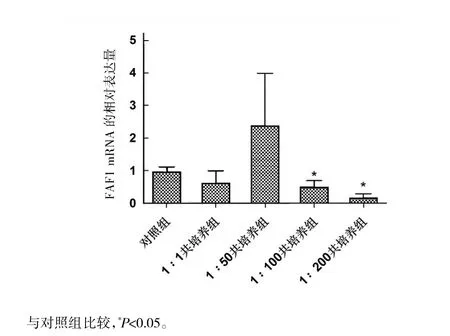
图4 HGC-27细胞与不同浓度Hp共培养24 h后FAF1 mRNA的相对表达量
3 讨论
Hp感染与胃癌的发生有关,是胃癌发生的一类致癌原[6],这一结论已被公认,然而目前对Hp致癌的具体机制仍未阐明。在胃黏膜的癌变过程中,凋亡和增殖调控紊乱起重要作用[7,8],因此凋亡相关基因在胃癌发生中的作用日益受到重视。
FAF1是Fas死亡信号结合体的成员之一[1],大量的研究表明FAF1是一种促细胞凋亡的基因。其促细胞凋亡的机制包括FAF1序列本身含有类似泛素的序列结构,FAF1的过度表达可以抑制泛素蛋白降解和细胞死亡增加[9];FAF1可以与蛋白激酶CK2组成复合物影响细胞凋亡[10,11];负调节NF-κB信号转导途径[12,13]、上调 caspase-8[14]可促进细胞凋亡。Bjørling-Poulsen等[4]对各种不同肿瘤组织用Western blot法检测,发现FAF1在胃癌组织中特异性低表达,提示FAF1可作为胃癌特殊的诊断标志物。Hyland等[15]研究中国中北部人群中Fas途径相关基因的SNPs时发现,FAF1的表达与胃贲门腺癌和非贲门腺癌的发生风险相关。但目前FAF1与胃癌及胃癌常见病因Hp感染的关系国内外鲜有报道。
本课题组的前期组织学研究发现,Hp感染胃黏膜FAF1 mRNA的表达明显低于无Hp感染的胃黏膜[16],提示Hp感染与胃组织FAF1 mRNA的表达水平有关。本研究进一步在细胞水平上研究发现,当Hp感染胃癌细胞时,低浓度菌液对胃癌细胞的增殖凋亡或无影响(感染复数为1∶1),或促进胃癌细胞增殖(感染复数为1∶50)。随着Hp感染浓度升高和时间延长,细胞增殖受到抑制,细胞凋亡增加,与王芬等[17]的研究结果一致。此外,随着Hp感染浓度的变化,FAF1 mRNA的表达也呈不同的变化,提示Hp对FAF1 mRNA表达的调节与其浓度有关。极低浓度时FAF1 mRNA的表达量与对照组无差异,低浓度时由于刺激细胞增殖,反应性FAF1 mRNA的表达升高。随着Hp感染浓度的升高,细胞凋亡增加,最终表现为对FAF1 mRNA表达的下调。提示Hp感染可能是引起胃癌细胞FAF1 mRNA表达下调的原因。推测体内的Hp感染是一个慢性过程,随着Hp感染时间的延长,促凋亡基因FAF1 mRNA的表达逐渐下调,细胞凋亡受到抑制;另一方面细胞代偿性增殖,当代偿性增殖的细胞数量超过凋亡的细胞数量后,过度增殖的胃黏膜上皮细胞可以逃逸Fas途径的凋亡,最终可能导致癌症的发生。
综上所述,Hp感染可导致胃癌细胞增殖、凋亡失衡,下调胃癌细胞FAF1 mRNA的表达。FAF1 mRNA的表达量与Hp感染的浓度有关,其下调可能是Hp致胃癌发生的机制之一。未来进一步研究FAF1基因的功能和作用机制,明确Hp感染下调FAF1基因的表达对相关下游通路的影响,或许有助于更进一步阐明Hp的致癌机制,为胃癌的治疗提供新的方向。
[1] Ryu SW,Lee SJ,Park MY,et al.Fas-associated factor 1,FAF1,is a member of Fas death-inducing signaling complex[J].J Biol Chem,2003,278(26):24003-24010.
[2] De Zio D,Ferraro E,D'Amelio M,et al.Faf1 is expressed during neurodevelopment and is involved in Apaf1-dependent caspase-3 activation in proneural cells[J].Cell Mol Life Sci,2008,65(11):1780-1790.
[3] Menges CW,Altomare DA,Testa JR.FAS-associated factor 1(FAF1):diverse functions and implications for oncogenesis[J].Cell Cycle,2009,8(16):2528-2534.
[4] Bjørling-Poulsen M,Seitz G,Guerra B,et al.The pro-apoptotic FAS-associated factor 1 is specifically reduced in human gastric carcinomas[J].Int J Oncol,2003,23(4):1015-1023.
[5] Liu AQ,Ge LY,Ye XQ,et al.Reduced FAF1 expression and helicobacter infection:correlations with clinicopathological features in gastric cancer[J].Gastroenterol Res Pract,2012,2012:153219.
[6] Kuipers EJ,Meuwissen SG.Helicobacter pylori and gastric carcinogenesis[J].Scand J Gastroenterol Suppl,1996,218:103-105.
[7] Maeda S,Mentis AF.Pathogenesis of Helicobacter pylori infection[J]. Helicobacter,2007,12 Suppl 1:10-14.
[8] Yu XW,Xu Y,Gong YH,et al.Helicobacter pylori induces malignant transformation of gastric epithelial cells in vitro[J].APMIS,2011,119(3):187-197.
[9] Buchberger A,Howard MJ,Proctor M,et al.The UBX domain:a widespread ubiquitin-like module[J].J Mol Biol,2001,307(1):17-24.
[10]Guerra B,Boldyreff B,Issinger OG.FAS-associated factor 1 interacts with protein kinase CK2 in vivo upon apoptosis induction[J].Int J Oncol,2001,19(6):1117-1126.
[11]Olsen BB,Jessen V,Højrup P,et al.Protein kinase CK2 phosphorylates the Fas-associated factor FAF1 in vivo and influences its transport into the nucleus[J].FEBS Lett,2003,546(2-3):218-222.
[12]Park MY,Moon JH,Lee KS,et al.FAF1 suppresses IkappaB kinase(IKK)activation by disrupting the IKK complex assembly[J].J Biol Chem,2007,282(38):27572-27577.
[13]Altomare DA,Menges CW,Pei J,et al.Activated TNF-alpha/NF-kappaB signaling via down-regulation of Fas-associated factor 1 in asbestos-induced mesotheliomas from Arf knockout mice[J].Proc Natl Acad Sci USA,2009,106(9):3420-3425.
[14]Park MY,Ryu SW,Kim KD,et al.Fas-associated factor-1 mediates chemotherapeutic-induced apoptosis via death effector filament formation[J].Int J Cancer,2005,115(3):412-418.
[15]Hyland PL,Lin SW,Hu N,et al.Genetic variants in fas signaling pathway genes and risk of gastric cancer[J].Int J Cancer,2013,134(4):822-831.
[16]刘爱群,葛莲英,罗小玲,等.FAF1 mRNA在胃癌组织中的表达及其与幽门螺杆菌感染的相关性[J].世界华人消化杂志,2010,18(23):2422-2426.
[17]王芬,潘建华,罗丽丹,等.不同幽门螺杆菌临床菌株对人胃黏膜细胞系GES-1增殖和凋亡的影响及其致癌性的研究[J].中南大学学报(医学版),2011,36(9):865-871.
[2014-02-28收稿][2014-08-20修回][编辑 罗惠予]
Effects of different Helicobacter pylori loads on proliferation,apoptosis and FAF1 mRNA expression in gastric cancer cells
FENG Jie,LIU Ai-qun,YUAN Yan-ling,GE Lian-ying(Department of Endoscopy,Affiliated Tumor Hospital of Guangxi Medical University,Nanning 530021,P.R.China)
GE Lian-ying.E-mail:gelianying2008@163.com
Objective To explore the molecular involvement of Helicobacter pylori in gastric cancer by examining the effects of different H.pylori loads on proliferation,apoptosis and FAF1 mRNA expression in gastric cancer cells.Method Human gastric carcinoma HGC-27 cells were co-cultured with different amounts of standard H.pylori strain NCTC11637;multiplicities of infection(MOIs,bacteria/cells)were 0,1,50,100 and 200.H.pylori was identified based on Gram staining and biochemical tests.Cancer cell proliferation was measured using the thiazolyl blue(MTT)assay after 0,12,24,36 and 48 h of co-culture.After 24 h co-culture,apoptosis in the cancer cells was measured using flow cytometry,and FAF1 mRNA expression was quantitated using fluorescent real-time quantitative RT-PCR.Expression of the β-actin gene was used as a reference for normalizing FAF1 mRNA expression levels.Results After 12 hco-culture,cancer cell proliferation at MOI 50 was significantly greater than at MOI 0(P<0.05),whereas proliferation at other MOIs was lower than at MOI 0(P<0.05).After co-culture for 24,36 and 48 h,cancer cell proliferation at all MOIs was significantly lower than at MOI 0(P<0.05).After 24 h co-culture,apoptosis levels and relative FAF1 mRNA expression were similar at MOIs 0,1,and 50(P>0.05).In contrast,apoptosis levels were significantly higher and relative FAF1 mRNA expression significantly lower at MOIs 100 and 200 than at MOI 0(P<0.05).Conclusion H.pylori infection can suppress proliferation,promote apoptosis and down-regulate FAF1 mRNA expression in gastric cancer cells.Down-regulation of FAF1 mRNA by H.pylori may lead to gastric cancer.
Gastric neoplasm;Fas-associated factor 1;Helicobacter pylori;Proliferation;Apoptosis
R735.2
A
1674-5671(2014)04-05
10.3969/j.issn.1674-5671.2014.04.10
广西自然科学基金资助项目(2012GXNSFDA053021)
葛莲英。E-mail:gelianying2008@163.com
