三七总皂苷对顺铂肾损害大鼠肾组织差异表达蛋白质的影响
2014-07-01杨玉芳刘华钢席加喜刘新文
杨玉芳刘华钢 席加喜 刘新文
作者单位:530021 南宁△广西医科大学第一附属医院药学部;广西医科大学药学院
基础研究
三七总皂苷对顺铂肾损害大鼠肾组织差异表达蛋白质的影响
杨玉芳△刘华钢 席加喜 刘新文
作者单位:530021 南宁△广西医科大学第一附属医院药学部;广西医科大学药学院
目的 探讨三七总皂苷(panax notoginsenosides,PNS)对顺铂肾损害大鼠肾组织差异表达蛋白质的影响。方法 实验大鼠随机分为正常对照组、顺铂模型组和PNS治疗组,对大鼠给药处理10 d后,检测大鼠血清尿素氮(BUN)、肌酐(Scr)和尿N-乙酰-β-氨基葡萄糖苷酶(NAG)的水平,并做肾脏病理检查;采用SELDI-TOF-MS技术筛选大鼠肾组织的差异表达蛋白质,并通过MALDI-TOF-MS/MS、Western blot实验予以鉴定。结果 顺铂模型组大鼠血清BUN、Scr和尿NAG的水平均显著高于正常对照组(P均<0.05)。电镜下可见肾小管上皮细胞的线粒体明显损伤,说明顺铂肾损害大鼠模型制作成功。PNS干预可使大鼠血清BUN、Scr和尿NAG的水平显著低于顺铂模型组(P<0.05),肾小管上皮细胞的线粒体损害程度较顺铂模型组明显改善,提示PNS对其有保护作用。筛选出顺铂模型组与正常对照组肾组织差异表达的蛋白质20个,其中7个蛋白质在顺铂模型组中的表达下调2倍以上;顺铂模型组与PNS治疗组肾组织差异表达的蛋白质18个,其中11个蛋白质在PNS治疗组中的表达下调;有6个共同的差异表达蛋白质在顺铂模型组较正常对照组的表达上调或下调,在PNS治疗组可回调到接近正常对照组水平。差异表达蛋白质m/z 10815.42被鉴定为线粒体热休克蛋白,m/z 16021.67被鉴定为血红蛋白β1亚基、血红蛋白β2亚基。结论 顺铂肾损害可伴随多种蛋白质的表达变化,这些差异表达蛋白质可能与顺铂损害肾脏以及PNS的保护作用有关。通过对其分离和鉴定,进一步了解其性质,将有助于全面、系统地探讨顺铂肾损害以及PNS保护作用的机制。
三七总皂苷;顺铂肾损害;差异表达蛋白质;SELDI-TOF-MS;线粒体热休克蛋白
顺铂对多种实体肿瘤均有效[1],是临床上最常用的化疗药物之一。然而顺铂肾毒性、治疗的疗效均与其剂量呈正相关,因此肾损害是限制顺铂临床应用剂量的主要不良反应。目前顺铂肾损害的机制尚未完全阐明。顺铂肾损害的发生、发展可能涉及多种机制、多种信号途径的复杂过程,并伴随多种蛋白质的表达变化[2,3]。而以往对顺铂肾损害的研究多停留在生化、免疫学等检测指标上,且缺乏联系性和系统性。
目前临床上多采用水化疗法辅以利尿药物和脱水剂防治顺铂肾损害,虽有一定效果,但肾功能损害仍然时有发生,而且该法并不适于所有患者,因此临床上急需寻找既不影响顺铂疗效又能降低顺铂肾毒性的药物。三七总皂苷(panax notoginsenosides,PNS)可降低顺铂肾损害小鼠的肌酐(Scr)、尿素氮(BUN)水平,增加肾小管上皮细胞的存活率[4],同时PNS具有提高机体免疫功能以及抑制肿瘤生长的作用[5,6],因此PNS对顺铂肾损害既有保护作用又不抑制其抗肿瘤效应。PNS含有多种有效成分和具有多种药理作用,其对顺铂肾损害的保护作用可能涉及多个途径和多种机制。本实验采用敏感、高通量的差异蛋白质组学的研究方法,即以CM10蛋白芯片结合SELDI-TOF-MS技术,对大鼠顺铂肾损害的肾组织差异表达的蛋白质进行筛选,并用PNS干预处理,从蛋白质组学的角度探讨顺铂肾损害及PNS保护作用的可能机制。
1 材料与方法
1.1 主要试剂和仪器
三七总皂苷注射剂(批号20110115)购自广西梧州制药(集团)股份有限公司。顺铂粉注射剂(批号0070152DB)购自齐鲁制药有限公司。CM10蛋白芯片为美国 Cuphergen公司产品,Protein Chip Biology System(PBSⅡC)型蛋白芯片阅读机为美国Cuphergen公司,5800 MALDI-TOF-MS/MS质谱仪为美国ABSCIX公司。
1.2 实验动物
48只SD雄性大鼠6周龄,体重(200±20)g,SPF级,由广西医科大学实验动物中心提供。实验动物许可证号GX MU2010032418。饲料、饮水和笼具等均经高压灭菌和紫外线消毒后使用。
1.3 实验动物分组及给药处理
实验大鼠适应性饲养1周后随机分为3组,每组16只,自然昼夜条件下自由进食、饮水。3组均为腹腔注射给药。⑴正常对照组:d1~d10给予与PNS等容量的生理盐水,每天1次;⑵顺铂模型组:d1给予顺铂(5 mg/kg),d2~d10给予与PNS等容量的生理盐水,每天1次;⑶PNS治疗组:d1给予顺铂(5 mg/kg)后,再给予PNS(31.35 mg/kg)1次,d2~d10给予PNS(31.35 mg/kg),每天1次。顺铂、PNS给药剂量参照魏伟等[7]主编的《药理实验方法学》,由成人的临床常用剂量换算为大鼠的给药剂量。
1.4 标本的采集及检测
于实验第10天给予PNS后用代谢笼收集大鼠尿液留作N-乙酰-β-氨基葡萄糖苷酶(NAG)检测,之后麻醉大鼠,切开腹腔行腹主动脉采血,EDTA抗凝取血清,分别采用氧化酶法、速率法测定大鼠血清Scr、BUN的水平,用对硝基酚比色法测定大鼠尿中NAG含量。用预冷生理盐水原位灌洗肾脏后,取部分肾组织作差异表达蛋白质的筛选与鉴定,另取部分肾组织送电镜室,观察肾组织病理学改变。
1.5 肾脏组织差异表达蛋白的检测
用组织裂解液将肾组织彻底裂解,以12 000 r/min、4℃离心1 h,上清液用Narodrop 2000(ND-2000)仪进行蛋白质定量,取50 μl上清液,加入80 μl CM10 buffer,立刻充分混合,以10 000 r/min、4℃离心5 min,在CM-10型芯片上样。采用SELDI-TOF-MS技术检测差异表达蛋白质质谱。用标准芯片校正质谱仪,仪器参数设定为:最高分子量为50 000道尔顿,优化范围为2 000~20 000道尔顿;激光强度为190,检测敏感性为8,每个样本取130个点的平均值。使用软件Ciphergen Protein Chip 3.2自动采集芯片上数据并绘制蛋白质质谱图。信号噪声(signal-to-noise ratio,S/N)大于5为有效波峰。蛋白质质荷比以m/z值表示,采用Biomarker Wizard软件计算 m/z相同的蛋白在各组之间峰值差异含量,P<0.05者为差异蛋白峰。
1.6 差异表达蛋白质的分离、纯化和鉴定
将含有候选差异表达蛋白质的肾组织标本以10 000 r/min、4℃离心3 min,采用Tricine-SDS-PAGE电泳凝胶分离、纯化部分差异表达蛋白质。电泳后的凝胶经考马斯亮蓝染色,将目标蛋白质相应的凝胶条带切下,加入适量胰蛋白酶工作液,在37℃烘箱中孵育过夜(12~16 h)。洗胶粒3次,吸取及合并酶解液体,离心取上清液在384靶盘上点靶,以校正标准品作为校正,采用MALDI-TOF-MS/MS质谱仪获取蛋白质的肽图谱,通过Mascot软件查询NCBI、SWISSPROT数据库进行搜索比对,得出目标蛋白质的相关信息。
1.7 Western blot(WB)法对目标蛋白质进行验证
含有目标蛋白质的标本经Tricine-SDS-PAGE凝胶电泳,并转移到PVDF膜上。接着将膜脱色后,用HSP10的单克隆一抗(1∶1 000)4℃孵育过夜,Tublin为内参。次日取出PVDF膜,以红外二抗(1∶25 000)室温下避光孵育2 h,最后采用美国LI-COR公司的Odyssey红外荧光扫描成像系统进行扫描和分析。
1.8 统计学方法
应用 SPSS 13.0统计学软件对实验数据进行处理和分析。计量资料采用(χ±s)表示,组间两两比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 顺铂肾损害大鼠模型以及PNS干预结果
顺铂模型组大鼠血清BUN、Scr和尿NAG的水平均显著高于正常对照组(P<0.05)。电镜下可见肾小管上皮细胞的线粒体明显损伤,说明顺铂肾损害大鼠模型制作成功。PNS干预可使大鼠血清BUN、Scr和尿NAG的水平显著低于顺铂模型组(P<0.05),肾小管上皮细胞的线粒体损害程度较顺铂模型组明显改善,提示PNS对顺铂肾损害有保护作用。
2.2 差异表达的蛋白质检测结果
从CM10蛋白芯片上获得的蛋白质峰中(图1-A)筛选出顺铂模型组与正常对照组之间的差异表达蛋白峰20个(P<0.05),其中7个蛋白质在顺铂模型组中的表达较正常对照组下调,且下调2倍以上。蛋白质m/z 16021.67、m/z 12151.56分别在顺铂模型组、正常对照组中的表达量最大。表1为部分差异表达的蛋白质。
从CM10蛋白芯片上获得的蛋白质峰中(图1-B)筛选出顺铂模型组与PNS治疗组之间的差异表达蛋白峰18个(P<0.05),其中11个蛋白质在PNS治疗组的表达下调。蛋白质m/z3763.05在PNS治疗组中的表达量最大。表2为部分差异表达蛋白质。

图1 从CM10蛋白芯片捕获的蛋白质质谱图
在表1、表2中,有6个为共同的差异表达蛋白质(表3),其中4个蛋白质在顺铂模型组的表达较正常对照组上调,而在PNS治疗组的表达较顺铂模型组下调;2个蛋白质在顺铂模型组较正常对照组下调,在PNS治疗组的表达较顺铂模型组上调。
2.3 差异表达蛋白质的鉴定结果
目前鉴定出以下两个目标蛋白质的相关信息。m/z 10815.42差异表达蛋白质与线粒体热休克蛋白(mitochondrial heat shock protein,mHSP或HSP10)(P26772)匹配上8个肽段,得分为96分(图2-A);蛋白质m/z 16021.67与血红蛋白β1亚基(P02091)和血红蛋白β2亚基(P11517)分别匹配上13个肽段、10个肽段,得分分别为256分、97分(图2-B)。
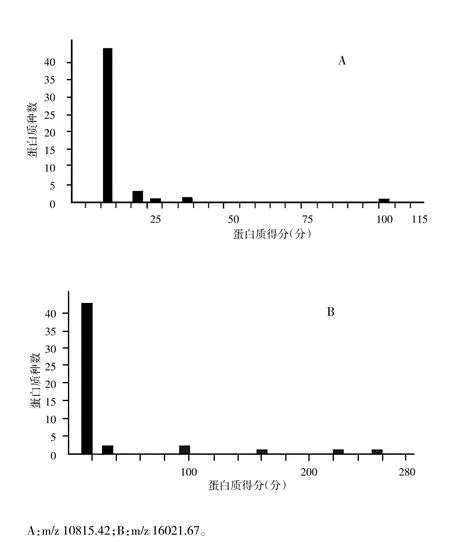
图2 差异表达蛋白质的质谱鉴定结果
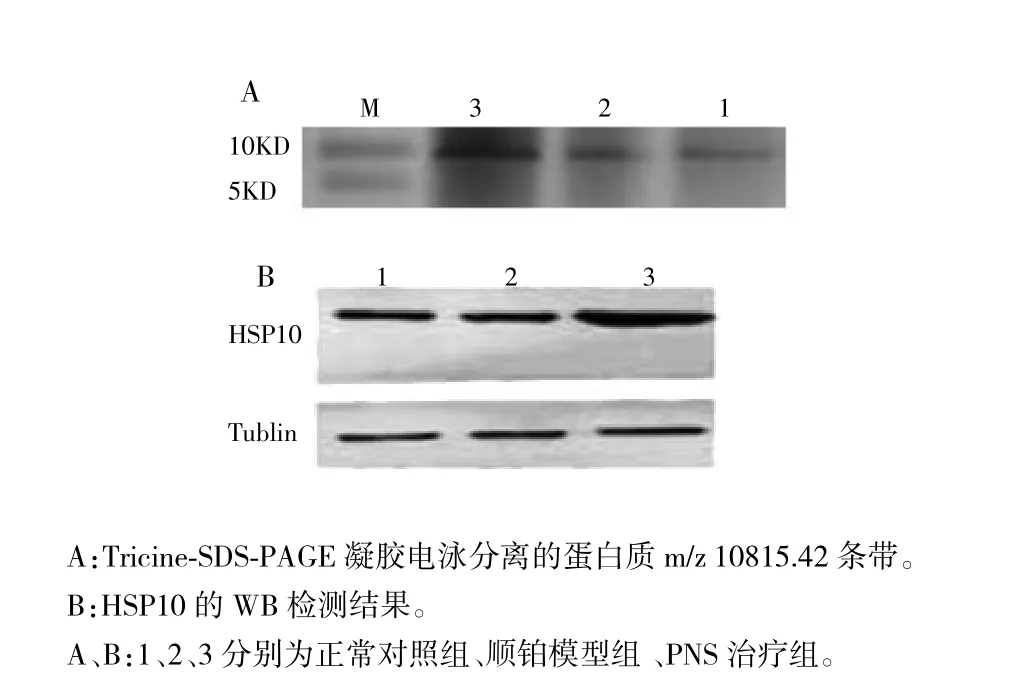
图3 各实验组大鼠肾组织中HSP10的电泳及WB实验结果
2.4 Western blot(WB)实验结果
WB实验结果证实,Tricine-SDS-PAGE凝胶电泳分离的目标蛋白质m/z 10815.42为蛋白质HSP10,而且PNS治疗组大鼠肾组织HSP10的表达高于顺铂模型组。见图3。
表1 正常对照组与顺铂模型组的部分肾组织差异表达的蛋白质(s)

表1 正常对照组与顺铂模型组的部分肾组织差异表达的蛋白质(s)
?
表2 顺铂模型组与PNS治疗组的部分肾组织差异表达的蛋白质(s)
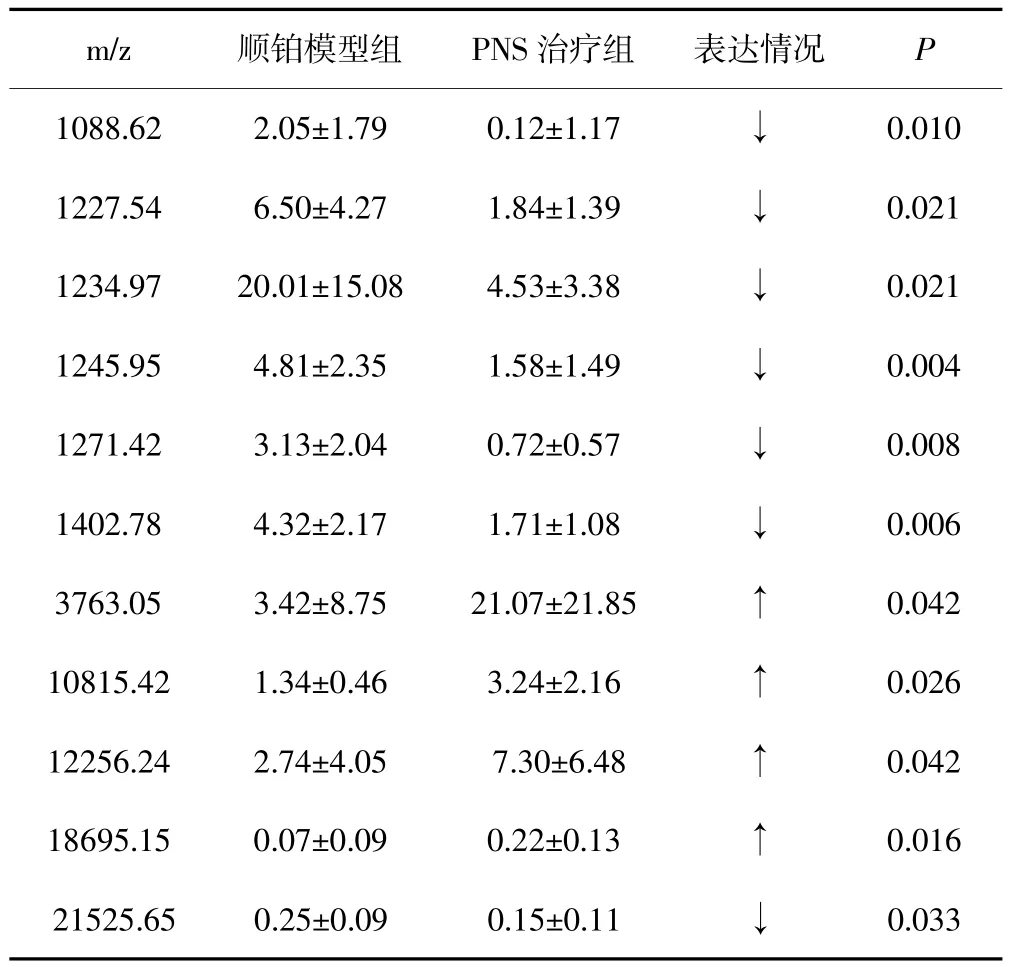
表2 顺铂模型组与PNS治疗组的部分肾组织差异表达的蛋白质(s)
?
表3 各实验组大鼠肾组织中共同存在的差异表达蛋白质(s)

表3 各实验组大鼠肾组织中共同存在的差异表达蛋白质(s)
*与正常对照组比较;#与顺铂模型组比较。
m/z 正常对照组 顺铂模型组 表达情况*P PNS治疗组 表达情况#P 1088.62 0.01±0.69 2.05±1.79 ↑ 0.019 0.12±1.17 ↓ 0.010 1227.54 1.75±1.09 6.50±4.27 ↑ 0.019 1.84±1.39 ↓ 0.021 1234.96 2.57±1.78 20.01±15.08 ↑ 0.037 4.53±3.38 ↓ 0.021 1402.78 0.86±1.73 4.32±2.17 ↑ 0.037 1.71±1.08 ↓ 0.006 12256.24 8.44±4.03 2.74±4.05 ↓ 0.026 7.30±6.48 ↑ 0.042 18695.15 0.28±0.05 0.07±0.09 ↓ 0.004 0.22±0.13 ↑ 0.016
3 讨论
顺铂肾损害的发生、发展是涉及多种机制[2,3]、多种信号途径的复杂过程,且伴随多种蛋白质的表达变化。PNS含有三七皂苷R1、人参皂苷Rg1、Rb1、Re等多种活性成分,具有抗氧化、抗增殖、促凋亡等多种药理作用。本课题组前期研究发现[8],PNS可能通过抗氧化损伤对顺铂肾损害起保护作用。另有报道,PNS可通过降低顺铂导致的DNA链间交联、DNA-蛋白交联和钙离子超载[4]等机制发挥预防顺铂肾毒性的作用。因此推测PNS对顺铂肾损害的保护作用可能涉及多种机制和位点。顺铂肾损害和PNS的保护作用均可体现在肾组织蛋白质种类、数量或性质的改变。
SELDI-TOF-MS技术为一种敏感、高通量的差异蛋白质组学的研究方法,由蛋白质芯片系统、质谱仪和分析软件构成,可选择性地捕获标本中与其特异性结合的蛋白质,为诊断、预防和治疗疾病提供重要线索[9]。本实验采用CM10蛋白芯片结合SELDI-TOFMS技术筛选顺铂肾损害大鼠肾组织差异表达的蛋白质,可以很好地检测到CM10芯片捕获的蛋白质质谱峰,蛋白质质谱峰主要集中在分子量20 000 Da以内,并在各实验组之间筛选出多个差异表达的蛋白质,说明SELDI-TOF-MS技术对筛选低分子量蛋白质有效、可行。
本实验对大鼠顺铂肾损害的肾组织筛选出差异表达蛋白质,这些差异表达蛋白质可能是顺铂损害肾脏的结果或者是导致肾脏损害的原因,亦可能是PNS保护顺铂肾脏损害的结果,或是通过改变这些蛋白质而发挥保护肾脏的作用。其中有6个共同的差异表达蛋白质在顺铂模型组较正常对照组的表达上调或下调,而PNS均能使其表达回调到接近正常对照组的水平。部分差异表达蛋白质的m/z相差小于100 Da,如表1中m/z分别为12 256.24、12 356.94、12 453.41等蛋白质,推测其来源、性质等相似,可能是同源蛋白。因此,对以上差异表达蛋白质进行分离、鉴定,了解其性质与作用,将有助于阐明顺铂肾损害和PNS保护作用的机制。
HSP在各种因素引起的肾损伤中发挥重要作用[10,11],包括肾缺血再灌注损伤、肾间质纤维化、糖尿病肾病等。HSP70在环孢素、庆大霉素诱导的急性肾损害早期大鼠肾组织的表达显著升高[12,13],可能与细胞启动自我保护的机制有关。另外,不少研究表明HSP与肾脏细胞线粒体功能密切相关[14,15]。HSP70可降低线粒体bax的积累,对缺血性急性肾损伤起到保护作用[10]。HSP10属于小分子HSP家族。HSP60和HSP10组合在维持线粒体的完整性和ATP产生的能力方面发挥重要作用[16]。目前尚未见HSP10在顺铂肾损害中作用的报道。本实验对顺铂肾组织病理检查发现,顺铂模型组肾小管上皮细胞的线粒体有明显损伤,PNS能减轻肾小管上皮细胞线粒体的损伤;肾组织差异表达蛋白质HSP10在PNS治疗组较顺铂模型组的表达上调2倍以上。综上所述,PNS是否通过上调HSP10对顺铂肾损害发挥保护作用,以及该蛋白质在其中的具体作用、调节机制等均有待进一步研究。
肾脏对红细胞的生成起重要作用。本实验中,血红蛋白β1亚基和血红蛋白β2亚基在顺铂模型组较正常对照组的表达上调。血红蛋白是由4个亚基通过共价键结合而成为α2β2结构的寡聚蛋白质,在生物体内起存储和运输氧气的作用,参与维持机体内环境的酸碱稳定。Johnson等[17]研究发现GSHPx.1基因缺陷的大鼠血红蛋白自动氧化率很低,但是产生活性氧的能力很强,这可能与超氧化物岐化酶的活性有关;血红蛋白中α1β1亚基和α1β2亚基的接合部位能明显影响血红蛋白的氧亲和力和协同氧化过程[18]。血红蛋白β1亚基、β2亚基与顺铂肾损害之间的关系有待进一步研究。
本实验采用CM10芯片结合SELDI-TOF-MS技术筛选差异表达蛋白质。由于不同类型的蛋白质芯片所捕获到的蛋白质可能有所不同,因此只采用一种类型的芯片筛选蛋白质,可能导致一些差异表达蛋白质丢失。同时,蛋白质芯片上的标本经过筛选差异表达蛋白质后,不能回收进行鉴定,因此筛选出来的差异表达蛋白质的性质、结构、功能等仍未明确,需要纯化鉴定和进行功能研究。另外,SELDI-TOF-MS技术对于筛选小分子的差异表达蛋白质很有效,与传统的二维电泳筛选技术对极小、极大及低丰度蛋白质等无法分离、鉴定可互补不足;但由于其筛选出的差异表达蛋白质多集中在20 000 Da以下,有的甚至在2 000 Da以下,且表达量低,在分离、纯化过程中容易损失,因此分离、鉴定工作难度增大[19]。有关方面值得深入研究和探讨。
综上,本实验结果表明,顺铂肾损害大鼠肾组织可伴随多种蛋白质的变化,这些差异表达的蛋白质可能与顺铂损害肾脏及PNS的保护作用有关。分离、鉴定这些差异表达蛋白质可为研究顺铂肾损害及PNS保护作用的机制提供实验佐证。
[1] 陈新谦,金有豫,汤光.新编药物学[M].第17版.北京:人民卫生出版社.2011:760.
[2] Sahu BD,Rentam KK,Putcha UK,et al.Carnosic acid attenuates renal injury in an experimental model of rat cisplatin-induced nephrotoxicity[J].Food Chem Toxicol,2011,49(12):3090-3097.
[3] Clark JS,Faisal A,Baliga R,et al.Cisplatin induces apoptosis through the ERK-p66shc pathway in renal proximal tubule cells[J].Cancer Lett,2010,297(2):165-170.
[4] Liu SJ,Zhou SW.Panax notoginseng saponins attenuated cisplatininduced nephrotoxicity[J].Acta Pharmacol Sin,2000,21(3):257-260.
[5] 李元青,马成杰,陈信义.三七活性成分抗肿瘤作用及其免疫学机制初探[J].北京中医药大学学报(中医临床版),2008,15(1):17-19.
[6] 刘丽丽,刘艳娥,房国涛.三七总皂苷逆转乳腺癌细胞MCF-7/ADM多药耐药的实验研究[J].时珍国医国药,2008,19(4):954-956.
[7] 魏伟,吴希美,李元健.药理实验方法学[M].第3版.北京:人民卫生出版社,2010:69-73.
[8] 席加喜,刘晓霞,杨玉芳,等.血栓通对顺铂肾损伤大鼠的肾功能和氧化指标的影响[J].中国实验方剂学杂志,2012,18(10):263-266.
[9] Lim JY,Cho JY,Paik YH,et al.Diagnostic application of serum proteomic patterns in gastric cancer patients by ProteinChip surfaceenhanced laser desorption/ionization time-of-flight mass spectrometry[J]. Int J Biol Markers,2007,22(4):281-286.
[10]Wang Z,Gall JM,Bonegio RG,et al.Induction of heat shock protein 70 inhibits ischemic renal injury[J].Kidney Int,2011,79(8):861-870.
[11] Patel AB,Robertson WG,Choong S,et al.Heat-shock protein 25 ameliorates calcium oxalate crystal-mediated oxidative stress in renal epithelial cells[J].BJU Int,2006,98(5):1094-1099.
[12]张鸿彦,赵达亚,孙玲娣.环胞霉素A诱导急性肾损伤大鼠肾脏热休克蛋白70的表达[J].哈尔滨医科大学学报,2007,41(2):136-139.
[13]张鸿彦,孙玲娣,赵达亚.庆大霉素诱导急性肾损伤大鼠肾脏热休克蛋白70的表达[J].实用儿科临床杂志,2007,22(5):333-335.
[14] Bruschi SA,Lindsay JG.Mitochondrial stress protein actions during chemically induced renal proximal tubule cell death[J].Biochem Cell Biol,1994,72(11-12):663-667.
[15] Yan LJ,Rajasekaran NS,Sathyanarayanan S,et al.Mouse HSF1 disruption perturbs redox state and increases mitochondrial oxidative stress in kidney[J].Antioxid Redox Signal,2005,7(3-4):465-471.
[16]Lin KM,Lin B,Lian IY,et al.Combined and individual mitochondrial HSP60 and HSP10 expression in cardiac myocytes protects mitochondrial function and prevents apoptotic cell deaths induced by simulated ischemia-reoxygenation[J].Circulation,2001,103(13):1787-1792.
[17] Johnson RM,Goyette G Jr,Ravindranath Y,et a1.Hemoglobin autoxidation and regulation of endogenous H2O2levels in erythrocytes[J]. Free Radic Biol Med,2005,39(11):1407-1417.
[18]Chang CK,Simplaceanu V,Ho C.Effects of amino acid substitutions at beta 131 on the structure and properties of hemoglobin:evidence for communication between alpha 1 beta 1-and alpha 1 beta 2-subunit interfaces[J].Biochemistry,2002,41(17):5644-5655.
[19] 杨晓丹,李巨.SELDI筛选绒癌耐氨甲喋呤细胞株耐药相关蛋白[J].中国医科大学学报,2011,40(1):45-47.
[2014-11-10收稿][2014-12-04修回][编辑 阮萃才]
Effect of Panax Notoginsenosides on renal proteins differentially expressed in rats experiencing cisplatin-induced nephrotoxicity
YANG Yu-fang△,LIU Hua-gang,XI Jia-xi,LIU Xin-wen(△Department of Pharmacy,The First Affiliated Hospital of Guangxi Medical University;Guangxi Medical University,Nanning 530021,P.R.China)
LIU Hua-gang.E-mail:hgliu@263.net
Objective To understand the effects of Panax Notoginsenosides(PNS)on renal proteins differentially expressed in rats experiencing cisplatin-induced nephrotoxicity.Methods Rats were randomly divided into three groups and treated with saline,cisplatin alone or cisplatin with PNS.At 10 days after treatment,renal tissue was examined for pathology,and levels of serum BUN,Scr,and urine NAG were determined.Renal proteins for which expression levels changed in response to cisplatin treatment were screened using SELDI-TOF-MS and identified using MALDI-TOF-MS/MS and Western blotting.Results We successfully created a rat model of cisplatin-induced nephrotoxicity,and PNS reduced the drug-induced damage.Mass spectrometry identified 20 renal proteins differentially expressed between the saline and cisplatin groups,as well as 18 proteins differentially expressed between the cisplatin and cisplatin+ PNS groups.Of these proteins,6 were up-or down-regulated by cisplatin treatment,and PNS returned their expression close to the levelsin the saline group.One of these proteins(m/z 10815.42)was identified as mitochondrial heat shock protein,while another(m/z 16021.67)was identified as hemoglobin subunit beta-1 and beta-2.Conclusions These differentially expressed renal proteins may mediate cisplatin-induced nephrotoxicity as well as the protective effects of PNS.Further studies should verify these leads and examine the cellular pathways involved.
Panax notoginseng saponins;Cisplatin-induced nephrotoxicity;Differentially expressed proteins;SELDI-TOF-MS;Mitochondrial heat shock protein
R282.7
A
1674-5671(2014)04-06
10.3969/j.issn.1674-5671.2014.04.07
国家自然科学基金资助项目(30850010、81260598)
刘华钢。E-mail:hgliu@263.net
