CTLA4.FasL免疫抑制效应及对肝前体细胞增殖分化潜能的影响
2014-06-28张晓刚
万 真,吕 毅,张晓刚
(西安交通大学医学院第一附属医院肝胆外科,先进外科技术与工程研究所,陕西西安 710061)
成体肝脏来源的肝前体细胞具有细胞体积小、增殖能力较强及可生成肝细胞和胆管上皮细胞等特点,可用于体内移植治疗终末期肝病[1]。移植的肝前体细胞可在受体内存活、定植,有效增殖并进一步分化为有功能活性的肝细胞[2]。不过,肝前体细胞表达主要组织相容性复合体Ⅰ类分子(major histocompatibility complex-I, MHC-Ⅰ),仍有较强的免疫原性,可诱发受体免疫排斥反应[3]。本实验构建了携带免疫调控基因CTLA4.FasL的慢病毒载体,评估CTLA4.FasL对肝前体细胞增殖活性及分化潜能的影响,并进一步研究负载CTLA4.FasL基因的小鼠肝前体细胞在单向混合淋巴细胞反应中抑制异种淋巴细胞增殖的作用。这可能为肝前体细胞移植的免疫排斥这一难题提供有效的解决途径。
1材料与方法
1.1实验用细胞、药品和主要试剂细胞系肝上皮样前体细胞(liver epithelial progenitor cells, LEPCs)由上海第二军医大学细胞生物学系胡以平教授提供[4],质粒GV261、pHelper 1.0和pHelper 2.0和293T细胞购自上海吉凯基因化学有限公司,携带CTLA4.FasL基因的pcDNA3.1(-)由本室冻存。Taqpolymerase、PrimeScript®RT Master Mix Perfect Real Time和SYBR®Premix ExTaqTMⅡ(TaKaRa公司);DMEM、RMPI 1640及胎牛血清(Hyclone公司);Trizol试剂和Lipofectamine 2000(Invitrogen公司);兔抗人FasL(Santa Cruz公司);Cell proliferation Reagent(WST-1)和Cell proliferation ELISA、Brdu(colorimetric)均为Roche公司;sFasL ELISA试剂盒(Raybiotech公司);淋巴细胞分离试剂(天津灏洋公司);台盼蓝、丝裂霉素C(mitomycinC, MMC)购自Sigma公司。
1.2实验动物SD大鼠,体质量200~300 g;C57BL/6小鼠,体质量20~25 g,均由西安交通大学医学院实验动物中心提供。饲养于SPF级实验室,自由进食饲料及水,实验操作经西安交通大学医学院第一附属医院伦理委员会审核通过。
1.3CTLA4.FasL的获取以携带CTLA4.FasL基因的质粒pcDNA3.1(-)为模板,扩增目的基因。设计、合成引物如下:CGGGTACCGGTCGCCACCATGGGTGTACTGCTCACAC和AGTCGCTAGCTT-AGAGCTTATATAAGCCGAAAAAC,下划线标记的分别是AgeⅠ和NheⅠ酶切位点。PCR反应条件是94 ℃变性5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环后,72 ℃延长10 min。将PCR产物在10 g/L琼脂糖凝胶电泳,预期可见961 bp大小的条带。切胶纯化后送TaKaRa公司测序,以排除碱基错配等变异的发生。
1.4携带CTLA4.FasL基因的慢病毒载体的制备将获得的目的基因片段CTLA4.FasL经AgeⅠ和NheⅠ双酶切后定向连接入线性化载体Lv-IRES-mCherry。取慢病毒包装的辅助质粒pHelper 1.0和pHelper 2.0,两者含有pol、VSG-G等基因以编码病毒特异性的酶和包膜蛋白,与重组病毒质粒使用Lipofectamine 2000共转染入293T细胞,转染8 h后更换为完全培养基,培养48 h后收集富含慢病毒颗粒的细胞上清液,纯化浓缩,-80 ℃长期保存。可得到携带目的基因的重组慢病毒载体Lv-CTLA4.FasL-IRES-mCherry,不携带目的基因的慢病毒空载体Lv-IRES-mCherry作为阴性对照组。针对慢病毒特异性WRPE元件设计引物(表1),利用RT-PCR法测定慢病毒滴度。

表1 RT-PCR引物序列
F:上游引物;R:下游引物。
1.5重组慢病毒载体体外感染LEPCsLEPCs细胞接种于含100 mL/L胎牛血清的DMEM培养液中,在37 ℃、50 mL/L CO2及饱和湿度的培养箱中培养。每1~2 d换液一次,3~4 d传代一次。接种生长良好的LEPCs细胞于6孔细胞培养板中,待完全贴壁后,换用含重组慢病毒颗粒的细胞培养液。调整慢病毒载体的用量,分别以MOI为1、5、10、20、100感染LEPCs细胞。在培养体系中,添加聚凝胺以增加感染效率。慢病毒感染5 d后,在荧光显微镜下观察比较各组细胞的活力和红色荧光蛋白mCherry的表达。倒置荧光显微镜200倍视野下计数被感染细胞及总细胞,随机选择5个视野。感染效率=(感染成功的细胞数/细胞总数)×100%。提取经慢病毒感染的LEPCs细胞的总蛋白行FasL蛋白印迹分析。
1.6ELISA法检测培养上清中融合蛋白CTLA4.FasL的浓度收集慢病毒感染后的细胞培养液,4 ℃ 400×g离心6 min去除细胞碎片,取上清经0.2 μm的无菌注射过滤器过滤,-20 ℃冻存。按照ELISA试剂盒说明进行操作,使用Bio-Tek Elx 800酶标仪检测,记录450 nm处的吸光度值。
1.7WST-1法检测细胞增殖活性未感染慢病毒的LEPCs细胞为LEPCs组;感染含CTLA4.FasL基因的慢病毒细胞为CTLA4.FasL-LEPC组;感染含mCherry基因的慢病毒细胞为mCherry-LEPCs组。3组细胞均以5×103细胞数/孔接种于96孔培养板中,每孔加入含 100 mL/L胎牛血清的DMEM培养液100 μL。培养24 h后每孔加入10 μL WST-1,继续培养4 h,振荡1 min以充分溶解结晶物,在酶标仪上读取450 nm波长处和690 nm波长处各孔吸光度值,计算两者之间的差值(A450 nm-A690 nm)。每组设3个平行样本,取各组值的均数表示细胞的增殖情况。
1.8RT-PCR法检测CK-19和c-Kit基因表达的变化收集3组细胞,用Trizol提取细胞总RNA并逆转录成cDNA,-20 ℃冻存。根据NCBI GenBank中提供的小鼠CK19和c-Kit基因序列设计引物,以β-actin为内参基因(表1)。使用TaKaRa SYBR®Premix ExTaqTMⅡ试剂盒,在Bio-Rad iQ5多色实时定量PCR检测系统中按三步法进行扩增。每组设3个复孔,实验结果重复3次。
1.9单向混合淋巴细胞反应无菌条件下切取大鼠和小鼠脾脏,用组织淋巴细胞分离液分离淋巴细胞。收集淋巴细胞,用含100 mL/L胎牛血清的RMPI 1640培养液重悬细胞并调整细胞浓度1×106/mL,台盼蓝染色检测淋巴细胞活性。以小鼠淋巴细胞为刺激细胞,大鼠淋巴细胞为反应细胞。给予刺激细胞25 μg/mL的MMC处理,37 ℃孵育30 min以抑制小鼠淋巴细胞的增殖能力。接种刺激细胞和反应细胞各100 μL于96孔培养板中,置于37 ℃、50 mL/L CO2及饱和湿度的培养箱中培养。
1.10Brdu法测定大鼠淋巴细胞的增殖在Brdu法中,利用5-氟脱氧尿嘧啶(5-bromo-deoxyuridine, Brdu)代替3H胸腺嘧啶标记合成的DNA,基于抗原Brdu的ELISA检测可灵敏、简便及安全地测定细胞合成DNA的能力,间接反映细胞的增殖情况。淋巴细胞共培养4 d后,每孔加入Brdu标记液孵育6 h,后经固定液、抗Brdu抗体工作液处理,加入反应底物,在370 nm和492 nm处测定吸光度值,以空白组调零,计算两者之间的差值。取LEPCs、mCherry-LEPCs和CTLA4.FasL-LEPCs细胞经50 μg/mL的MMC 37 ℃孵育1 h。PBS洗2次后以1×104细胞数/孔接种于96孔培养板中,待完全贴壁后再接种大鼠淋巴细胞和MMC处理的小鼠淋巴细胞,测定大鼠淋巴细胞的增殖情况。以大鼠淋巴细胞单独培养为阴性对照,测定各组大鼠淋巴细胞的增殖情况,以刺激指数(stimulation index, SI)表示:SI=A492 nm-A370 nm(实验组)/A492 nm-A370 nm(阴性对照组)。每组设3个复孔,实验结果重复3次。
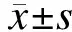
2结果
2.1CTLA4.FasL基因的PCR扩增PCR产物行10 g/L琼脂糖凝胶电泳,可见961 bp大小的条带(图1)。测序结果与GenBank中人CTLA4(序列接收号:BC074893)和FasL(序列接收号:BC017502)相比,碱基序列完全正确。
2.2构建携带CTLA4.FasL的重组慢病毒载体同源重组法得到复制缺陷性慢病毒载体Lv-CTLA4.FasL-IRES-mCherry和空白慢病毒载体Lv-IRES-mCherry。纯化、浓缩慢病毒液,RT-PCR测得其滴度为2×108TU/mL。
2.3Lv-CTLA4.FasL-IRES-mCherry感染LEPCs在MOI为1、5和10时,表达红色荧光细胞占总细胞比例逐渐增高,荧光强度逐渐增强,细胞形态无明显变化。不过,继续增加慢病毒用量,MOI增大为20和100时,大量LEPCs死亡,细胞增殖停止,提示高慢病毒用量或是目的蛋白的高表达对细胞有强烈的毒性作用。在感染体系中添加5 μg/mL聚凝胺,MOI为10时,感染效率可高达90%(图2)。因此,在此后的实验中,均采用这一条件下慢病毒感染的LEPCs细胞。Western blot检测显示,CTLA4.FasL蛋白可在CTLA4.FasL-LEPCs细胞中有效表达,而在LEPCs和mCherry-LEPCs内无表达(图3)。
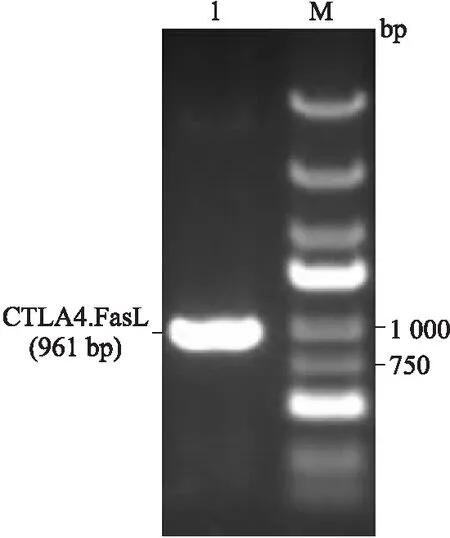
图1 CTLA4.FasL基因的PCR扩增
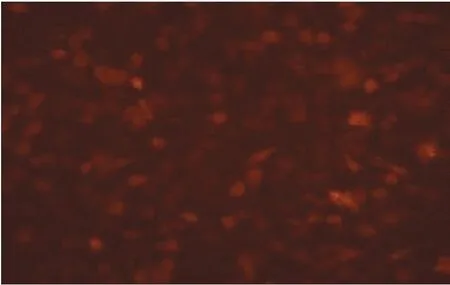
图2 红色荧光蛋白在LEPCs内的表达
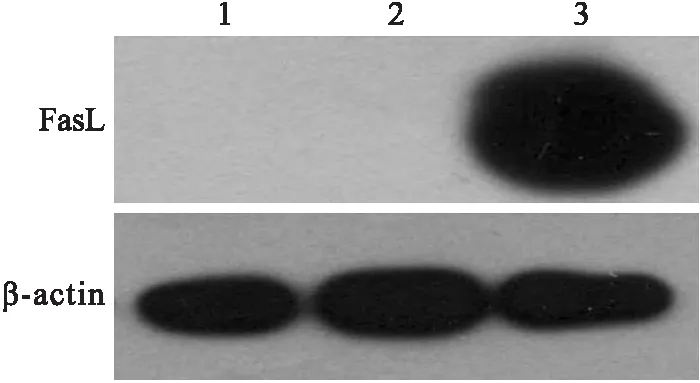
图3 Western blot 检测重组慢病毒载体感染LEPCs后CTLA4.FasL的表达
2.4LEPCs细胞培养上清液CTLA4.FasL浓度的测定慢病毒Lv-CTLA4.FasL-IRES-mCherry感染LEPCs细胞培养上清液中CTLA4.FasL质量浓度可达(0.72±0.10)μg/mL,可在-20 ℃长期冻存。mCherry-LEPCs和LEPCs细胞培养上清液不能检测到CLTA4.FasL的表达。
2.5重组慢病毒感染后LEPCs增殖活性及分化潜能的改变WST-1实验结果显示,CTLA4.FasL-LEPCs 的A450 nm-A690 nm值为1.361±0.073,而mCherry-LEPCs和LEPCs则分别为1.369±0.078、1.383±0.117。单因素方差分析示3组LEPCs细胞增殖活性无统计学差异(F=0.517,P=0.603)。这表明MOI=10时,慢病毒感染及CLTA4.FasL的表达对LEPCs的增殖能力无明显损害作用。以β-actin基因mRNA表达水平为参照,利用2-△t法计算CK19和c-Kit基因的相对表达量(表2)。CK19和c-Kit mRNA的表达在慢病毒Lv-CTLA4.FasL-IRES-mCherry和Lv-IRES-mCherry感染前后均无明显变化(F=2.472,P=0.165;F=0.305,P=0.748)。
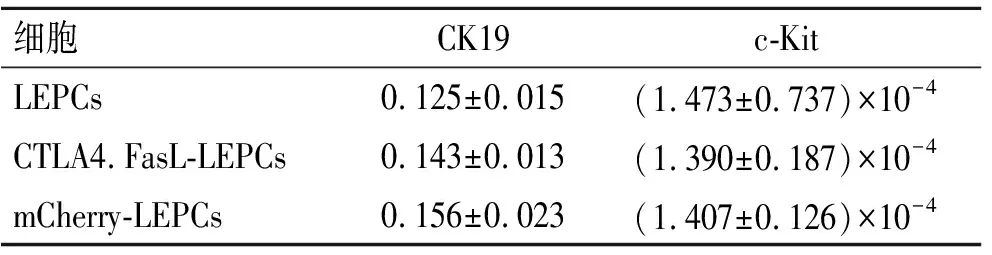
表2 RT-PCR检测3组LEPCs细胞CK19和c-Kit mRNA的表达
2.6CTLA4.FasL对大鼠淋巴细胞增殖的影响小鼠淋巴细胞与大鼠淋巴细胞共培养96 h后,大鼠淋巴细胞显著增殖,刺激指数为6.444±0.424。在异种淋巴细胞共培养(mixed lymphocyte culture, MLC)体系中接种CTLA4.FasL-LEPCs细胞,大鼠淋巴细胞增殖受抑制,刺激指数减少至2.337±0.266(P<0.05)。而LEPCs和mCherry-LEPCs细胞无此免疫抑制效应(图4)。
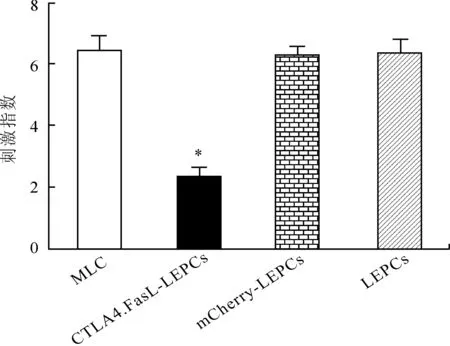
图4 3组LEPCs细胞对大鼠淋巴细胞增殖的影响
3讨论
随着干细胞生物学表型的鉴定及分离纯化技术的进步,肝前体细胞移植用于终末期肝病的治疗显示了愈发诱人的前景。本实验中用到的肝前体细胞系由接受倒千里光碱腹腔注射联合2/3肝切除的小鼠肝脏分离、纯化而来。这类上皮样非实质细胞在门管区活化、增殖,形成管状结构并向肝小叶中延伸,可进一步生成嗜碱性肝细胞团和胆管结构。体外培养条件下表达CK19、Thy-1、c-Kit等干细胞相关基因,可诱导生成肝细胞和胆管上皮细胞。因此,被命名为肝上皮样前体细胞(liver epithelial progenitor cells, LEPCs)。较原代肝细胞体外培养多需要3D培养技术及添加特殊的生长因子,培养数周内其表型、功能逐步丧失,LEPCs可在单层贴壁培养条件下大量扩增,同时保留双向分化潜能。另外,LEPCs多次传代后仍保持正常核型38+XY,种植入裸鼠皮下未见肿瘤形成,提示在无致癌因素存在的情况下LEPCs不会恶性转化为肿瘤起始细胞[5]。LEPCs是肝干细胞生物学特性及移植研究的有力工具。
为支持肝功能,促进肝损伤的修复,需要有足够数量的肝前体细胞在受体内长期有效地植入,并分化为有代谢、合成等功能的肝细胞[6]。不过,植入分化过程及新生成的肝细胞必将诱发强烈的免疫排斥反应,导致移植物功能受损甚至移植物丢失[7]。细胞毒T淋巴细胞相关抗原(cytotoxic T lymphocyte associate antigen-4, CTLA4)是T细胞下调分子,在建立外周免疫耐受中发挥着重要作用。LAN等[8]发现,较阴性对照组,在移植18周内CTLA4.Ig基因修饰的人源肝前体细胞能在受体小鼠肝脏内显著存活、增殖。活化T细胞上调表达Fas受体,与FasL结合后可启动凋亡途径以限制免疫应答。而CTLA4.FasL分子含有CTLA4和FasL双功能域,能在抑制初始T细胞的活化增殖的同时诱导活化的T细胞凋亡,其效应远远高于单个免疫分子或两者联合应用[9-11]。本实验中Lv-CTLA4.FasL-IRES-mCherry感染的LEPCs细胞能强有力地抑制单向混合淋巴细胞共培养中大鼠淋巴细胞的增殖,表明在异种淋巴细胞的活化增殖中CTLA4.FasL同样具有负性调控作用。而LEPCs细胞无此抑制效应,提示不同于间充质干细胞[12],LEPCs本身不能表达免疫调节分子从而抑制淋巴细胞的活化增殖。
FasL分子与其细胞膜表面受体Fas结合后能启动细胞凋亡途径,有着潜在的细胞毒性[13-14]。不过,CTLA.FasL分子将FasL胞外区代之以CTLA4胞外区,通过与B7分子的高效结合增加其对活化T淋巴细胞的靶向性,这能极大地减轻其细胞毒性作用[15]。在本实验中,我们评估了Lv-CTLA4.FasL-IRES-mCherry感染对LEPCs的增殖活性及分化潜能的影响。重组慢病毒载体可有效地感染LEPCs(感染率>90%),CTLA4.FasL蛋白可有效表达。WST-1和RT-PCR实验结果示,在慢病毒载体感染前后LEPCs增殖活性和干细胞相关基因CK19和c-Kit的表达量无明显变化。
总之,本研究成功构建了携带CTLA4.FasL基因的慢病毒载体,研究了CLTA4.FasL对LEPCs细胞的增殖活性及分化潜能的影响,探索了负载CLTA4.FasL基因的LEPCs在异种混合淋巴细胞反应中抑制大鼠淋巴细胞增殖的作用,为进一步的肝前体细胞移植动物实验奠定了基础。
参考文献:
[1] DOLLE L, BEST J, MEI J, et al. The quest for liver progenitor cells: a practical point of view[J]. J Hepatol, 2010, 52(1):117-129.
[2] DUNCAN AW, DORRELL C, GROMPE M. Stem cells and liver regeneration[J]. Gastroenterology, 2009, 137(2):466-481.
[3] LEE JH, PARK HJ, KIM YA, et al. Differentiation and major histocompatibility complex antigen expression in human liver-derived stem cells[J]. Transpl Proc, 2012, 44(4):1113-1115.
[4] LI WL, SU J, YAO YC, et al. Isolation and characterization of bipotent liver progenitor cells from adult mouse[J]. Stem Cells, 2006, 24(2):322-332.
[5] WU K, DING J, CHEN C, et al. Hepatic transforming growth factor beta gives rise to tumor-initiating cells and promotes liver cancer development[J]. Hepatology, 2012, 56(6):2255-2267.
[6] ZHANG W, TUCKER-KELLOGG L, NARMADA BC, et al. Cell-delivery therapeutics for liver regeneration[J]. Adv Drug Deliv Rev, 2010, 62(7-8):814-826.
[7] WALKER JP, BUMGARDNER GL. Hepatocyte immunology and transplantation: current status and future potential[J]. Curr Opin Organ Transplant, 2005, 10(2):67-76.
[8] LAN F, MA X, LIU Y, et al. Adenovirus-mediated CTLA4Ig gene transfer improves the survival of grafted human hepatic progenitors in mouse liver[J]. Transpl Proc, 2009, 41(5):1862-1864.
[9] ZHANG W, WANG F, YAN J, et al. Design, expression and characterization of a novel coexpression system of two antiarthritic molecules[J]. Appl Microbiol Biotechnol, 2013, 97(14):6301-6314.
[10] ZHANG W, WANG B, WANG F, et al. CTLA4-FasL fusion product suppresses proliferation of fibroblast-like synoviocytes and progression of adjuvant-induced arthritis in rats[J]. Mol Immunol, 2012, 50(3):150-159.
[11] 万真,吕毅,严小鹏,等. CTLA4.FasL双功能融合基因真核表达载体的构建与表达[J]. 细胞与分子免疫学杂志,2012,28(2):167-169.
[12] GAO K, CHEN Y, WEI L, et al. Inhibitory effect of mesenchymal stem cells on lymphocyte proliferation[J]. Cell Biochem Funct, 2008, 26(8):900-907.
[13] GUY CS, WANG J, MICHALAK TI. Hepatocytes as cytotoxic effector cells can induce cell death by CD95 ligand-mediated pathway[J]. Hepatology, 2006, 43(6):1231-1240.
[14] ASKENASY N, YOLCU ES, YANIV I, et al. Induction of tolerance using Fas ligand: a double-edged immunomodulator[J]. Blood, 2005, 105(4):1396-1404.
[15] JIN Y, QU A, WANG GM, et al. Simultaneous stimulation of Fas-mediated apoptosis and blockade of costimulation prevent autoimmune diabetes in mice induced by multiple low-dose streptozotocin[J]. Gene Ther, 2004, 11(12):982-991.
