锌指蛋白185对人胶质瘤细胞迁移的影响*
2014-06-28郑全辉
陆 斌 郑全辉
锌指蛋白185对人胶质瘤细胞迁移的影响*
陆 斌①郑全辉②
目的:探讨锌指蛋白185(zinc finger protein 185,ZNF185)在人胶质瘤细胞迁移中的作用。方法:Western blot检测ZNF185在神经胶质瘤及瘤旁正常组织的蛋白表达,克隆ZNF185基因转染人胶质瘤细胞,免疫荧光染色检测ZNF185的细胞定位,细胞划线和Transwell小室法检测ZNF185蛋白对细胞迁移的影响。结果:与瘤旁正常脑组织相比,ZNF185在人胶质瘤组织和细胞系中的表达显著降低;ZNF185蛋白主要分布于人胶质瘤细胞的细胞质、细胞膜,并与肌动蛋白纤维共定位;过表达ZNF185显著抑制人胶质瘤细胞的迁移。结论:ZNF185通过结合肌动蛋白纤维发挥抑制人胶质瘤细胞迁移的作用。
锌指蛋白 神经胶质瘤 细胞迁移
胶质瘤是神经系统最常见的原发性肿瘤,严重危害人类健康。恶性脑胶质瘤形成的早期具有较强的侵袭和弥散能力,即使手术全切瘤组织后,仍不能避免其在术腔边缘复发。目前对胶质瘤发生和发展的分子机制仍缺乏深入了解。近年分子遗传学研究表明,多种与细胞增殖、分化相关基因的表达异常在胶质细胞瘤的发生、发展过程中发挥重要作用[1-2]。锌指蛋白185(zinc finger protein 185,ZNF185)是一种c端含有LIM(Lin-1、Is1.1和nec-3)结构域的蛋白,其编码基因包括脑部在内的人体多种组织中表达,并发挥广泛的抑癌基因作用[3-5]。然而,对于ZNF185是否在人脑胶质细胞瘤的发生、发展过程中发挥作用尚不明确。本研究检测ZNF185在人脑胶质瘤和瘤旁正常组织的表达差异,探讨其在胶质瘤细胞中的细胞定位和对细胞迁移的影响,以期为深入了解胶质细胞瘤的发生和发展机制提供线索。
1 材料与方法
1.1 材料
人脑胶质细胞瘤及瘤旁正常组织取自32例自2008年1月至2014年1月于唐山市工人医院就诊,经病理确诊为胶质瘤患者的冻存组织标本。其中男性20例,女性12例,年龄15~67岁,中位年龄38.5岁。人胶质瘤细胞系SF767由本实验室冻存。DMEM细胞培养液、胎牛血清(FBS)购自美国GIBCO公司;TRIzol试剂盒、Lipofactamine 2000购自美国Invitrogen公司;各种限制性核酸内切酶、T4 DNA连接酶和反转录试剂盒购自日本TaKaRa公司;质粒抽提试剂盒和胶回收试剂盒购自美国Axygen公司;兔抗人ZNF185一抗、兔抗人actin一抗、HRP羊抗兔二抗购自北京博奥森公司。pEGFPC2绿色荧光蛋白表达质粒由中国科学院动物研究所赵勇研究员提供;蛋白提取试剂盒和Bio-Rad蛋白浓度测定试剂盒购自北京天恩泽公司,引物由上海生物工程服务公司合成。氨基糖苷类抗生素G418、Hoechst、Phalloidin-TRITC购自Sigma公司。Transwell小室购自美国Corning公司。
1.2 方法
1.2.1 Western blot分别混合人脑胶质细胞瘤和瘤旁正常组织(5例/组),提取组织蛋白及胶质瘤细胞系SF767总蛋白,测定蛋白浓度。各取10 μg进行SDS-PAGE胶电泳。电泳后将蛋白电转(4℃、恒流300 mA、2 h)至硝酸纤维素膜(NC)上,然后将NC膜在含100 g/L脱脂奶粉的TBST中室温封闭2 h,加兔抗人ZNF185一抗(1∶1 000)4℃过夜,TBST洗去未结合一抗,再加HRP羊抗兔IgG二抗(1∶5 000)室温作用1 h,TBST冲洗后加底物反应3 min,暗室曝光。
1.2.2 ZNF185 cDNA克隆 瘤旁正常组织总RNA提取和反转录按照试剂盒说明书进行。PCR采用Pfx高保真DNA聚合酶和下列引物:上游:5'-GGAATTCA TGAGTATCTCAGCTCTTG-3';下游:5'-ACGCGTCG ACTAGAAGAGCTTCTCATAGC-3'。上、下游引物分别加入EcoRI/SalI酶切位点。反应条件:94℃2 min,然后94℃30 s,58℃45 s,72℃延伸1 min;30个循环,最后72℃孵育10 min,PCR产物胶回收并纯化。EcoRI/SalI双酶切PCR产物和pEGFPC2质粒,回收纯化酶切产物,并利用T4 DNA Ligase将其连接。转化,挑选克隆进行序列测定。
1.2.3 细胞培养和转染 人胶质瘤细胞系SF767采用DMEM培养基,10%胎牛血清常规培养。表达ZNF185和空载体绿色荧光蛋白质粒转染采用Lipofactamine 2000,按操作说明进行。为获得稳定转染ZNF185的细胞,SF767细胞在转染24 h后,1∶2分离培养过夜,加入G418(600 mg/mL)筛选抗性克隆。选择培养1个月后,采用流式细胞仪分选阳性细胞,分别命名为EGFPC2-ZNF185和EGFPC2,常规培养。
1.2.4 免疫荧光染色 在涂布纤维黏连蛋白(10 mg/mL)的玻片上培养EGFPC2-ZNF185和EGFPC2转染的SF767细胞,PBS冲洗,4%多聚甲醛中固定20 min,然后用0.1%的Triton X-100/PBS透膜5 min。采用Hoechst进行细胞核染色,Phalloidin-TRITC(1∶40)标记肌动蛋白纤维。荧光显微镜观察ZNF185在细胞内的定位和与肌动蛋白纤维的结合。
1.2.5 细胞划线法检测细胞迁移 分别将EGFPC2-ZNF185和EGFPC2空载体稳定转染的SF767细胞接种24孔板,2×105个细胞/孔。在孔内细胞汇合度>90%时,用灭菌200 μL加样器枪头在垂直于孔背面的横线处划痕标记,采用荧光显微镜和Image J 1.48u软件观察和测量划痕宽度,每1个视野测量3处不同位点。48 h后,采用同样方法测量细胞划痕宽度,根据2次划痕宽度的差值判断细胞迁移能力。迁移率=(0 h划线宽度-48 h划线宽度)/0 h划线宽度×100%。
1.2.6 Transwell小室检测细胞迁移 实验分为EGFPC2-ZNF185和EGFPC2空载体转染组。消化每组SF767细胞,无血清培养基洗涤3次,调整细胞浓度为2×106/mL。分别取每组细胞悬液100 μL加入Transwell上室,下室加500 μL完全培养基,每组细胞设3个复孔,37℃、5%CO2孵育24 h,弃培养基,棉签轻擦拭上室细胞。取出Transwell用PBS洗涤2次,4%多聚甲醛固定10 min,倒置,风干,用0.1%结晶紫染色25 min,PBS洗涤3次,再用棉签轻擦净上室细胞,倒置显微镜下每个样本随机计数5个视野的细胞数,取均数作为迁移细胞数,实验重复3次。迁移抑制率=(EGFPC2转染组穿膜细胞数-EGFPC2-ZNF185转染组穿膜细胞数)/EGFPC2转染组穿膜细胞数×100%。
1.3 统计学处理
2 结果
2.1 ZNF185在人脑胶质瘤细胞中表达水平变化
Western blot检测瘤旁正常组织和人脑胶质瘤及胶质瘤细胞系SF767中ZNF185的表达,发现与瘤旁正常组织相比,ZNF185在人胶质瘤及胶质瘤细胞系SF767中的表达分别降低66.91%和63.24%(P<0.05,图1)。
2.2 ZNF185基因克隆
从手术切除的胶质瘤旁正常组织提取总RNA,反转录成cDNA后采用ZNF185基因特异引物扩增,扩增产物克隆至pEGFPC2载体,测序分析表明,克隆cDNA包含全长ZNF185编码序列。此序列羧基端含有2个锌指结构组成的LIM结构域,氨基端为肌动蛋白骨架结合结构域(ATD)(图2)。
2.3 ZNF185蛋白的细胞定位分析
分别将编码ZNF185蛋白的EGFPC2-ZNF185质粒和空载体EGFPC2质粒转染人胶质瘤细胞SF767,同时采用Hoechst染细胞核,荧光显微镜观察ZNF185的细胞定位。EGFPC2质粒表达绿色荧光蛋白,在细胞核和细胞质均分布;而EGFPC2-ZNF185质粒编码的ZNF185-绿色荧光蛋白融合蛋白,主要分布于细胞质和细胞膜(图3);进一步采用Phalloidin-TRITC红色荧光标记肌动蛋白纤维,发现空载体EGFPC2编码的绿色荧光蛋白与肌动蛋白染色分离,而ZNF185-绿色荧光蛋白与肌动蛋白染色重叠,表明ZNF185在细胞内与肌动蛋白纤维结合(图3)。
2.4 过表达ZNF185对SF767细胞迁移的影响
肌动蛋白纤维是重要的细胞骨架蛋白,参与细胞形态的维持和细胞的运动。ZNF185在SF767细胞中与肌动蛋白结合,提示ZNF185可能调控SF767细胞的迁移。为此,本研究分别将EGFPC2空载质粒和EGFPC2-ZNF185质粒转染SF767细胞,经G418筛选后获得稳定转染细胞株。Western blot检测显示,转染EGFPC2-ZNF185质粒细胞与转染空载质粒细胞相比,ZNF185的表达显著增加(图4A)。采用细胞划线法检测过表达ZNF185对SF767细胞迁移的影响,发现在细胞划线48 h后,转染EGFPC2-ZNF185质粒SF767细胞的迁移率为47.88%,而转染EGFPC2空载质粒细胞的迁移率为63.34%,二者相比降低15.46%,迁移抑制率达24.4%(P<0.05,图4B,4C)。近一步采用Transwell小室检测过表达ZNF185对SF767细胞迁移的影响,发现转染EGFPC2-ZNF185的SF767穿膜细胞数较转染EGFPC2空载质粒SF767的穿膜细胞数显著减少,迁移抑制率达31.37%(P<0.05,图4D,表1)。

图1 Western blot检测ZNF185的表达Figure 1 Western blot detection of ZNF185 expression

图2 ZNF185表达质粒的构建Figure 2 Construction of ZNF185 expression plasmid from normal human brain tissues
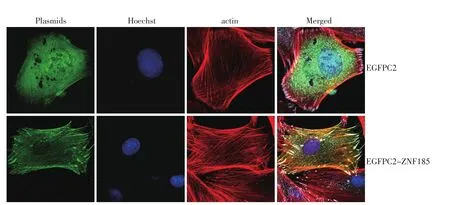
图3 荧光显微镜观察ZNF185在SF767细胞中的定位及与肌动蛋白actin的结合Figure 3 Immunofluorescence detection of ZNF185 cellular location and its interaction with actin filaments in SF767 cells
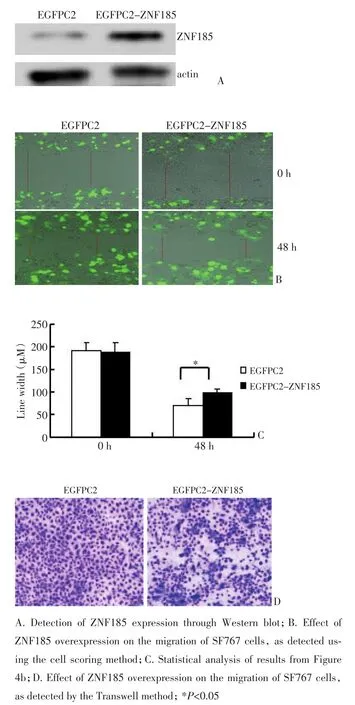
图4 过表达ZNF185对SF767细胞迁移的影响Table 4 Effects of ZNF185 overexpression on the migration of SF767 cells
表1 Transwell小室检测过表达ZNF185对SF767细胞迁移的影响 (n=3±s)Table 1 Effect of ZNF185 overexpression on the migration of SF767 cells (n=3,±s)
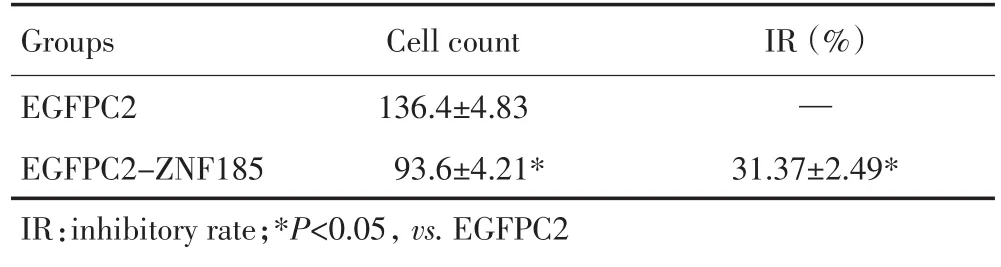
表1 Transwell小室检测过表达ZNF185对SF767细胞迁移的影响 (n=3±s)Table 1 Effect of ZNF185 overexpression on the migration of SF767 cells (n=3,±s)
Cell count 136.4±4.83 93.6±4.21* IR(%)—31.37±2.49* Groups EGFPC2 EGFPC2-ZNF185 IR:inhibitory rate;*P<0.05,vs.EGFPC2
3 讨论
人脑胶质瘤是神经系统常见的肿瘤,约占颅内原发肿瘤的40%~60%,恶性胶质瘤的预后相对较差。胶质母细胞瘤1年生存率约30%,而5年的生存率不足5%[6]。研究表明胶质瘤的发生和发展与多种癌基因的异常表达增加和(或)抑癌基因的表达降低有关[7]。然而对其发生、发展的分子机制仍缺乏全面了解。因此进一步寻找与胶质瘤发生、发展关系密切的新基因并深入探索其功能,对于设计合理的治疗药物及判断预后,进一步提高胶质瘤的治疗水平具有重要意义。
锌指蛋白(ZNF)是一类含Zn2+离子并具有手指状结构域的蛋白质,由于其自身的结构特点,可以选择性地结合特异的靶结构,使锌指蛋白在基因的表达调控、细胞分化、胚胎发育等生命过程中发挥重要作用。ZNF185由于其羧基端含有2个锌指结构组成的LIM结构域,又称LIM结构域蛋白,ZNF185在人类多种组织表达,前列腺组织表达最高,骨髓、外周血、脑、肺、肾等组织也有较高表达。有趣的是在相应的肿瘤如前列腺癌、白血病、肺癌等组织中,ZNF185的表达显著降低,并且与癌症的严重程度和转移程度呈正比[3-5,8]。
目前尚不明确ZNF185是否在人胶质瘤的发生和发展过程中发挥作用。本研究发现,与瘤旁正常脑组织相比,ZNF185在人脑胶质瘤组织和细胞系中表达降低,表明ZNF185发挥较普遍的抑癌基因功能。大量LIM结构域蛋白不仅具有调控细胞增殖和分化功能,也可通过与细胞骨架蛋白或细胞外基质成分相互作用,调节细胞的变形、运动、黏附及信号转导功能[9]。通过ZNF85表达质粒的构建及测序,发现ZNF185蛋白氨基端有一个肌动蛋白结合结构域(ATD),而免疫荧光染色结果进一步证实ZNF185可与细胞肌动蛋白纤维结合。由于胶质瘤是一种具有高局部侵袭性和增殖性的肿瘤,同时细胞肌动蛋白纤维骨架系统在维持细胞形态以及肿瘤细胞迁移、侵袭过程中发挥作用。为此,本研究采用细胞划线和Transwell小室两种方法检测ZNF185对胶质瘤细胞迁移的影响,尽管结果存在一定差异,但二者均显示过表达ZNF185对SF767细胞的迁移具有显著抑制作用。
LIM蛋白参与调控肿瘤细胞的迁移和侵袭。Xu等[10]报道上调FHL1(four and a half LIM domains 1)的表达可显著抑制胃癌MKN45细胞的迁移和侵袭。Liu等[11]发现LHX6(LIM homeobox domain 6)在肺癌组织中表达降低,而过表达LHX6则显著抑制肺癌95D和H358细胞的存活和迁移。一些在肿瘤细胞中表达增加的LIM蛋白如LIMD2、LIMK1促进肿瘤细胞的迁移和侵袭[12-13]。可见,LIM蛋白对肿瘤细胞迁移和侵袭的影响与其抑癌或癌基因功能的发挥密切相关。ZNF185在人脑胶质瘤细胞中具有抑癌基因功能,这与其发挥抑制肿瘤细胞迁移的作用一致。另外,研究显示多种蛋白如Pten、Plex-B3以及RhoGTP酶系统可通过调节肌动蛋白纤维的聚合或定位影响胶质瘤细胞的迁移[14-16]。对于ZNF185如何通过细胞肌动蛋白纤维抑制人脑胶质瘤细胞的迁移,其分子机制和信号途径目前仍不清楚,有待在今后实验中逐步解决。
总之,本研究提示锌指蛋白ZNF185在人脑胶质瘤细胞中发挥抑癌基因的作用,过表达ZNF185可显著抑制胶质瘤细胞的迁移,其抑制机制可能与ZNF185与肌动蛋白纤维的相互作用有关。研究结果为寻找针对人脑胶质瘤新的治疗靶点提供了线索。
1 Melin B,Jenkins R.Genetics in glioma:lessons learned from genome-wide association studies[J].Curr Opin Neurol,2013,26(6):688-692.
2 Xu QF,Li LC,Yao X,et al.The role of IDH1 mutation in gliomas-A review[J].Chin J Clin Oncol,2012,39(18):1836-1839.[徐庆福,李立超,姚 雪,等.IDH1基因突变在脑胶质瘤中的研究进展[J].中国肿瘤临床,2012,39(18):1836-1839.]
3 Zhang JS,Gong A,Young CY.ZNF185,an actin-cytoskeleton-associated growth inhibitory LIM protein in prostate cancer[J].Oncogene,2007,26(1):111-122.
4 Medina PP,Carretero J,Ballestar E,et al.Transcriptional targets of the chromatin-remodelling factor SMARCA4/BRG1 in lung cancer cells[J].Hum Mol Genet,2005,14(7):973-982.
5 Zheng QH,Zhang AH,Zheng AH,et al.DNA methylation regulates chronic myeloid leukemia cell proliferation through ZN185[J]. Progress in Biochemistry and Biophysics,2013,40(1):64-71.[郑全辉,张爱红,郑爱华,等.DNA甲基化通过锌指蛋白185调控慢性粒细胞白血病细胞的增殖[J].生物化学与生物物理进展,2013,40(1):64-71.]
6 Sun JJ,Wang ZY.Local treatment of malignant glioma[J].National Medical Journal of China,2005,85(20):1438-1439[孙建军,王振宇.恶性脑胶质瘤的局部治疗进展[J].中华医学杂志,2005,85(20):1438-1439.]
7 Ostrom Q,Cohen ML,Ondracek A,et al.Gene markers in brain tumors:what the epileptologist should know[J].Epilepsia,2013,54 (9):25-29.
8 Vanaja DK,Cheville JC,Iturria SJ,et al.Transcriptional silencing of zinc finger protein 185 identified by expression profiling is associated with prostate cancer progression[J].Cancer Res,2003,63(14):3877-3882.
9 Zheng Q,Zhao Y.The diverse biofunctions of LIM domain proteins:determined by subcellular localization and protein-protein interaction[J].Biol Cell,2007,99(9):489-502.
10 Xu Y,Liu Z,Guo K.Expression of FHL1 in gastric cancer tissue and its correlation with the invasion and metastasis of gastric cancer [J].Mol Cell Biochem,2012,363(1-2):93-99.
11 Liu WB,Jiang X,Han F,et al.LHX6 acts as a novel potential tumour suppressor with epigenetic inactivation in lung cancer[J].Cell Death Dis,2013,24(4):e882.
12 Peng H,Talebzadeh-Farrooji M,Osborne MJ,et al.LIMD2 is a small LIM-only protein overexpressed in metastatic lesions that regulates cell motility and tumor progression by directly binding to and activating the integrin-linked kinase[J].Cancer Res,2014,74 (5):1390-1403.
13 Chen Q,Jiao D,Hu H,et al.Downregulation of LIMK1 level inhibits migration of lung cancer cells and enhances sensitivity to chemotherapy drugs[J].Oncol Res,2013,20(11):491-498.
14 Gont A,Hanson JE,Lavictoire SJ,et al.PTEN loss represses glioblastoma tumor initiating cell differentiation via inactivation of Lgl1 [J].Oncotarget,2013,4(8):1266-1279.
15 Li X,Law JW,Lee AY.Semaphorin 5A and plexin-B3 regulate human glioma cell motility and morphology through Rac1 and the actin cytoskeleton[J].Oncogene,2012,31(5):595-610.
16 Khalil BD,El-Sibai M.Rho GTPases in primary brain tumor malignancy and invasion[J].J Neurooncol,2012,108(3):333-339.
(2014-04-18收稿)
(2014-07-08修回)
(本文编辑:邢颖)
Effect of Zinc finger protein 185 on the migration of human glioma cells
Bin LU1,Quanhui ZHENG2
Quanhui ZHENG;E-mail:zhqhdlp@sohu.com
1Department of Neurosurgery,Tangshan Worker's Hospital,Tangshan 063000;2College of Basic Medicine,Hebei United University,Tangshan 063000,China.
This work was supported by the Natural Science Foundation of Hebei Province(No.H2013209019)and the Foundation of Tangshan Science and Technology Bureau(No.13130290z).
Objective:To explore the effect of Zinc finger protein 185(ZNF185)on the migration of human gliocytoma cells.Methods:ZNF185 protein expression in human gliocytoma and its adjacent normal tissues was detected through Western blot.The ZNF185 gene was cloned and transfected into the human gliocytoma cell line SF767.ZNF185 cells were located through immunofluorescence staining,and cell migration was analyzed using the cell scoring method.Results:CZNF185 protein expression was lower in the human gliocytoma cell line than in normal para-neoplastic tissues.ZNF185 protein was mainly expressed in the cytoplasm and cell membrane of the human gliocytoma cells and was co-located with F-actin.ZNF185 overexpression repressed the migration of human gliocytoma cells.Conclusion:ZNF185 represses the migration of human gliocytoma cells by binding to F-actin.
zinc finger protein,glioma,cell migration

10.3969/j.issn.1000-8179.20140592
①河北省唐山市工人医院(河北省唐山市063000);②河北联合大学基础医学院
*本文课题受河北省自然科学基金(编号:H2013209019)和唐山市科技计划项目(编号:13130290z)资助
郑全辉 zhqhdlp@sohu.com
陆斌 硕士,副主任医师。专业方向为神经外科治疗。
E-mail:lubin1974@yahoo.com
