2,3-二氢喹唑啉-4(1H)-酮的催化合成
2014-06-27任德成马养民
张 金, 任德成, 马养民, 苗 智
(陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021)
0 引言
2,3-二氢喹唑啉-4(1H)-酮及其衍生物是一类具有良好生物活性、药理活性的含氮杂环化合物,其在抗炎[1]、抗菌[2]、抑制癌细胞[3]、抗高血压[4]、利尿[5]等方面表现出良好的活性,因此2,3-二氢喹唑啉-4(1H)-酮及其衍生物的合成引起人们广泛的关注.
目前,合成2,3-二氢喹唑啉-4(1H)-酮及其衍生物的方法主要有:(1)以邻氨基苯甲酰胺为底物,与醛酮在Lewis酸催化下合成相应产物[6-8];(2) 以邻硝基苯甲酰胺为底物在SnCl2或TiCl4-Zn催化下合成2,3-二氢喹唑啉-4(1H)-酮及其衍生物[9,10];(3)以靛红酸酐为底物,与不同氨源和醛在多种催化体系下合成目标产物[11-14].然而,这些方法都或多或少的存在一些缺点,例如:使用毒性较大的试剂和溶剂,催化剂不能循环使用,实验后续处理较复杂,反应时间较长等.因此,寻找一种绿色、经济、高效地合成2,3-二氢喹唑啉-4(1H)-酮及其衍生物的方法显得尤为重要.本研究发展了以纳米ZnO为催化剂,乙醇/水为溶剂,靛红酸酐为底物一锅法合成2,3-二氢喹唑啉-4(1H)-酮类化合物的方法.该方法溶剂绿色无毒,催化剂可重复使用活性无明显降低,实验操作简单.
1 实验部分
1.1仪器和试剂
XT5型显微熔点仪,温度计未较正,北京市科仪电光仪器厂;VECTOR-22型光谱仪,KBr压片,德国Bruker公司;ADVANCE III 400MHz型核磁共振仪,TMS内标,德国Bruker公司;纳米ZnO(30 nm),阿拉丁试剂有限公司;靛红酸酐,萨恩化学技术有限公司;苯胺,天津市登峰化学试剂厂;邻甲氧基苯胺,萨恩化学技术有限公司;间硝基苯胺,萨恩化学技术有限公司;无水乙醇,天津市河东区红光试剂厂;苯甲醛,天津市化学试剂二厂;对甲氧基苯甲醛,国药集团化学试剂有限公司;邻硝基苯甲醛,阿拉丁试剂有限公司.
1.2 2,3-二氢喹唑啉-4(1H)-酮的合成
在25 mL 反应瓶中加入1.0 mmol靛红酸酐、1.1 mmol芳香胺、1.1 mmol芳香醛、0.1 mmol 纳米ZnO、5.0 mL 乙醇水溶液,回流条件下加热、搅拌反应(TLC跟踪反应进程),反应结束后,将混合物过滤,收集滤液进行拌样.对样品进行柱色谱、重结晶等方法分离提纯.用1H-NMR,13C-NMR, IR对产品进行表征.
产品的表征数据如下:
2,3-二苯基-2,3-二氢喹唑啉-4(1H)-酮 (4a). 白色晶体,熔点: 206~208 ℃.1H NMR (400 MHz, DMSO-d6)δ7.72 (d,J=7.8 Hz, 1H),7.67(d,J=2.2 Hz,1H),7.38(d,J=7.4 Hz,2H),7.36-7.22(m,8H),7.18(t,J=7.2 Hz,1H),6.76(d,J= 8.1 Hz,1H),6.71(t,J=7.5 Hz,1H),6.29(d,J=2.5 Hz,1H).13C NMR(100 MHz,DMSO-d6)δ162.23,146.55,140.78,140.68,133.74,128.58,128.35,128.26,127.94,126.55,126.20,125.97,117.48,115.30,114.76,72.56.IR(KBr):3 296,1 635,1 512,1 394,1 161,752, 696 cm-1.
2-(4-甲氧基苯基)-3-苯基-2,3-二氢喹唑啉-4(1H)-酮 (4b).白色晶体,熔点:201~203 ℃.1H NMR(400 MHz,CDCl3)δ7.94(dd,J=7.8,1.0 Hz,1H),7.28-7.19(m,5H),7.10(t,J=6.7 Hz,3H),6.81(t,J=7.5 Hz,1H),6.69(d,J=8.7 Hz,2H),6.55(d,J=8.0 Hz,1H),5.99(s,1H),4.67(s,1H),3.67(s,3H).13C NMR(100 MHz,CDCl3)δ162.4,158.9,144.4,139.4,132.8,130.8,128.0,127.9,127.2,126.1,125.8,118.5,115.9,113.8,112.9,73.1,54.5.IR(KBr):3 298,2 933,1 633,1 252,1 171,694,606 cm-1.
2-(2-硝基苯基)-3-苯基-2,3-二氢喹唑啉-4(1H)-酮(4c).淡黄色晶体,熔点:178~180 ℃.1H NMR(400 MHz,CDCl3)δ8.08(dd,J= 8.1,1.1 Hz,1H),8.05(dd,J=7.9,1.3 Hz,1H),7.82(dd,J=7.8,0.9 Hz,1H),7.61(td,J=7.7,1.0 Hz,1H),7.53-7.46(m,1H),7.37- 7.28(m,3H),7.26- 7.21(m,3H),6.88(t,J=7.6 Hz,1H),6.72(s,1H),6.59(d,J=8.0 Hz,1H),5.54(s, 1H).13C NMR(100 MHz,CDCl3)δ163.2,147.3,144.0,140.7,135.5,134.3,134.1,129.8,129.2,129.0,128.7,127.0,126.1,125.9,119.8,116.2,115.3,70.1.IR(KBr):3 259,1 631,1 533,1 356,1 294,1 182,756,696,519 cm-1.
3-(2-甲氧基苯基)-2-(4-甲氧基苯基)-2,3-二氢喹唑啉-4(1H)-酮 (4d).白色晶体,熔点:166~168 ℃.1H NMR(400 MHz,DMSO-d6)δ7.68(s,1H),7.33-7.25(m,4H),7.18- 7.12(m,1H),6.95(d,J=8.1 Hz,2H),6.83-6.69(m,5H),6.06(s,1H),3.73(s,3H),3.66(s,3H).13C NMR(100 MHz,DMSO-d6)δ162.5,159.3,155.0,147.7,133.5,131.6,130.7,128.7,128.4,128.3,127.9,119.9,117.3,114.8,114.4,113.2,111.8,72.7,55.4,55.0.HRMS (ESI):calcd for C22H”20N2O3Na[M+Na]+:383.137 2,found 383.135 3.IR(KBr):3 294,2 935,1 635,1 500,1 252,1 173,1 028,750,696,534 cm-1.
3-(2-甲氧基苯基)-2-(2-硝基苯基)-2,3-二氢喹唑啉-4(1H)-酮 (4e).淡黄色晶体,熔点:180~182 ℃.1H NMR(400 MHz,CDCl3)δ8.00(dd,J=12.3,7.9 Hz,2H),7.92(d,J= 8.1 Hz,1H), 7.58(t,J=7.6 Hz,1H),7.43(t,J= 7.7 Hz,1H),7.29 (d,J=7.6 Hz,1H),7.22(d,J=7.8 Hz,1H),7.11(d,J=7.5 Hz,1H),6.92(d,J=8.3 Hz,1H),6.86(q,J= 7.4 Hz,2H), 6.64-6.56(m,2H),5.39(s,1H),3.79(s, 3H).13C NMR(100 MHz,CDCl3)δ163.1,154.7,147.8,144.8,135.1,134.0,133.6,129.9,129.6,129.2,129.0,128.2,125.2,120.7,119.5,116.0,115.1,112.2,69.0, 55.7.HRMS(ESI): calcd for C21H17N3O4Na[M+Na]+:398.1117, found 398.1111.IR(KBr):3 261,1 639,1 520,1 259,0 1 178, 1 024, 748 cm-1.
3-(3-硝基苯基)-2-苯基-2,3-二氢喹唑啉-4(1H)-酮 (4f).淡黄色晶体,熔点:127~128 ℃.1H NMR(400MHz,DMSO-d6)δ8.16 (t,J=2.1Hz,1H),8.05(dd,J=8.1,1.8 Hz, 1H),7.80(d,J=2.5Hz,1H),7.78- 7.71 (m,2H),7.62(t,J=8.1 Hz, 1H),7.41(d,J=7.2 Hz,2H), 7.37~ 7.22(m,4H),6.82(d,J=8.1Hz,1H),6.75 (t,J=7.4 Hz,1H), 6.52(d,J=2.5 Hz,1H).13C NMR(100 MHz,DMSO-d6) δ162.6,147.6,146.9,141.4,139.8,134.2,132.6,129.9,128.6,128.5,128.1,126.7,120.7,120.6,117.7,115.0,114.7,72.1.HRMS (ESI): calcd for C20H16N3O3[M+H]+:346.1192,found 346.118 6.
1.3 催化剂的回收
反应结束后,将反应物过滤,将得到的催化剂用乙醇洗涤、烘干,备用.
2 结果与讨论
2.1 反应条件优化及底物拓展
以靛红酸酐、苯胺、苯甲醛为反应底物考察不同催化剂对反应的影响(图1).在乙醇作为溶剂下,当不使用催化剂时,反应产率只有20%(表1,序号1).相同底物反应在CuO(5% mol)或ZnO(5% mol)催化下,产率分别为28%和30%(表1,序号2~3).当使用纳米ZnO作为催化剂时,反应产率达40%(表1,序号4).在纳米ZnO催化下,考察不同溶剂对反应的影响.当溶剂为乙醇时,产物产率只有40%(表1,序号4).随着水的加入,产物产率逐渐增大到70%(表1,序号5~8),说明水有利于反应进行.继续增大水的比例,产物产率却有所下降(表1, 序号9),当溶剂为纯水时,产物产率只有55%(表1,序号10),这可能由于底物水溶性不佳,水量过多不利于反应物溶解,从而影响反应产率.随后,考察不同用量的催化剂对反应的影响(表1,序号11~13).结果发现,催化剂用量为10 mmol%时是最佳用量.通过反应条件考察,确定靛红酸酐 (1.0 mmol),芳香胺 (1.1 mmol),芳香醛 (1.1 mmol),纳米ZnO用量为0.1 mmol时,在5.0 mL 乙醇水溶液 (体积比1∶1)中回流加热为最佳反应条件.
图1 2,3-二氢喹唑啉酮条件优化示意图
[a]靛红酸酐 (1.0 mmol),苯胺 (1.1 mmol),苯甲醛 (1.1 mmol),纳米ZnO, 回流条件.[b]分离产率.
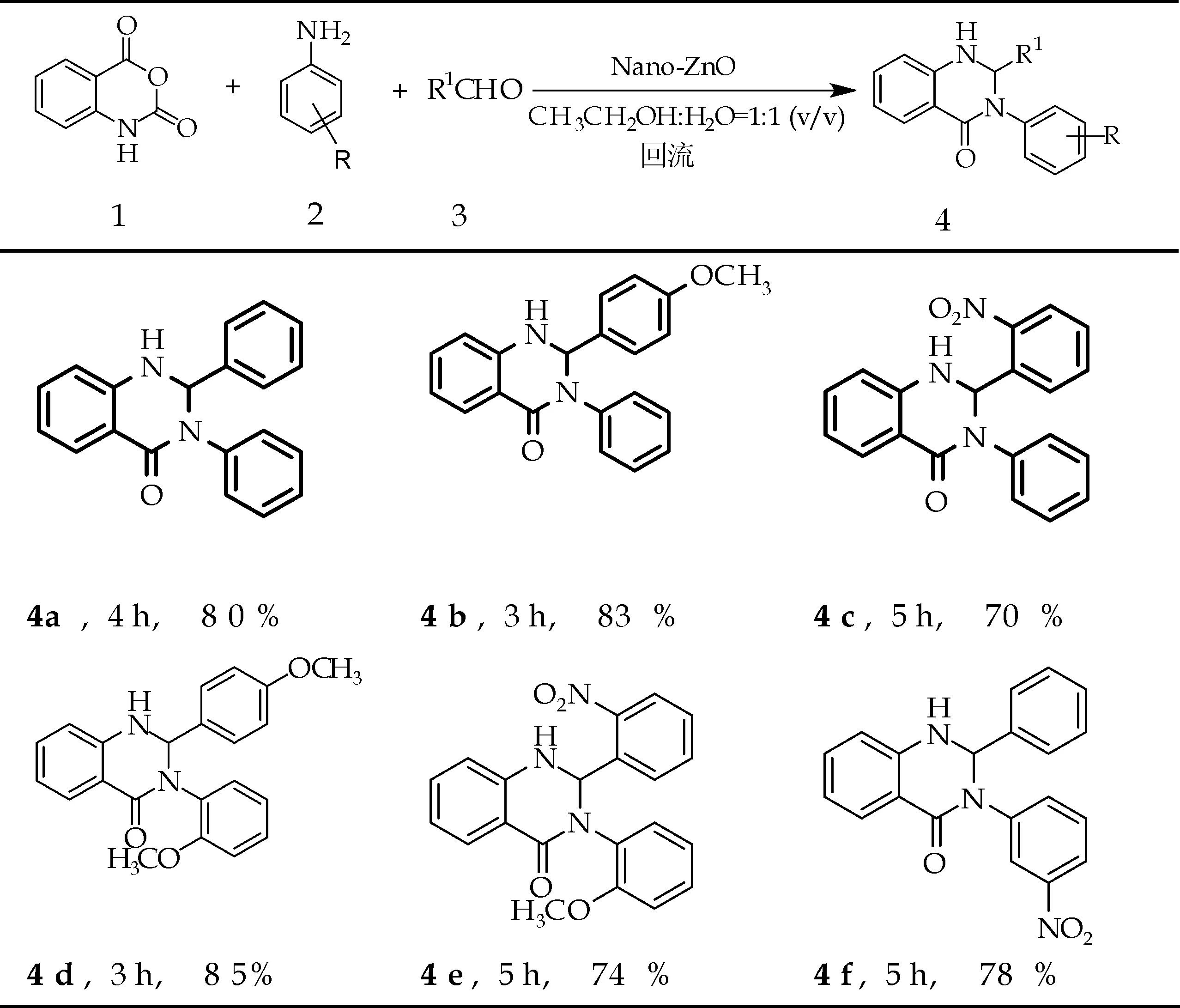
图2 纳米ZnO催化不同底物合成 2,3-二氢喹唑啉-4(1H)-酮
在优化条件下,考察10 mmol%的纳米ZnO对目标产物的催化效果,试验结果见图2.由图2结果可知: 芳香胺和醛不论连接供电子基团或连接吸电子基团,反应都可顺利进行,反应时间为3~5 h.其中,当苯胺作为氨源时,芳香醛上连有供电子基团所得到的产物比芳香醛连吸电子基团所得到的产物产率要高(图2,4b-4c).另外,芳香胺连有供电子基团所得到的化合物比连吸电子基团所得的产物产率高 (图2,4b和4d,4a和4f).由此可知,芳香醛和胺连有供电子基团更有利于目标产物的生成.
2.2 催化剂重复使用
将催化剂洗涤、烘干,以靛红酸酐、苯甲醛、苯胺为反应模型,按照优化后的实验条件将催化剂重复使用3次,发现4a产率分别为80%,77%,75%(表2),由此说明纳米ZnO作为催化剂时,反应活性并没有随着重复使用次数的增加而明显降低.
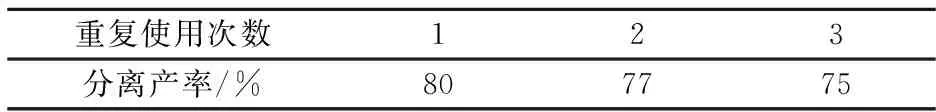
表2 催化剂的重复使用性实验
3 结论
纳米ZnO可有效催化合成2,3-二氢喹唑啉-4(1H)-酮及其衍生物.该方法具有操作简单,乙醇水溶剂清洁,催化剂可回收利用,反应时间短等特点.
[1]Hoonur R S,Patil B R,Badiger D S,et al.Transition metal complexes of 3-aryl-2-substituted 1, 2-dihydroquinazolin-4(3H)-one derivatives: new class of analgesic and anti-inflammatory agents[J].European journal of medicinal chemistry,2010,45(6):2 277-2 282.
[2]Alaimo R J,Russell H E.Antibacterial 2,3-dihydro-2-(5-nitro-2-thienyl)-quinazolin-4-(1H)-ones[J].Journal of medicinal chemistry,1972,15(3):335-336.
[3]Chinigo G M,Paige M,Grindrod S,et al.Asymmetric synthesis of 2,3-dihydro-2-arylquinazolin- 4-ones: methodology and application to a potent fluorescent tubulin inhibitor with anticancer activity[J].Journal of medicinal chemistry,2008,51(15):4 620-4 631.
[4]Rexall Drug Co.Substituted 2,3-dihydro-4(1H)- quinazolinones[P].USA:3257397,1966-06-21.
[5]Cohen E,Klarberg B,Vaughan Jr J R.Quinazolinone sulfonamides as diuretic agents[J].Journal of the American Chemical Society,1959,81(20):5 508-5 509.
[6]Chen J,Su W,Wu H,et al.Eco-friendly synthesis of 2,3-dihydroquinazolin-4(1H)-ones in ionic liquids or ionic liquid-water without additional catalyst[J].Green Chemistry,2007,9(9):972-975.
[7]Chinigo G M,Paige M,Grindrod S,et al.Asymmetric synthesis of 2,3-dihydro-2-arylquinazolin-4(1H)-ones: methodology and application to a potent fluorescent fubulin inhibitor with anticancer activity[J].Journal of Medicinal Chemistry,2008,51(15):4 620-4 631.
[8]Cheng X,Vellalath S,Goddard R,et al.Direct catalytic asymmetric synthesis of cyclic aminals from aldehydes[J].Journal of the American Chemical Society,2008,130(47):15 786-15 787.
[9]Yoo C L,Fettinger J C,Kurth M J.Stannous chloride in alcohol:a one-pot conversion of 2-nitro-N-arylbenzamides to 2, 3-dihydroquinazoline- 4(1H)-ones[J].The Journal of Organic Chemistry,2005,70(17):6 941-6 943.
[10]Shi D,Rong L,Wang J,et al.Synthesis of quinazolin-4(3H)-ones and 1,2-dihydroquinazolin-4(3H)-ones with the aid of a low-valent titanium reagent[J].Tetrahedron Letters,2003,44(15):3 199-3 201.
[11]Baghbanzadeh M,Salehi P,Dabiri M,et al.Water-accelerated synthesis of novel bis-2,3-dihydroquinazolin-4(1H)-one derivatives[J].Synthesis,2006(2):344-348.
[12]Dabiri M,Salehi P,Otokesh S,et al.Efficient synthesis of mono- and disubstituted 2,3-dihydroquinazolin-4(1H)-ones using KAl(SO4)2·12H2O as a reusable catalyst in water and ethanol[J].Tetrahedron Letters,2005,46(36):6 123-6 126.
[13]Salehi P,Dabiri M,Baghbanzadeh M,et al.One-pot,three-component synthesis of 2,3-dihydroquinazolin-4(1H)-ones by montmorillonite K-10 as an efficient and reusable catalyst[J].Synthetic Communications,2006,36(16):2 287-2 292.
[14]Shaabani A,Rahmati A,Rad J M.Ionic liquid promoted synthesis of 3-(2′-benzothiazolo) -2,3-dihydroquinazolin-4(1H)-ones[J].Comptes Rendus Chimie,2008,11(6):759-764.
