埃博拉病毒感染的实验室检测方法
2014-06-27高伟赵平任浩戚中田
高伟,赵平,任浩,戚中田
第二军医大学微生物学教研室,上海市医学生物防护重点实验室,上海 200433
埃博拉病毒(Ebola virus,EBOV)为单负链RNA病毒,属丝状病毒科(Filoviridae)丝状病毒属(Filovirus),首先在西非发现,因靠近埃博拉河而得名。埃博拉病毒属于生物安全四级(biosafety level 4,BSL-4)病原体,引起的疾病为埃博拉出血热或称埃博拉病毒病(Ebola virus disease, EVD),潜伏时间2~21 d,从发病到死亡一般4~9 d。感染致死率最高可达90%,远高于严重急性呼吸综合征(severe acute respiratory syndrome,SARS)10%的致死率[1]。目前既无预防疫苗,也无特效治疗药物。
2014年3月EVD在西非暴发,由于当地医疗条件滞后,不能及时、有效地进行病毒感染的诊断,对患者处理不当,导致EVD呈播散传播。随着旅游业和相关贸易的发展,进出疫区的机会增多,EVD传入我国的风险进一步加大[2]。2014年7月中国香港地区报道1例疑似病例,引起全国关注,后经实验室检测未发现病毒,因此早期诊断格外重要。本文就埃博拉病毒感染的实验室检测进行综述。
1 埃博拉病毒
埃博拉病毒可分为扎伊尔埃博拉病毒(Zaire Ebola virus,ZEBOV)、本迪布焦埃博拉病毒(Bundibugyo Ebola virus,BDBV)、雷斯顿埃博拉病毒(Reston Ebola virus,RESTV)、苏丹埃博拉病毒(Sudan Ebola virus,SUDV)和塔伊森林埃博拉病毒(Taï Forest Ebola virus,TAFV)(也称科特迪瓦埃博拉病毒,Cote d’Ivoire Ebola virus)5个亚型,其中ZEBOV、BDBV和SUDV与非洲EVD大型疫情相关,本次疫情为ZEBOV所致。
埃博拉病毒在电镜下呈多种形态,如“L”形、“U”形、“如意”形等[3]。病毒基因组长度18.9 kb,基因排列顺序是3′-NP-VP35-VP40-GP/sGP-VP30-VP24-L-5′,编码7种病毒蛋白:核蛋白(nucleoprotein,NP)、聚合酶辅助因子(VP35)、基质蛋白(VP40)、包膜刺突糖蛋白(glycoprotein,GP)、复制转录蛋白(VP30)、基质蛋白(VP24)、RNA依赖性RNA聚合酶(L)(图1)。埃博拉病毒核衣壳由单负链RNA基因组、NP、聚合酶L、VP35和VP30组成,GP在病毒颗粒表面形成完整的穗状突起,基质蛋白VP40和VP24将病毒核衣壳连接至病毒包膜[4]。GP通过受体结合介导病毒进入易感细胞并在诱导中和抗体中起重要作用[5]。
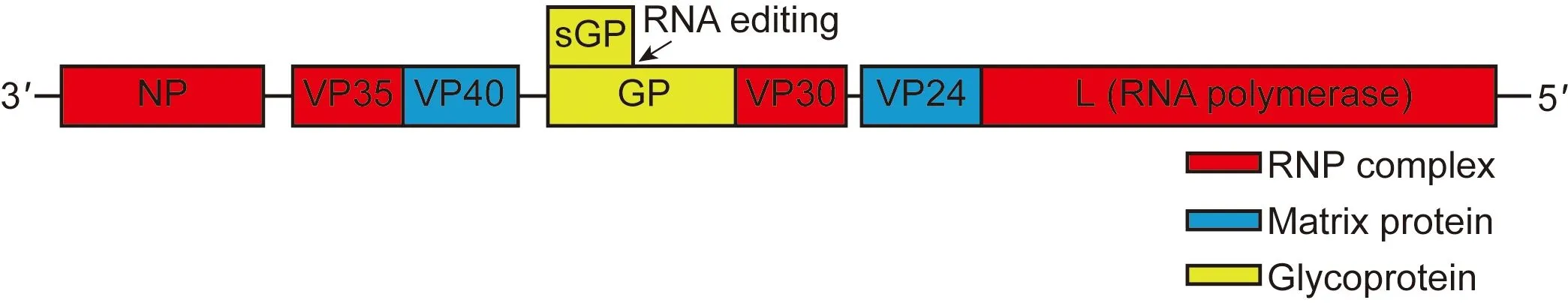
图1埃博拉病毒的基因组结构示意图
Fig.1DiagramofgenomicstructureofEbolavirus
2 实验室诊断方法
EVD的病原学诊断方法包括病毒学诊断与免疫学诊断。病毒学诊断又可分为病毒分离与培养、病毒核酸检测,免疫学诊断主要包括抗原和抗体检测。由于EVD患者一旦发病,其体液和血液具有高度感染性,故诊断需敏感、特异。为最大限度地降低误诊率,往往采取多种方法综合诊断。目前常用方法见表1。
表1埃博拉病毒感染常用检测技术
Tab.1DiagnosticassaysforEbolavirusinfection
检测方法实际应用检测靶点优点缺点病毒分离病毒类型的确定观察细胞病变现象,检测病毒核酸准确检测病毒类型环境要求高,检测周期长,无法批量检测反转录-聚合酶链反应疫源地快速高效检测基因组中的保守序列特异度高,速度快,高通量操作技术要求高,易出现假性结果抗原酶联免疫吸附试验或胶体金技术发病初期或死亡患者病毒蛋白(NP、GP等)特异度高,速度快,设备要求低取样存在感染风险抗体酶联免疫吸附试验或胶体金技术愈后分析,流行病调查 人体产生的病毒抗体(IgG、IgM)特异度高,速度快,设备要求低患者早期未产生抗体前不能检出
2.1 病毒分离
病毒分离是EVD诊断的可靠方法,特异度高。埃博拉病毒培养可选细胞株较多,目前最常用的是非洲绿猴肾(Vero)细胞和仓鼠肾(BHK)细胞,可通过观察细胞病变、电镜检查或免疫学方法对培养细胞进行病毒学鉴定。培养时,将病毒样本稀释10倍,感染单层Vero细胞,2~3 d后可观察到细胞病变效应(cytopathic effect,CPE),待CPE达50%后用免疫荧光法检测抗原[6]。一般在感染8 h后可在培养液中检测到病毒RNA,7 d后可见Vero细胞变圆。通过病毒空斑实验,可计算出样本中病毒滴度[7]。由于具有高致病性,故病毒的分离与培养要在BSL-4实验室进行[2]。
2.2 病毒核酸检测
聚合酶链反应(polymerase chain reaction,PCR)可通过检测病毒核酸诊断EVD,灵敏度高,周期短。由于待检标本具有较高的传染性,故行核酸检测前标本应先经过灭活。常用检测埃博拉病毒核酸的扩增引物见表2。常用检测方法有套式反转录PCR(reverse transcription-PCR,RT-PCR)、实时定量PCR(real-time quantitative PCR,Q-PCR)[11-17]。在2000年乌干达暴发的EVD疫情中,科学家已研发出针对SUDV NP区的高致病性(Gulu)位点的套式RT-PCR特异性引物[12]。尽管RT-PCR法具有快速、灵敏、高效的特性,但存在假阳性和假阴性,且不同实验室RT-PCR检测系统的灵敏度也有区别[19]。近年来,研发了实时荧光定量PCR法。Drosten等应用SRBY染料的一步法荧光定量RT-PCR中,设计的引物为Filo-A(5′-ATCGGAATT- TTTCTTTCTCATT-3′)和Filo-B(5′-ATGTGG-TGGGTTATAATAATCACTGACATG-3′),用来特异性扩增埃博拉病毒的L蛋白基因[11]。另外,基于TaqMan探针的Q-PCR也已应用于EVD检测。设计TaqMan探针,分别在5′端连接6-羧基荧光素(6-carboxyfluorescein)和3′端连接淬灭荧光基团[12]。已证明PCR是诊断EVD的特异、高效方法。
国内也有学者进行了相关研究。盖微微等针对SUDV和ZEBOV的GP基因保守区序列,建立了基于TaqMan探针的实时 PCR法,可用于对SUDV和ZEBOV分型,灵敏度可达1.0×101拷贝[13]。Yang等还建立了可同时检测马尔堡病毒和埃博拉病毒的实时荧光定量PCR[16]。我国目前已批准5家公司的“埃博拉病毒核酸检测试剂”,供在紧急情况下使用,其中一家公司的试剂可同时测出5个型别的埃博拉病毒。
表2已知检测埃博拉病毒核酸的扩增引物与探针
Tab.2PrimersandprobesusedinnucleicacidassaysforEbolavirus

引物或探针序列(5'-3')目的基因(bp)文献RT-PCREBO-GP1 (F)AATGGGCTGAAAATTGCTACAATCEBOV GP (579)[8]EBO-GP2 (R)TTTTTTTAGTTTCCCAGAAGGCCCACTRT-PCRRES-NP1 (F)GTATTTGGAAGGTCATGGATTCRESTV NP (337)[8]RES-NP2 (R)CAAGAAATTAGTCCTCATCAATCRT-PCRZAI-NP1 (F)GGACCGCCAAGGTAAAAAATGAZEBOV NP (268)[8]ZAI-NP2 (R)GCATATTGTTGGAGTTGCTTCTCAGCRT-PCREBO-SV (F)GATGAGGACAAACTTTTTAAEBOV NP,[9]EBO-SC (R)GCCTCACGCAGTTGCTGATATTGZEBOV NP (372)RT-PCRFATCGGAATTTTCTTTCTCATTGAAAGAZEBOV L (420)[10]RATGTGGTGGATTATAATAATCACTGA-CATGCATRT-PCRFilo-A (F)ATCGGAATTTTTCTTTCTCATTFilovirus L (419)[8, 11]Filo-B (R)ATGTGGTGGGTTATAATAATCACTG-ACATGNested SudZaiNP1(+)(F)GAGACAACGGAAGCTAATGCSUDV and ZEBOV NP[12]RT-PCRSudZaiNP1(-)(R)AACGGAAGATCACCATCATG (150)SudZaiNP2(+)(F)GGTCAGTTTCTATCCTTTGCSudZaiNP2(-)(R)CATGTGTCCAACTGATTGCC
(续表2)
F,上游引物;R,下游引物;P,TaqMan探针。
2.3 病毒抗原检测
埃博拉病毒感染早期,患者组织和血液中的病毒滴度高,可通过检测病毒蛋白进行早期诊断。早期开发了埃博拉病毒抗原捕获酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA),1995年在刚果、1996年在加蓬和2000年在乌干达的EVD诊断中应用[10,12,20]。目前,已开发出用于检测埃博拉病毒的抗原捕获ELISA及胶体金检测试剂盒,靶蛋白包括NP、VP40和GP等[21-24](表3)。
由于NP靶蛋白C端110位氨基酸具有很强的抗原性,因此所建立的用于抗原捕获ELISA的单克隆抗体均位于该区域。对于不同病毒基因型,针对ZEBOV重组NP(recombinant NP,rNP)的单克隆抗体识别NP C端的构象表位,而针对RESTV rNP的单克隆抗体识别的是线性表位[25]。有趣的是,抗原捕获ELISA单克隆抗体中,识别RESTV的rNP(Res2-6C8 和 Res2-1D8)线性表位的单克隆抗体只能检测RESTV rNP[21],而捕获ZEBOV rNP(3-3D)构象表位的单克隆抗体可同时检测ZEBOV、SUDV、RESTV和BDBV的rNP[21,23]。Lucht等制备了一组诊断ZEBOV rNP和RESTV rNP的单克隆抗体,可特异性结合ZEBOV NP、RESTV NP、SUDV NP[24]。此外,他们还研发了针对ZEBOV GP和VP40的ELISA试剂盒[24]。ZEBOV GP-ELISA只能检测ZEBOV GP,而VP40-ELISA能检测所有类型埃博拉病毒的VP40[22]。
表3埃博拉病毒抗原检测方法
Tab.3AntigendetectionforEbolavirus

靶蛋白捕获抗体抗体识别位点检测抗体病毒型扎伊尔苏丹塔伊森林雷斯顿文献EBOVZEBOV和SUDV混合单克隆抗体未指明ZEBOV和SUDV免疫兔血清RRUKR[20]RESTV NPRESTV NP单克隆抗体Res2-6C8RESTV NP C端RESTV rNP免疫兔血清NNNR[21]RESTV NP单克隆抗体Res2-1D8RESTV NP C端RESTV rNP免疫兔血清NNNR[21]ZEBOV VP40ZEBOV VP40单克隆抗体2C4未指明ZEBOV生物素标记的单克隆抗体5F6RRRR[22]ZEBOV NPZEBOV单克隆抗体3-3DZEBOV NP C端ZEBOV rNP免疫兔血清RRPRR[23]ZEBOV GPZEBOV GP单克隆抗体3B11未指明ZEBOV过氧化物酶标记的单克隆抗体1G12RNNN[24]
R,阳性反应;UK,未知;N,不反应;PR,可能反应。
2.4 病毒抗体检测
埃博拉病毒特异性IgM抗体在发病后2~9 d出现,持续存在至发病后1~6个月;IgG抗体在发病后6~18 d出现,持续存在至发病后2年以上。因此,IgG检测诊断需用感染初期及其后的双份血清,效价升高4倍或以上才有意义。由于EVD发病迅速,有的患者往往还没有产生免疫应答就已死亡,因此血清学诊断适用于流调溯源,而不适用于急性期诊断。基于病毒感染细胞产生的病毒作为抗原开发的间接免疫荧光法,已普遍应用于埃博拉病毒的抗体检测[26]。最近,基于埃博拉病毒抗原的IgG-ELISA和IgM-ELISA法已建立并成为埃博拉病毒感染的血清学诊断工具[27-29]。
为克服抗原来源的困难,几个研究组建立埃博拉病毒重组蛋白的抗体诊断系统。Prehaud等首先报道了埃博拉病毒线性表位Gabon 94的rNP和rGP用于IgG和IgM抗体检测[30],同时比较了大肠埃希菌表达的埃博拉病毒rNP和杆状病毒表达的埃博拉病毒rGP用作ELISA抗体检测的功效[10]。7例EVD患者血清ELISA结果均为阳性,而22例对照血清为阴性反应[27]。Saijo等在杆状病毒表达系统中进一步表达了N端加入6个His标签的ZEBOV rNP,使ZEBOV rNP高效纯化。基于ZEBOV rNP的IgG-ELISA在ZEBOV、SUDV和RESTV的抗体检测中均表现出高灵敏度和特异度[27]。应用类似方法,研究者开发了基于ZEBOV rNP和RESTV rNP的IgG-ELISA系统[31]。Groen等研发的IgG-ELISA试剂盒用rNP或rVP35作为抗原,发现用rNP抗原包被的IgG-ELISA可用于所有埃博拉病毒的检测,而应用rVP35抗原包被的IgG-ELISA只能应用于ZEBOV的检测。此外,在采集的动物和人血清样本(26个阳性和500个阴性)中,发现ZEBOV rNP IgG-ELISA比rVP35 IgG-ELISA具有更高的灵敏度[32]。国内盖薇薇等以埃博拉病毒VP40基因原核表达产物为抗原,建立了检测埃博拉出血热抗体的间接ELISA[33]。间接免疫荧光技术是另一种新的埃博拉病毒抗体检测方法,用杆状病毒表达系统感染HeLa细胞生产埃博拉病毒 rNP及RESTV rNP,这2种蛋白在埃博拉病毒抗体检测中具有高的敏感度和特异度[26,34]。常用埃博拉病毒抗体检测方法见表4。
表4埃博拉病毒抗体检测方法
Tab.4AntibodydetectionforEbolavirus

方法抗原来源抗原重组蛋白的表达灵敏度(阳性样品/阳性对照)特异度(阴性样本/阴性对照)文献ELISAZEBOV(加蓬94株)rNP大肠埃希菌9/922/22[30]rGP杆状病毒9/922/22ZEBOVrNP杆状病毒13/1450/51[27]截短rNP (361^739)大肠埃希菌13/1450/51rNP杆状病毒24/26489/500[32]rVP35杆状病毒12/26489/500[32]ZEBOVrVP40大肠埃希菌20/2010/10[33]RESTV截短rNP (360^739)大肠埃希菌10/1072/72[31]间接免疫RESTVrNP杆状病毒16/1696/96[26] 荧光法ZEBOVrNP杆状病毒14/1447/48[34]
3 结语
据世界卫生组织2014年10月29日通报,几内亚、利比里亚、塞拉利昂、尼日利亚、刚果、马里、塞内加尔、西班牙和美国等国家有13 567人感染,4 951人死亡。尽管10月底几内亚和塞内加尔传来EVD疫情结束的好消息,但鉴于EVD的高度传染性,全球仍严阵以待。
2014年8月,来自哈佛大学Broad研究院等多处的研究人员对超过99个埃博拉病毒基因组进行了测序和分析,发现2014年流行的埃博拉病毒存在超过300个基因突变,在传播期间基因突变的速度加快,且部分基因突变可能影响PCR诊断试剂中的引物。因此,在疾病流行期间,应及时对病毒基因组进行分析,也有助于开发有效的现场快速检测方法[35]。
综上所述,尽管已建立基于核酸、抗原和抗体的不同检测技术,但考虑到埃博拉病毒感染及变异特点,实验室诊断方法和技术还应不断完善。
[1] Rybka A, Szanyi J, Kapla J, Plíšek S. Highly contagious diseases with human-to-human transmission [J]. Klin Mikrobiol Infekc Lek, 2012, 18(6): 180-183.
[2] Dixon MG, Schafer IJ; Centers for Disease Control and Prevention (CDC). Ebola viral disease outbreak—West Africa, 2014 [J]. MMWR Morb Mortal Wkly Rep, 2014, 63(25): 548-551.
[3] Zaki SR, Shieh WJ, Greer PW, Goldsmith CS, Ferebee T, Katshitshi J, Tshioko FK, Bwaka MA, Swanepoel R, Calain P, Khan AS, Lloyd E, Rollin PE, Ksiazek TG, Peters CJ. A novel immunohistochemical assay for the detection of Ebola virus in skin: implications for diagnosis, spread, and surveillance of Ebola hemorrhagic fever. Commission de Lutte contre les Epidemies a Kikwit [J]. J Infect Dis, 1999, 179(Suppl 1): S36-S47.
[4] 瞿涤,袁正宏,闻玉梅. 埃博拉病毒及其致病机制[J]. 微生物与感染, 2014 [Epub ahead of print].
[5] Marzi A, Reinheckel T, Feldmann H. Cathepsin B & L are not required for ebola virus replication [J]. PLoS Negl Trop Dis, 2012, 6(12): e1923.
[6] Ksiazek TG, Rollin PE, Williams AJ, Bressler DS, Martin ML, Swanepoel R, Burt FJ, Leman PA, Khan AS, Rowe AK, Mukunu R, Sanchez A, Peters CJ. Clinical virology of Ebola hemorrhagic fever (EHF): virus, virus antigen, and IgG and IgM antibody findings among EHF patients in Kikwit, Democratic Republic of the Congo, 1995 [J]. J Infect Dis, 1999, 179(Suppl 1): S177-S187.
[7] Parkes-Ratanshi R, Elbireer A, Mbambu B, Mayanja F, Coutinho A, Merry C. Ebola outbreak response; experience and development of screening tools for viral haemorrhagic fever (VHF) in a HIV center of excellence near to VHF epicentres [J]. PLoS One, 2014, 9(7): e100333.
[8] Sanchez A, Ksiazek TG, Rollin PE, Miranda ME, Trappier SG, Khan AS, Peters CJ, Nichol ST. Detection and molecular characterization of Ebola viruses causing disease in human and nonhuman primates [J]. J Infect Dis, 1999, 179(Suppl 1): S164-S169.
[9] Onyango CO, Opoka ML, Ksiazek TG, Formenty P, Ahmed A, Tukei PM, Sang RC, Ofula VO, Konongoi SL, Coldren RL, Grein T, Legros D, Bell M, De Cock KM, Bellini WJ, Towner JS, Nichol ST, Rollin PE. Laboratory diagnosis of Ebola hemorrhagic fever during an outbreak in Yambio, Sudan, 2004 [J]. J Infect Dis, 2007, 196(Suppl 2): S193-S198.
[10] Leroy EM, Baize S, Lu CY, McCormick JB, Georges AJ, Georges-Courbot MC, Lansoud-Soukate J, Fisher-Hoch SP. Diagnosis of Ebola haemorrhagic fever by RT-PCR in an epidemic setting [J]. J Med Virol, 2000, 60(4): 463-467.
[11] Drosten C, Göttig S, Schilling S, Asper M, Panning M, Schmitz H, Günther S. Rapid detection and quantification of RNA of Ebola and Marburg viruses, Lassa virus, Crimean-Congo hemorrhagic fever virus, Rift Valley fever virus, dengue virus, and yellow fever virus by real-time reverse transcription-PCR [J]. J Clin Microbiol, 2002, 40(7): 2323-2330.
[12] Towner JS, Rollin PE, Bausch DG, Sanchez A, Crary SM, Vincent M, Lee WF, Spiropoulou CF, Ksiazek TG, Lukwiya M, Kaducu F, Downing R, Nichol ST. Rapid diagnosis of Ebola hemorrhagic fever by reverse transcription-PCR in an outbreak setting and assessment of patient viral load as a predictor of outcome [J]. J Virol, 2004, 78(8): 4330-4341.
[13] 盖微微,郑学星,薛向红,高玉伟,赵永坤,王铁成,王化磊,黄耕,冯娜,杨松涛,夏咸柱. 埃博拉病毒检测与分型Real-time PCR方法的建立[J]. 中国病原生物学杂志, 2013, 8(3): 208-211, 216.
[14] Gibb TR, Norwood DA Jr, Woollen N, Henchal EA. Development and evaluation of a fluorogenic 5′ nuclease assay to detect and differentiate between Ebola virus subtypes Zaire and Sudan [J]. J Clin Microbiol, 2001, 39(11): 4125-4130.
[15] Trombley AR, Wachter L, Garrison J, Buckley-Beason VA, Jahrling J, Hensley LE, Schoepp RJ, Norwood DA, Goba A, Fair JN, Kulesh DA. Comprehensive panel of real-time TaqMan polymerase chain reaction assays for detection and absolute quantification of filoviruses, arenaviruses, and New World hantaviruses [J]. Am J Trop Med Hyg, 2010, 82(5): 954-960.
[16] Yang Y, Bai L, Hu KX, Yang ZH, Hu JP, Wang J. Multiplex real-time PCR method for rapid detection of Marburg virus and Ebola virus [J]. Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi, 2012, 26(4): 313-315.
[17] Weidmann M, Mühlberger E, Hufert FT. Rapid detection protocol for filoviruses [J]. J Clin Virol, 2004, 30(1): 94-99.
[18] Towner JS, Sealy TK, Khristova ML, Albario CG, Conlan S, Reeder SA, Quan PL, Lipkin WI, Downing R, Tappero JW, Okware S, Lutwama J, Bakamutumaho B, Kayiwa J, Comer JA, Rollin PE, Ksiazek TG, Nichol ST. Newly discovered ebola virus associated with hemorrhagic fever outbreak in Uganda [J]. PLoS Pathog, 2008, 4(11): e1000212.
[19] Niedrig M, Schmitz H, Becker S, Günther S, ter Meulen J, Meyer H, Ellerbrok H, Nitsche A, Gelderblom HR, Drosten C. First international quality assurance study on the rapid detection of viral agents of bioterrorism [J]. J Clin Microbiol, 2004, 42(4): 1753-1755.
[20] Ksiazek TG, Rollin PE, Jahrling PB, Johnson E, Dalgard DW, Peters CJ. Enzyme immunosorbent assay for Ebola virus antigens in tissues of infected primates [J]. J Clin Microbiol, 1992, 30(4): 947-950.
[21] Ikegami T, Niikura M, Saijo M, Miranda ME, Calaor AB, Hernandez M, Acosta LP, Manalo DL, Kurane I, Yoshikawa Y, Morikawa S. Antigen capture enzyme-linked immunosorbent assay for specific detection of Reston Ebola virus nucleoprotein [J]. Clin Diagn Lab Immunol, 2003, 10(4): 552-557.
[22] Lucht A, Grunow R, Möller P, Feldmann H, Becker S. Development, characterization and use of monoclonal VP40-antibodies for the detection of Ebola virus [J]. J Virol Methods, 2003, 111(1): 21-28.
[23] Niikura M, Ikegami T, Saijo M, Kurane I, Miranda ME, Morikawa S. Detection of Ebola viral antigen by enzyme-linked immunosorbent assay using a novel monoclonal antibody to nucleoprotein [J]. J Clin Microbiol, 2001, 39(9): 3267-3271.
[24] Lucht A, Grunow R, Otterbein C, Möller P, Feldmann H, Becker S. Production of monoclonal antibodies and development of an antigen capture ELISA directed against the envelope glycoprotein GP of Ebola virus [J]. Med Microbiol Immunol, 2004, 193(4): 181-187.
[25] Saijo M, Niikura M, Maeda A, Sata T, Kurata T, Kurane I, Morikawa S. Characterization of monoclonal antibodies to Marburg virus nucleoprotein (NP) that can be used for NP-capture enzyme-linked immunosorbent assay [J]. J Med Virol, 2005, 76(1): 111-118.
[26] Ikegami T, Saijo M, Niikura M, Miranda ME, Calaor AB, Hernandez M, Manalo DL, Kurane I, Yoshikawa Y, Morikawa S. Development of an immunofluorescence method for the detection of antibodies to Ebola virus subtype Reston by the use of recombinant nucleoprotein-expressing HeLa cells [J]. Microbiol Immunol, 2002, 46(9): 633-638.
[27] Saijo M, Niikura M, Morikawa S, Ksiazek TG, Meyer RF, Peters CJ, Kurane I. Enzyme-linked immunosorbent assays for detection of antibodies to Ebola and Marburg viruses using recombinant nucleoproteins [J]. J Clin Microbiol, 2001, 39(1): 1-7.
[28] Macneil A, Reed Z, Rollin PE. Serologic cross-reactivity of human IgM and IgG antibodies to five species of Ebola virus [J]. PLoS Negl Trop Dis, 2011, 5(6): e1175.
[29] Ksiazek TG, West CP, Rollin PE, Jahrling PB, Peters CJ. ELISA for the detection of antibodies to Ebola viruses [J]. J Infect Dis, 1999, 179(Suppl 1): S192-S198.
[30] Prehaud C, Hellebrand E, Coudrier D, Volchkov VE, Volchkova VA, Feldmann H, Le Guenno B, Bouloy M. Recombinant Ebola virus nucleoprotein and glycoprotein (Gabon 94 strain) provide new tools for the detection of human infections [J]. J Gen Virol, 1998, 79 (Pt 11): 2565-2572.
[31] Ikegami T, Saijo M, Niikura M, Miranda ME, Calaor AB, Hernandez M, Manalo DL, Kurane I, Yoshikawa Y, Morikawa S. Immunoglobulin G enzyme-linked immunosorbent assay using truncated nucleoproteins of Reston Ebola virus [J]. Epidemiol Infect, 2003, 130(3): 533-539.
[32] Groen J, van den Hoogen BG, Burghoorn-Maas CP, Fooks AR, Burton J, Clegg CJ, Zeller H, Osterhaus AD. Serological reactivity of baculovirus-expressed Ebola virus VP35 and nucleoproteins [J]. Microbes Infect, 2003, 5(5): 379-85.
[33] 盖微微, 郑学星, 薛向红, 冯娜, 王化磊, 王铁成, 赵永坤, 黄耕, 高玉伟, 杨松, 夏咸柱. 埃博拉病毒VP40蛋白的原核表达及其抗体间接ELISA检测方法的建立[J]. 中国病原生物学杂志, 2013, 8 (9): 782-786.
[34] Saijo M, Niikura M, Morikawa S, Kurane I. Immunofluorescence method for detection of Ebola virus immunoglobulin G, using HeLa cells which express recombinant nucleoprotein [J]. J Clin Microbiol, 2001, 39(2): 776-778.
[35] Gire SK, Goba A, Andersen KG, Sealfon RS, Park DJ, Kanneh L, Jalloh S, Momoh M, Fullah M, Dudas G, Wohl S, Moses LM, Yozwiak NL, Winnicki S, Matranga CB, Malboeuf CM, Qu J, Gladden AD, Schaffner SF, Yang X, Jiang PP, Nekoui M, Colubri A, Coomber MR, Fonnie M, Moigboi A, Gbakie M, Kamara FK, Tucker V, Konuwa E, Saffa S, Sellu J, Jalloh AA, Kovoma A, Koninga J, Mustapha I, Kargbo K, Foday M, Yillah M, Kanneh F, Robert W, Massally JL, Chapman SB, Bochicchio J, Murphy C, Nusbaum C, Young S, Birren BW, Grant DS, Scheiffelin JS, Lander ES, Happi C, Gevao SM, Gnirke A, Rambaut A, Garry RF, Khan SH, Sabeti PC. Genomic surveillance elucidates Ebola virus origin and transmission during the 2014 outbreak [J]. Science, 2014, 345(6202): 1369-1372.
