五步蛇咬伤致肢体肿胀与淋巴循环关系的初步研究
2014-06-27包鹏举张根葆
孙 瑶,包鹏举,张根葆
(皖南医学院 1.病理生理学教研室;2.蛇毒研究所;3.生理学教研室,安徽 芜湖 241002)
全球每年有500万人被毒蛇咬伤,大约10万人死亡,近30万人永久致残[1]。其中,血循环毒蛇咬伤的重要并发症就是肢体肿胀或肿胀持久不退。肿胀发展迅速,可在数小时内累及整个肢体,组织持续缺血坏死,患者不得不接受截肢的命运,这严重影响患者的身心健康。
现代医学对蛇伤肿胀的认识[2]:一是蛇毒蛋白水解酶可以直接损害血管内皮细胞,改变血管舒缩功能,增加管壁通透性;另一种观点认为蛇毒作用于血管内皮细胞和组织细胞,使之释放出磷脂酶A2、组胺、5-羟色胺等,从而引起血管通透性增加,组织间液增多而肿胀;此外,还有学者认为是蛇毒抗原抗体复合物未被清除,引起组织细胞变性所致[3]。然而目前,从肿胀消退时间和消退程度上看,西医和中医治疗的效果并不理想。因此,深入认识蛇伤肿胀的发病机制,积极寻求更为有效的治疗方案已成为目前亟须解决的问题和研究关注的焦点。
作为血液循环的辅助系统——淋巴循环[4],对内环境的稳定起到十分重要的作用。组织液进入毛细淋巴管[5-6]形成淋巴液,随着集合淋巴管规律性舒缩运动以及胸内负压等作用下经淋巴干和淋巴导管最终进入血液循环的过程即为淋巴循环。通过淋巴循环可以回收组织液中的蛋白质,运输脂肪及其他营养物质,调节血浆与组织液之间的液体平衡,清除进入组织的红细胞和细菌,发挥防御屏障的作用。蛇伤肿胀的发生发展中淋巴循环会出现哪些变化?至今相关报道较少。本实验选用五步蛇毒复制蛇伤肿胀模型,观察大鼠肠系膜淋巴管的运动,对乳糜池淋巴液进行毛细管电泳分析,初步研究五步蛇咬伤对淋巴循环的影响,为进一步探讨蛇伤肿胀的机制提供一定的理论依据。
1 材料和方法
1.1 动物 清洁级Sprague-Dawley大鼠,雌雄不限,体质量(220±30)g,由皖南医学院实验动物中心提供,实验动物许可证编号:SCXK(苏)2009-0001。
1.2 主要试剂和仪器 皖南地区五步蛇毒,由皖南医学院蛇毒研究所提供;TGL-16G台式超速冷冻离心机,上海安亭科学仪器厂;BI 2000医学图像分析系统,成都泰盟科技有限公司;P/ACE MDQ毛细管电泳仪,美国贝克曼库尔特有限公司。
1.3 方法
1.3.1 五步蛇蛇伤肿胀大鼠模型 大鼠称重后用1.5%戊巴比妥钠溶液(2 ml/kg)腹腔注射麻醉,仰卧位固定在大鼠手术台上。根据Javier Mora等[7]人报道及前期预实验结果,于大鼠左后肢注射蛇毒溶液(0.3 mg/kg),注射后15、30、60、120、240和480 min时测量局部肿胀度,以注射后30 min时出现明显肿胀,且大鼠未死亡视为模型复制成功。
1.3.2 大鼠肠系膜集合淋巴管观察[8]腹部手术取出肠系膜,找到1条清晰的淋巴管,置于观察盒中,保鲜膜覆盖其上,37 ℃保温、保湿。利用倒置显微镜及录像系统观察大鼠肠系膜淋巴管30 min内的运动变化,计算淋巴管收缩频率。
1.3.3 大鼠乳糜池淋巴液获取[9]肌肉注射0.5%肝素(1 ml/ kg,700 U/ ml),全身抗凝。从剑突起沿其左侧肋缘向下外方作一长约5 cm的切口,再从剑突向下作正中切开,暴露横膈与腹主动脉,在腹主动脉的左后侧找到乳糜池,于乳糜池上剪一斜口,将插管逆淋巴回流方向插入2~4 mm,用10号丝线将乳糜池连同周围的结缔组织、椎前筋膜一并结扎,收集模型组大鼠注射蛇毒30 min时的淋巴液。
1.3.4 毛细管电泳检测淋巴浆[10]淋巴液置于3 000 rpm离心10 min获取淋巴浆,将淋巴浆稀释一倍后置于超滤管(0.5 ml,10 ku)中,14 000 rpm离心10 min,分别得到超滤液和截留蛋白并对它们进行毛细管电泳。毛细管区带电泳条件:石英毛细管总长60.2 cm × 75 μm i.d.(美国Beckman Coulter公司);分离电压:18 kV;检测波长:198 nm;操作温度:25 ℃;压力方式进样:3.45 kPa × 5 s;30 mmol/L Tris-HCl缓冲液(pH 9.0)。
2 结果
2.1 五步蛇蛇伤肿胀模型的评价 如图1、2所示,以注射五步蛇毒30 min时足垫增高的厚度为100%,模型组大鼠在注射蛇毒30 min内左后肢局部肿胀度明显增高(P<0.05);而在注射蛇毒30 min后,足垫增高的厚度变化不明显,且大鼠在480 min内未死亡,五步蛇蛇伤肿胀模型复制成功。
2.2 大鼠肠系膜集合淋巴管的运动频率 40倍镜下观察到位于肠系膜脂肪树中的集合淋巴管,见图3。1 min内淋巴管完成一次舒缩的次数即为运动频率,结果见图4,注射蛇毒30 min内,肠系膜淋巴管的运动频率呈现小幅度增加,可能与组织液生成增多有关。30 min后,肠系膜淋巴管运动频率显著下降(P<0.05),提示淋巴管功能紊乱,这可能是参与蛇伤肿胀发生发展的关键环节。
2.3 淋巴浆毛细管电泳 同等电泳条件下,与对照组相比,模型组淋巴浆中出现了多种活性组分(结果见图5、6),它们可能是促进蛇伤肿胀发生发展的关键物质。
3 讨论
目前对蛇伤肿胀的研究多定位在组织细胞和血管上,而其与淋巴循环的关系报道甚少。淋巴管起始于毛细淋巴管,仅由一层淋巴管内皮细胞组成,管壁薄,缺乏基底膜结构,内皮细胞通过锚丝维持内皮细胞间的开放连接,可允许多种大分子物质自由进入毛细淋巴管。蛇毒[11]主要成分是蛋白质和多肽,约占干重的95%,进入组织中的蛇毒其中一部分随损伤的血管进入血液外,另一部分经毛细淋巴管进入淋巴循环,最终到达血液中。
由于蛇伤的部位多位于四肢肢体,故本实验通过注射一定量的五步蛇毒于大鼠后肢来复制蛇伤肿胀模型。当蛇毒剂量为0.3 mg/kg时,发现注射后30 min时局部肿胀度明显增高,30 min后肿胀的变化不明显,且大鼠在480 min内未死亡,这与临床蛇伤肿胀的发展特征十分吻合[2]。
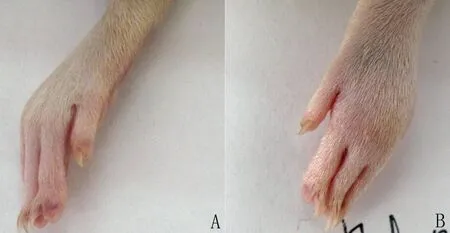
图1 大鼠正常足(A)与五步蛇毒肿胀足(B)的比较
Fig 1 Comparison of normal rat foot (A) and swollen foot (B) after intervention withAgkistrodonacutusvenom
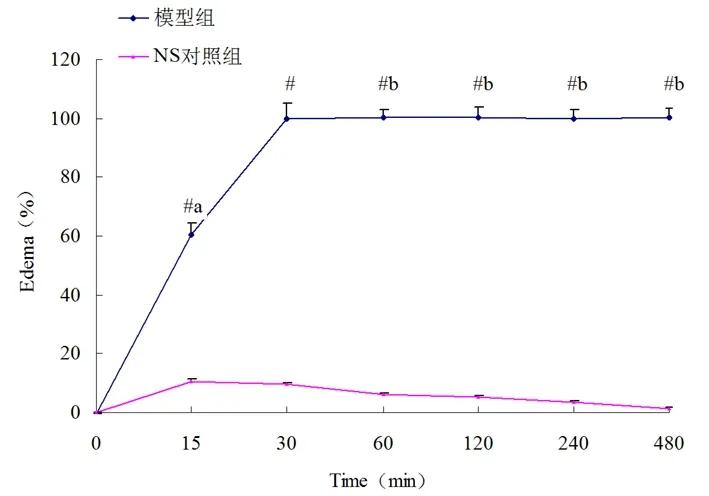
注:与NS对照组比较,#P<0.01;模型组各时间点的肿胀度与
30 min时的比较,aP<0.01,bP>0.05
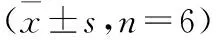
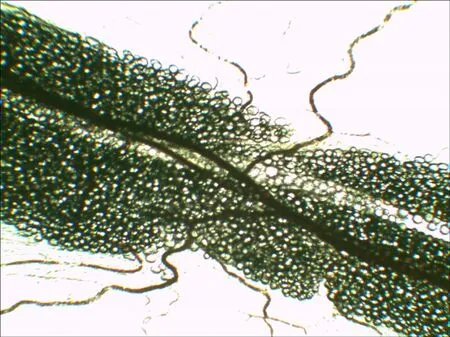
图3 大鼠肠系膜集合淋巴管镜下图
Fig 3 The microscopic appearance of mesenteric collecting lymph vessel in rats
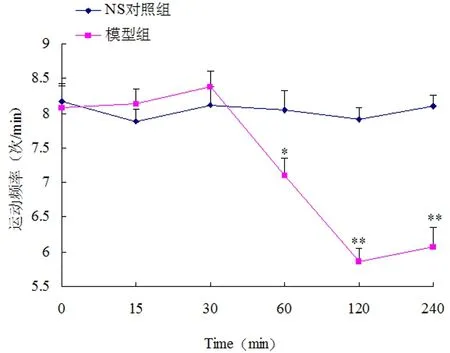
注:与0min相比,*P<0.05,**P<0.01
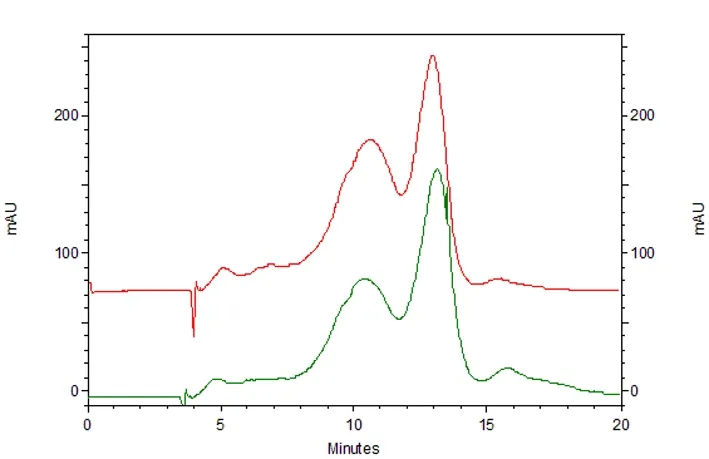
图5 对照组与模型组淋巴滤液的毛细管电泳图谱
Fig 5 Electropherograms for lymph plasma filtrate in the control and model group
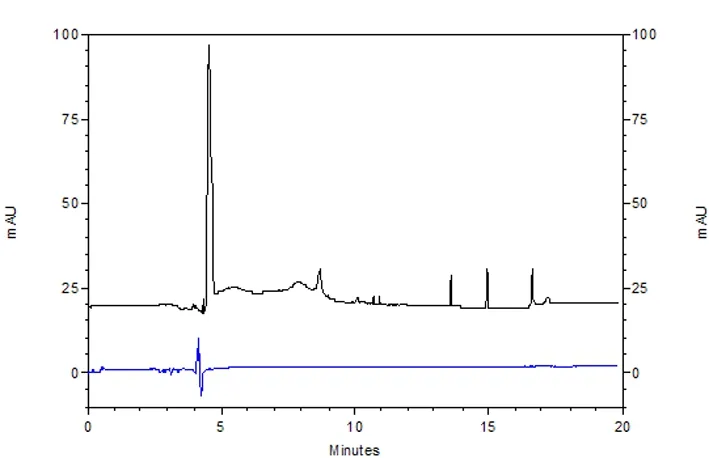
图6 对照组与模型组淋巴截留蛋白的毛细管电泳图谱
Fig 6 Electropherograms for lymph plasma protein retention in the control and model group
在神经和多种活性物质的共同参与下,集合淋巴管平滑肌节律性的舒缩维持淋巴液单向循环,这是淋巴循环的动力学基础[12]。为了解蛇伤肿胀时集合淋巴管功能的改变情况,在注射蛇毒后动态检测大鼠肠系膜集合淋巴管的运动频率。结果表明,注射蛇毒30 min内,肠系膜淋巴管的运动频率呈现小幅度增加,这可能与肠黏膜组织液生成增多、淋巴液量增加,从而提高淋巴管舒缩运动有关;30 min后,肠系膜淋巴管运动频率显著下降,提示淋巴管平滑肌功能紊乱。由此可推测肿胀组织淋巴管的功能改变出现的更早或(和)更加严重,这可能是参与蛇伤肿胀发生发展的关键环节。此外,在注射蛇毒30 min时获取乳糜池淋巴液,并进行毛细管电泳检测。为提高检测效率,我们将淋巴液离心后再超滤[13],截留物多为分子量大于3 ku的蛋白,而超滤液主要是分子量小于3 ku的多肽。图谱显示,模型组淋巴浆中出现了多种活性组分,它们可能是促进蛇伤肿胀发生发展的关键物质。
综上所述,本研究证实五步蛇咬伤后淋巴液中出现多种活性组分,淋巴管运动频率降低,继而加重肢体肿胀。至于蛇伤肿胀淋巴循环功能障碍的具体机制还需从淋巴管的细胞分子水平进行深入探讨,从而为寻找能早期缓解患者症状、减少并发症、降低致残率的蛇伤肿胀治疗新方案提供理论依据。
【参考文献】
[1] 叶万丽.毒蛇咬伤患者局部处理与护理现状[J].中国中医急症,2010,19(10): 1769-1770.
[2] 高建,袁冬华,彭清生.祛风活血末外敷配合红外线理疗在蛇伤后肢体肿胀的临床应用[J].中国临床实用医学,2010,4(11):203-204.
[3] 宋鹏.糜蛋白酶治疗蝮蛇咬伤后期肿胀34例体会[J].蛇志,2002,14(4):26-27.
[4] LIU NINGFEI LIU,LU QING,JIANG ZHAOHUA,etal.Anatomic and functional evaluation of the lymphatics and lymph nodes in diagnosis of lymphatic circulation disorders with contrast magnetic-resonance lymphangiography[J].Journal of Vascular Surgry,2009,49(4):980-987.
[5] NICOLE C.JOHNSON,GUILLERMO OLIVER.Insight into Lymphatic Vasculature Development[J].Biomedical and life sciences,2009,13:11-25.
[6] DIMANA O.MITEVA,JOSEPH M.RUTKOWSKI,BRANDON DIXON,etal.Transmural flow mdulates cell and fluid transport functions of lymphatic endothelium[J].Circulation esearch,2010,106:920-931.
[7] JAVIER MORA,RODRIG MORA,BRUNO LOMONTE,etal.Effects of Bothrops asper Snake Venom on Lymphatic Vessels: Insights into a Hidden Aspect of Envenomation [J].PLoS Neglected Tropical Diseases,2008,2(10): e318.
[8] ERIC A.BRIDENBAUGH,DANIEL JUPITER,TAKASHI NAGAI,etal.Lymphatic muscle cells in rat mesenteric lymphatic vessles of various ages[J].Lymphatic research and biology,2013,11(1):35-42.
[9] 李忠正,陈静子,郭义,等.大鼠“足三里”穴不同干预措施对胸导管淋巴液量及其相关化学物质的影响[J].针刺研究,2012,37(6):453-455.
[10] 孙瑶,包鹏举,张根葆.毛细管区带电泳分析五步蛇毒蛋白C激活剂和蛋白C的相互作用[J].色谱,2013,31(1):59-63.
[11] 覃公平,季达明,舒普荣,等.中国蛇毒学[M].南宁:广西科学技术出版社,1999:3-544.
[12] 泰立鹏,牛春雨,赵自刚.一氧化氮在淋巴管收缩中的作用[J].生理科学进展,2011,42(3):237-240.
[13] 董秀玲,戴忠鹏,林炳承,等.超滤-毛细管电泳测定肺癌患者血清中的唾液酸[J].色谱,2000,18(5):426-428.
