婴幼儿淋巴结核病原体及多位点可变数目串联重复序列分析
2014-06-27邓桂林钱雪琴武洁沈鑫张军卢水华沈芳
邓桂林,钱雪琴, 武洁,沈鑫, 张军,卢水华,沈芳
1. 上海市(复旦大学附属)公共卫生临床中心,上海 201508; 2. 上海市疾病预防控制中心,上海 200336
卡介苗(bacillus Calmette-Guérin,BCG)是一种牛分枝杆菌(Mycobacteriumbovis,M.bovis)减毒活疫苗,可有效预防播散性结核病发生,如结核性脑膜炎、粟粒型肺结核。BCG感染通常发生于免疫功能低下的接种人群,如慢性肉芽肿病(chronic granulomatous disease,CGD)患者、重症联合免疫缺陷病(severe combined immunodeficiency disease,SCID)患者和人类免疫缺陷病毒(human immunodeficency virus,HIV)感染者,其发病率为0.1/100万~4.3/100万,病死率为50%~71%[1-3]。抗结核一线药物为利福平、异烟肼、乙胺丁醇和吡嗪酰胺,而BCG对吡嗪酰胺天然耐药[2],对异烟肼的敏感度亦有所减低[4],应用一线药物治疗可能导致病情延误、加重,甚至死亡。因此,区分BCG感染与结核分枝杆菌感染对治疗及预后很重要。国内关于BCG感染已有多篇报道,但大多根据预防接种史及临床表现作出分析,较少应用分子生物学方法进行鉴别。本研究对73例0~3岁淋巴结核患儿的淋巴结穿刺液阳性培养物进行菌型鉴定及多位点可变数目串联重复序列分析(multiple-locus variable-number tandem repeat analysis,MLVA),以了解婴幼儿淋巴结核的主要病原体及其分子生物学信息。
1 材料与方法
1.1 材料
1.1.1标本来源H37Rv、牛分枝杆菌和BCG由上海市疾病预防控制中心提供;79株临床分离株来自上海市(复旦大学附属)公共卫生临床中心的73例0~3岁淋巴结核患儿淋巴结穿刺液标本(男53例、女20例),其中5例患儿存在重复菌株(男4例有5株重复,女1例有1株重复)。
1.1.2主要仪器及试剂所用仪器及试剂包括基因扩增仪(Bio-Rad公司)、凝胶成像仪(Bio-Rad公司)、分析软件Quantity One (Bio-Rad公司)、试剂盒Mycobacterium tuberculosis Typing Kit Ⅰ(北京康为世纪生物科技有限公司)、试剂盒2×Taq PCR MasterMix(北京天根生化科技有限公司)等。
1.2 方法
1.2.1化学法取新鲜培养物(2~3周),以含0.5% 吐温80的生理盐水配制成10-2mg/ml的悬液,用10 μl标准接种环接种1支对硝基苯甲酸(p-nitrobenzoic acid,PNB)培养基、1支噻吩-2-羧酸肼(thiophene-2-carboxylic acid hydrazide,TCH)培养基和2支改良L-J培养基。接种后1支L-J培养基置于28 ℃培养,PNB培养基、TCH培养基和另1支L-J培养基置于37 ℃培养,培养4周,观察各培养基上菌落生长情况。37 ℃ L-J培养基菌落生长良好,则继续观察28 ℃ L-J培养基、37 ℃ PNB培养基、37 ℃ TCH培养基的生长情况。28 ℃L-J培养基和(或)37 ℃ PNB培养基上有菌落生长判为非结核分枝杆菌;28 ℃L-J培养基和37 ℃ PNB培养基上无菌落生长判为结核分枝杆菌复合群。37 ℃ TCH培养基上有菌落生长为人型结核分枝杆菌;37 ℃ TCH培养基上无菌落生长考虑为牛分枝杆菌。若37 ℃L-J培养基菌落生长不良,则继续放置至8周观察,结果判断亦同。具体操作参见《结核病诊断实验室检验规程》[5]。
1.2.2核酸提取双蒸水制备菌悬液,80 ℃灭活30 min,100 ℃水浴10 min,立即置冰上2 min,12 000 r/min离心10 min,取上清液-20 ℃保存备用。
1.2.3分子生物学鉴定根据Mycobacterium tuberculosis Typing Kit Ⅰ试剂盒操作说明书进行检测及结果判读。
1.2.4结核分枝杆菌复合群鉴定根据Parsons等[6]的设计进行引物合成和结果判断,生工生物工程(上海)股份有限公司完成引物合成。具体序列见表1。扩增片段包括RD1、 RD9和RD10。聚合酶链反应(polymerase chain reaction,PCR)扩增反应体系为20 μl,其中含上、中、下引物(10 pmol/L)各0.4 μl,2×Taq PCR MasterMix 10 μl,模板1 μl,双蒸水补至反应体积。反应条件:预变性94 ℃ 10 min;变性94 ℃ 30 s,退火58 ℃ 30 s,延伸72 ℃ 30 s,30个循环;后延伸72 ℃ 7 min。取3 μl扩增产物,以50 bp DNA Marker为标准,于1%琼脂糖凝胶12.5 V/cm电泳40 min,用凝胶成像仪扫描成像。
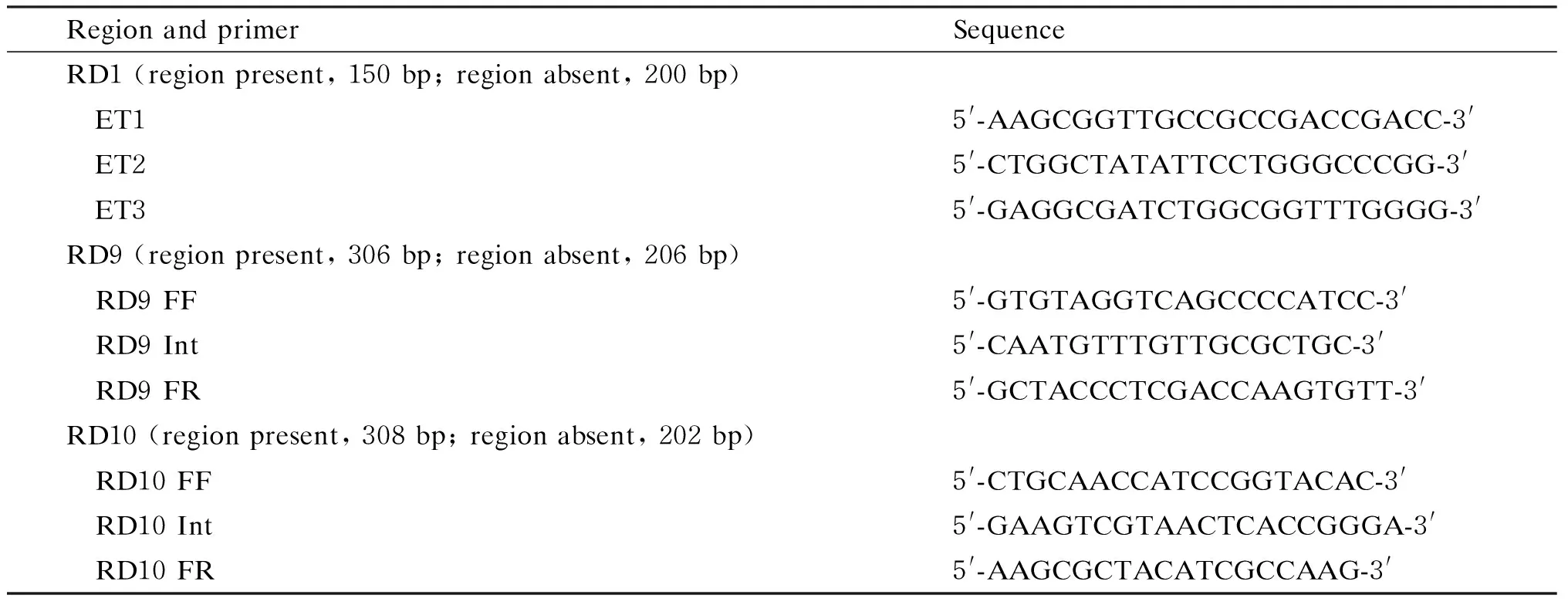
表1 缺失区扩增用引物序列Tab.1 Primer sequences for deleted region analysis
1.2.5MLVA分型根据Mycobacterium tuberculosis Typing Kit Ⅰ试剂盒操作说明书进行检测及结果判读,位点包括QUB-11b、QUB-18、QUB-26、QUB-4156、QUB-1895、MIRU26、MIRU31、MIRU10、MIRU40、Mtub21、Mtub04和ETR-F。结果输入http: //www.miru-vntrplus.org进行数据分析。
2 结果
2.1 分枝杆菌鉴定
传统化学法培养4周,79株菌株在37 ℃ L-J培养基菌落生长均良好,在37 ℃ PNB和28 ℃ L-J培养基上均无菌落生长;3株在37 ℃ TCH培养基上可见明显菌落生长。据此判断79株菌株为结核分枝杆菌复合群,其中76株可能为牛分枝杆菌,3株为人型结核分枝杆菌。
对PCR产物进行扩增,结果显示,79株菌株中有3株存在850 bp和361 bp产物,76株仅存在850 bp产物,所有菌株的扩增产物条带清晰,无杂带干扰。根据试剂盒操作说明书,79株菌株均判为结核分枝杆菌复合群,其中3株为人型结核分枝杆菌。
2.2 结核分枝杆菌复合群鉴定
RD1、RD9和RD10扩增产物显示,H37Rv和3株临床分离株RD1、RD9和RD10均存在(图1);牛分枝杆菌存在RD1,缺失RD9、RD10;BCG和76株临床分离株RD1、RD9和RD10均缺失。由此可见,79株菌株中,76株为BCG菌株,3株为人型结核分枝杆菌。76株BCG分别来自70例患儿,占95.9%(70/73);人型结核分枝杆菌则占4.1%(3/73)。
2.3 MLVA分型
人型结核分枝杆菌与BCG间存在多态性差异(图2)。经12位点分析,获得4个基因型(表2)。其中3株为独立基因型;76株成簇,结合2.2结果显示为BCG菌株,即为同一来源。3株独立基因型菌株经结核分枝杆菌复合群鉴定为人型结核分枝杆菌。4个基因型与数据库菌株比较,BCG菌株与牛分枝杆菌具有亲源性,3株人型结核分枝杆菌则属结核分枝杆菌北京基因型(图3)。
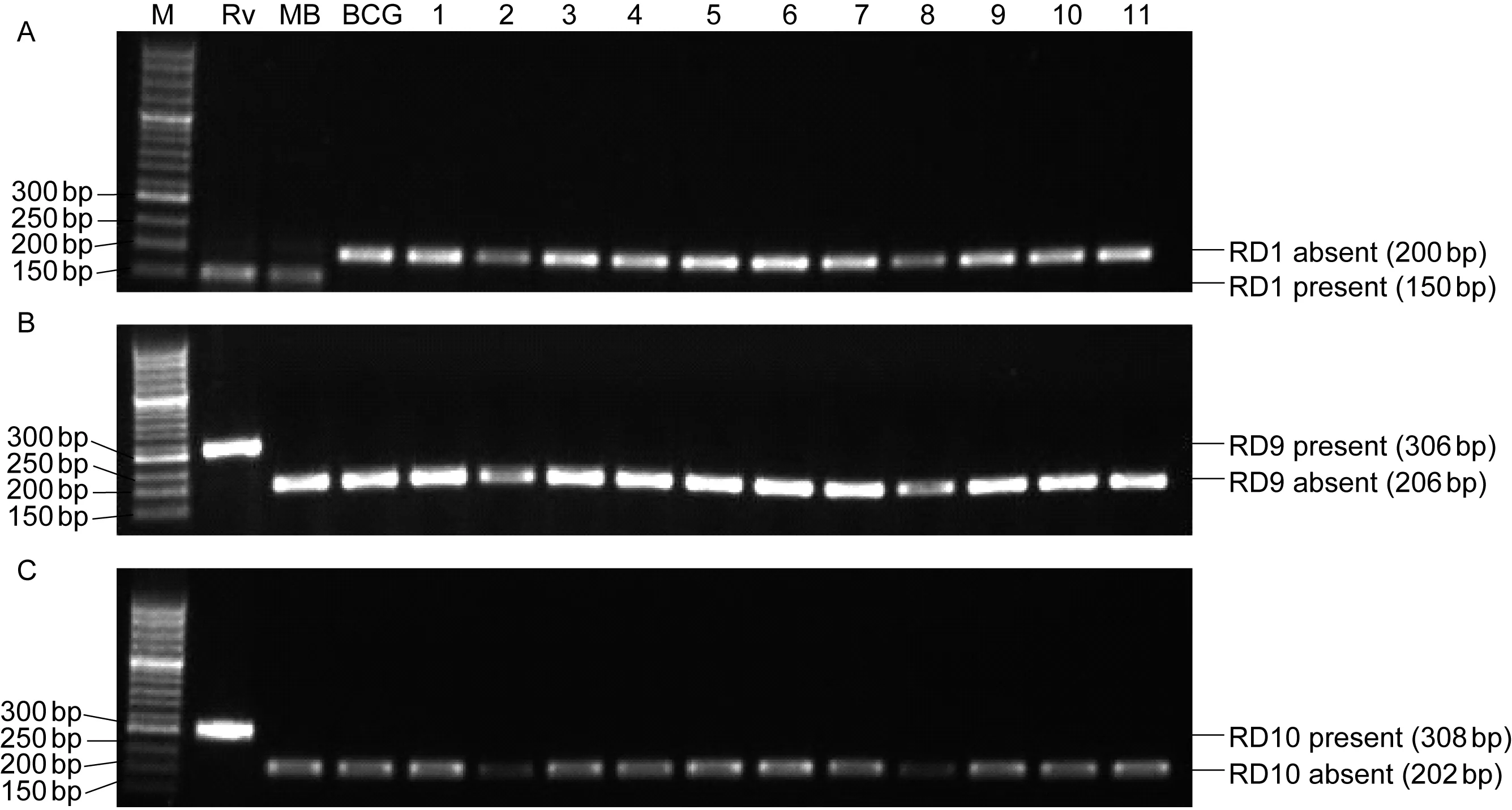
A: RD1. B: RD9. C: RD10.M, 50 bp DNA marker; Rv, H37Rv; MB, Mycobacterium bovis; Lanes 1-11, isolates.
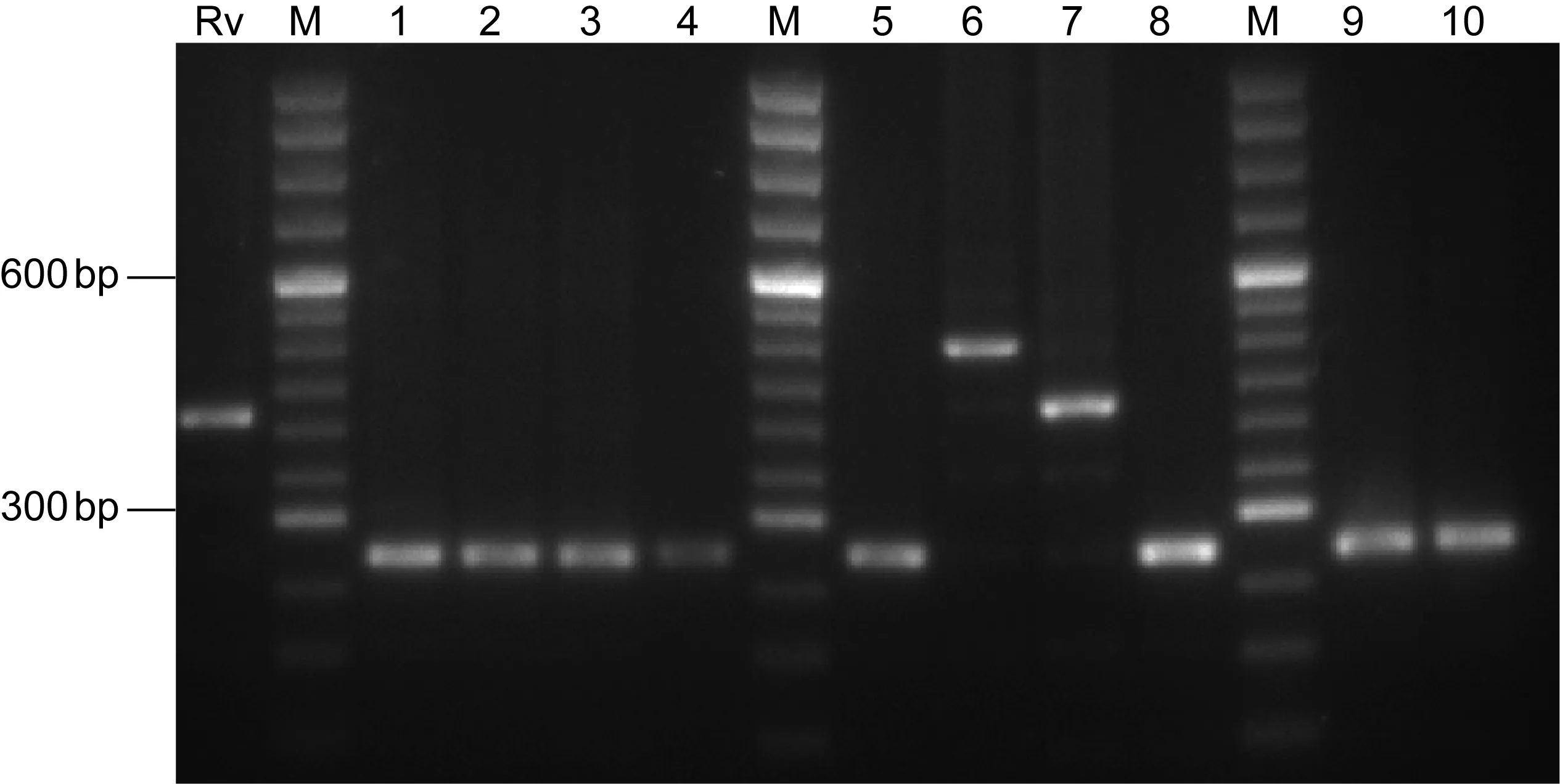
M, 50 bp marker; Lanes 1-10, isolates; Rv, quality control H37Rv. Rv and lane 7 showed 5 alleles (422 bp), lane 6 showed 6 alleles (491 bp) and other lanes showed 3 alleles (284 bp).
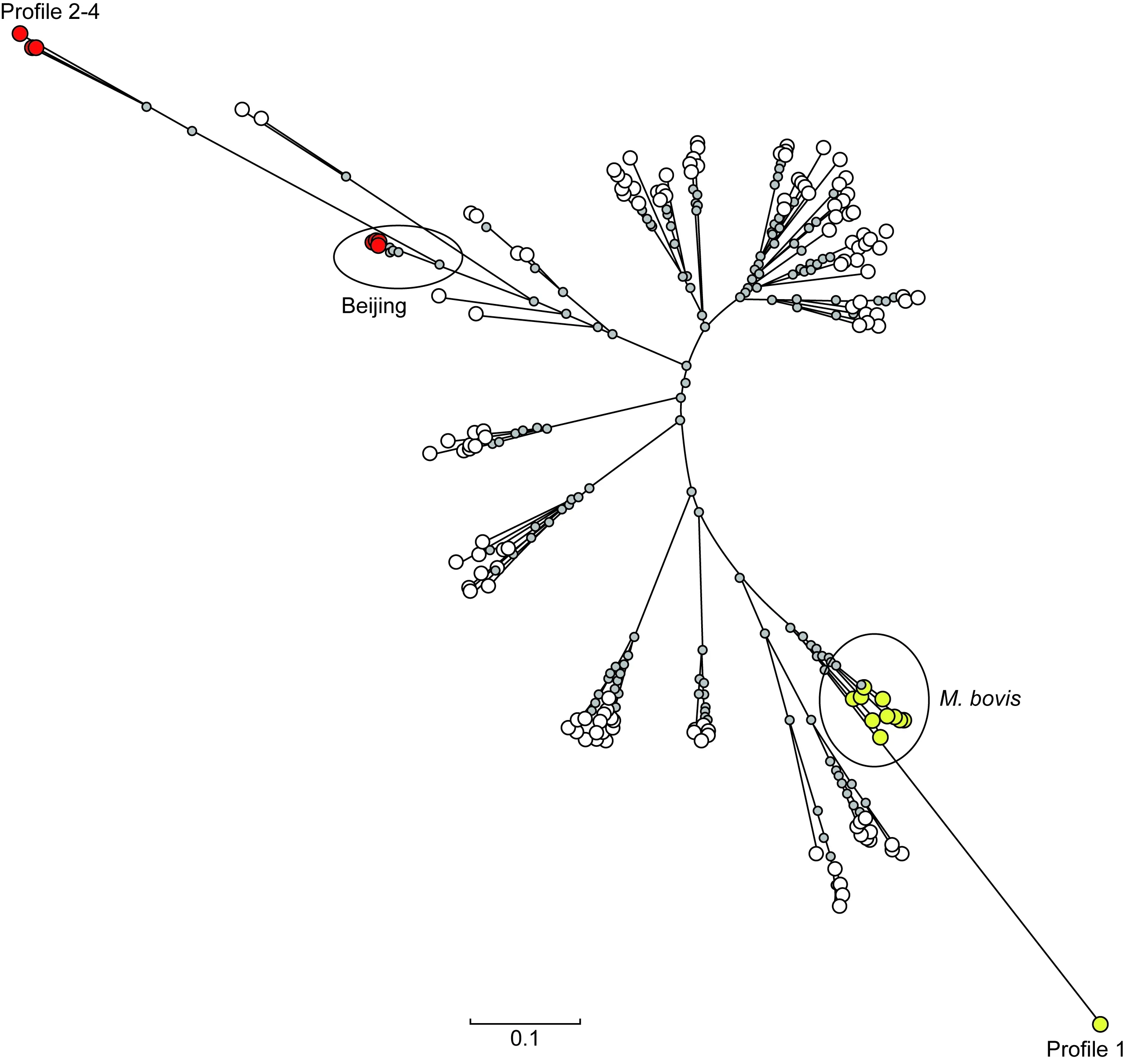
图3 4个基因型的辐射进化树Fig.3 Radial neighbor-joining tree of four genotypes (including reference strains in tree)

表2 MLVA基因型及重复序列数Tab.2 Genotypes and numbers of MLVA
3 讨论
BCG是一种牛分枝杆菌经236代人工培养形成的减毒活疫苗,主要用于结核病预防,也可用于膀胱癌治疗。因其为减毒活疫苗,当免疫力低下人群接种BCG时,有可能导致感染。有文献报道,某些疾病的治疗亦可引起BCG感染[7-9]。诊断时,传统化学方法操作复杂、耗时长,且难以区分牛分枝杆菌与BCG[10]。随着全基因组测序技术的广泛开展,通过序列比对发现,与牛分枝杆菌相比,BCG存在RD1缺失;与人型结核分枝杆菌相比,BCG存在RD1、RD9和RD10缺失。本研究对来自73例淋巴结核患儿的79株临床分离株进行以上片段扩增,结果显示多数为BCG感染,少数为人型结核分枝杆菌感染。结果提示,BCG是多数婴幼儿淋巴结核的病原体。
BCG对吡嗪酰胺天然耐药[2],对异烟肼的敏感度逐渐降低[4]。当异烟肼最低抑菌浓度(minimum inhibitory concentration,MIC)升高时,药物剂量也应升高,从而达到有效杀菌目的。若只使用常规剂量,仅能抑制BCG生长而无法获得有效杀灭。应用利福平联合异烟肼进行常规剂量治疗,可能诱发BCG多重耐药[11]。本研究结果表明,与人型结核分枝杆菌感染相比,对BCG感染更应采取个性化治疗,以取得理想疗效。
MLVA是一种以可变数目串联重复序列(variable number tandem repeat, VNTR)为分子标识基础的分型方法,具有重复性好、特异度高、结果数据化、操作简单、实验时间短等特点。可变数目重复序列可因结核分枝杆菌来源不同而串联重复数不同,其侧翼序列高度保守,主要用于结核分枝杆菌的流行病学调查[12],监测传染病的传染源。本研究中76株BCG的MLVA表现完全一致,而3株人型结核分枝杆菌无同源性,与BCG比对亦无同源性,提示该方法鉴定BCG有较高的准确率。
淋巴结核的主要感染途径[13]有以下几条:①皮肤黏膜接种感染。感染的细菌经淋巴管到达引流区的淋巴结而发病,此途径的原发病灶通常为皮肤黏膜。本研究中70例BCG感染患儿通过此途径感染。②淋巴管直接蔓延。原发病灶的结核分枝杆菌经淋巴管流入肺内淋巴结和支气管淋巴结,或蔓延至其他淋巴结,从而引起淋巴结核,此种感染方式原发病灶通常位于肺部。3例人型结核分枝杆菌感染患儿中,1例肺部病灶不明显,仅局部淋巴结受累,可能通过此途径感染。③血行播散。血行播散导致的淋巴结核通常为全身性多部位结核病变,淋巴结核仅为局部表现形式。3例人型结核分枝杆菌感染病例中,2例存在多部位感染,受累部位包括肺、淋巴结、骨、腹膜等,考虑为此途径感染。
BCG引起婴幼儿淋巴结核可能与3个因素相关:①患儿存在免疫状态改变或遗传因素改变。结核病免疫主要依靠细胞免疫,BCG亦如此,T细胞免疫缺陷可导致BCG易感。对于免疫功能正常的健康人群,分枝杆菌侵入机体后,CD4+辅助/诱导T细胞产生γ干扰素(interferon γ,IFN-γ)、白细胞介素2(interleukin 2,IL-2)、肿瘤坏死因子β(tumor necrosis factor β,TNF-β)等细胞因子,诱导巨噬细胞吞噬细菌;同时,巨噬细胞和树突细胞分泌IL-12和IL-23,正反馈调节IFN-γ产生。CD8+抑制性/细胞毒性T细胞则通过溶解吞噬细菌后的巨噬细胞以清除病原体。当患者存在IFN-γ结构异常,或分泌异常,或调节异常,均可导致感染[14,15]。李惠民等[16]报道,在18例播散性BCG感染病例中,12例存在原发性免疫缺陷病,包括CGD、IL-12/IFN-γ通路缺陷、SCID等,6例存在不确定的免疫缺陷。国外亦有相似报道[17]。②BCG因素。BCG从1921年开始应用于临床,各个国家由于运输、保存及传代用培养基不同,产生了不同亚型,而新亚型的产生直至1966年世界卫生组织(World Health Organization,WHO)规范了疫苗的保存和转种方法才得以阻止。现用的BCG主要分为两大类,第1类含有大量MPB70蛋白表达基因,包括2个IS6110插入序列及可表达甲基分枝菌酸和MPB64蛋白的基因,其代表亚型有BCG Tokyo、 BCG Moreau、BCG Russia和BCG Sweden。第2类仅含有少量MPB70蛋白表达基因,包括单个IS6110插入序列及无表达甲基分枝菌酸和MPB64蛋白的基因,代表亚型有BCG Pasteur、BCG Copenhagen、BCG Glaxo和BCG Tice。我国所用的BCG为1947年突变生成的亚型,属第2类[18]。其与Calmette-Guérin最初研制的BCG相比,存在RD2缺失、IS6110_phoP缺失及串联重复改变。Pan等[19]对4种BCG进行全基因组测序,显示4种疫苗亦存在基因和单核苷酸多态性不同。RD2包含多个基因,该区域基因的Rv1979c至Rv1982缺失会引起免疫反应下降[20],Rv1985c至Rv1986缺失则无改变。③卫生防疫工作人员因素。卫生防疫工作人员未严格掌握BCG接种禁忌证[21],如给接受免疫抑制剂治疗的患儿接种BCG,操作不规范,使用前未完全混合而使接种浓度过高、接种量超标或注射过深(注入皮下或肌内)[22]。
本研究不足之处在于患儿来自全国不同省市,接种的BCG制品来自不同生产厂家,故未能收集相应的BCG样品,缺乏MLVA分析结果。
综上所述,BCG是引起婴幼儿淋巴结核的主要病原体,临床分离的BCG其MLVA分型无差异。
[1] Bematowska EA,Wolska-Kusnierz B, Pac M,Kurenko-Deptuch M, Zwolska Z, Casanova JL, Piatosa B, van Dongen J, Roszkowski K, Mikoluc B, Klaudel-Dreszler M, Liberek A. Disseminated bacillus Calmette- Guérin infection and immunodeficiency [J]. Emerg Infect Dis, 2007, 13(5): 799-801.
[2] Talbot EA, Perkins MD, Silva SFM, Forthingham R. Disseminated bacille Calmette-Guérin disease after vaccination: case report and review [J]. Clin Infect Dis, 1997, 24(6): 1139-1146.
[3] Casanova JL, Jouanguy E, Lamhamedi S, Blanche S, Fischer A. Immunological conditions of children with BCG disseminated infection [J]. Lancet, 1995, 346(8974): 581.
[4] Kolibab K, Derrick SC, Morris SL. Sensitivity to isoniazid of Mycobacterium bovis BCG strains and BCG disseminated disease isolates [J]. J Clin Microbiol, 2011, 49(6): 2380-2381.
[5] 中国防痨协会基础专业委员会. 结核病诊断实验室检验规程[M]. 北京: 中国教育文化出版社, 2006: 52-58.
[6] Parsons LM, Brosch R, Cole ST, Somoskövi A, Loder A, Bretzel G, Van Soolingen D, Hale YM, Salfinger M. Rapid and simple approach for identification of Mycobacterium tuberculosis complex isolates by PCR-based genomic deletion analysis [J]. J Clin Microbiol, 2002, 40(7): 2339-2345.
[7] Gao CQ, Mithani R, Leya J, Dawravoo L, Bhatia A, Antoine J, De Alba F, Russo PA, Fimmel CJ. Granulomatous hepatitis, choroiditis and aortoduodenal fistula complicating intravesical Bacillus Calmette-Guérin therapy: case report [J]. BMC Infect Dis, 2011, 11: 260.
[8] Alvarez-Múgica M, Gómez JM, Vázquez VB, Monzón AJ, Rodríguez JM, Robles LR. Pancratic and psoas abscesses as a late complication of intravesical administration of bacillus Calmette-Guerin for bladder cancer: a case report and review of the literature [J]. J Med Case Rep, 2009, 3: 7323.
[9] Mavrogenis AF, Sakellariou VI, Tsiodras S, Papagelopoulos PJ. Late Mycobacterium bovis spondylitis after intravesical BCG therapy [J]. Joint Bone Spine, 2009, 76(3): 290-300.
[10] Hayashi D, Takii T, Mukai T, Makino M, Yasuda E, Horita Y, Yamamoto R, Fujiwara A, Kanai K, Kondo M, Kawarazaki A, Yano I, Yamamoto S, Onozaki K. Biochemical characteristics among Mycobacterium bovis BCG substrains [J]. FEMS Microbiol Lett, 2010, 306(2): 103-109.
[11] Hong DN, Huyen MN, Lan NT, Duong NH, Ngo VV, Ngoc DT, Huu KT, Nguyen T, Do Chau V, Marcy O, Van de Perre P, Bauls AL, Godreuil S.Rifampin-resistance Mycobacterium bovis BCG-induced disease in HIV-infected infant, Vietnam [J]. Emerg Infect Dis, 2013, 19(7): 1168-1170.
[12] 李兆娜,刘梅,吕冰,赵秀芹,刘志广,焦伟伟,孙琳,贾文祥,申阿东,万康林. 不同串联重复序列位点组合用于中国结核分枝杆菌基因分型的能力比较分析 [J]. 中华预防医学杂志,2009, 43(3): 215-222.
[13] Juan CP, Sylvia CL, Viviana R. Tuberculosis 2007—From basic science to patient care [M]. Brazil: BourcillierKamps.com, 2007, 526-527.
[14] 许艳,周键,卢水华. 播散性卡介苗感染与遗传性白细胞介素-12/干扰素γ通路缺陷 [J]. 临床肺病杂志,2011, 16(10): 1592-1594.
[15] Kong XF, Vogt G, Chapgier A, Lamaze C, Bustamante J, Prando C, Fortin A, Puel A, Feinberg J, Zhang XX, Gonnord P,Pihkala-Saarinen UM, Arola M, Moilanen P, Abel L, Korppi M, Boisson-Dupuis S, Casanova J. A novel form of cell type-specific partial IFN-gammaR1 deficiency caused by a germ line mutation of the IFNGR1 initiation codon [J]. Hum Mol Genet, 2010, 19(3): 434-444.
[16] 李惠民,赵顺英,贺建新,江载芳. 播散性卡介苗感染18例分析 [J]. 中华儿科杂志,2010, 48(1): 65-68.
[17] Toida I, Nakata S. Severe adverse reactions after vaccination with Japanese BCG vaccine: a review [J]. Kekkaku, 2007, 82(11): 809-824.
[18] Liu J, Tran V, Leung AS, Alexander DC, Zhu B. BCG vaccines: their mechanisms of attenuation and impact on safety and protective efficacy [J]. Hum Vaccin, 2009, 5(2): 70-78.
[19] Pan Y, Yang X, Duan J, Lu N, Leung AS, Tran V, Hu Y, Wu N, Liu D, Wang Z, Yu X, Chen C, Zhang Y, Wan K, Liu J, Zhu B. Whole-genome sequences of four Mycobacterium bovis BCG vaccine strains [J]. J Bacteriol, 2011, 193(12): 3152-3153.
[20] Kozak RA, Alexander DC, Liao R, Sherman DR, Behr MA. Region of difference 2 contributes to virulence of Mycobacterium tuberculosis [J]. Infect Immun, 2011, 79(1): 59-66.
[21] 陈凤,蒋利萍,朱朝敏. 小儿卡介苗接种不良反应73例临床分析 [J]. 中华传染病杂志, 2012, 30(12): 747-749.
[22] 李晓云,陈美淑,张丽云. 新生儿接种卡介苗后引起腋下淋巴结炎的原因及对策 [J]. 临床肺科杂志, 2013, 18(1): 95-96.
