耐药结核分枝杆菌感染动物模型所用菌株的筛选
2014-06-27丁海榕林树柱卢锦标邓海清王国治秦川占玲俊
丁海榕,林树柱,卢锦标,邓海清,王国治,秦川,占玲俊
1. 中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021; 2. 中国食品药品检定研究院结核疫苗室,北京 100050; 3. 温州医科大学环境与公共卫生学院,温州 325035
结核病是由结核分枝杆菌引起的一种传染性疾病,死亡率仅次于艾滋病。全球每天约有3 835人死于结核病,导致1 000万儿童成为孤儿。中国是全球5个结核病高负担地区之一,2010年15岁及以上人群活动性肺结核的患病率为459/10万,涂阳肺结核患病率为66/10万[1]。全球每年结核分枝杆菌感染20亿人,治疗花费上千亿美元。随着多重耐药及广泛耐药结核分枝杆菌的出现,结核病的治疗费用增加了200倍[2]。
防控耐药结核病的主要方法是研发新的抗结核药物和预防性疫苗,这些药物和疫苗的评价要借助耐药结核分枝杆菌感染动物模型,而建立模型需实验室标准化的耐药毒株。目前模型所用菌株为标准菌株H37Rv,缺乏相应的耐药株,因此需筛选出耐药表型清楚、基因背景清楚、毒力较强且具有代表性的标准耐药毒株。建立不同实验目的的模型需不同耐药表型的菌株,这就要筛选出不同耐药表型的实验室标准化耐药毒株。
异烟肼(isoniazid,INH)和利福平(rifampin,REP)是治疗结核病的重要一线药物[3],但目前耐利福平菌株增多已成为全球性问题,有学者提议将结核分枝杆菌耐利福平作为其多重耐药的标志[4]。我国约90%耐利福平分离株同时合并耐异烟肼,特别是在复治结核病患者中。2010年全国第5次结核病流行病学抽样调查报告显示[1],复治结核病患者耐药率前3位分别为:异烟肼(30.8%)、利福平(17.9%)、链霉素(streptomycin,Strep)(12.8%)。
通常耐药结核分枝杆菌的毒力会相对下降,即细菌耐药性的获得常以适应性降低为代价[5]。利福平耐药基因rpoB常以531、526位突变为主,有数据表明,rpoB某些突变可补偿细菌耐药引起的适应性降低[6]。也有实验表明,katG基因 315位发生突变的耐异烟肼临床分离株在小鼠模型中仍保留毒力[7],即结核分枝杆菌耐药适应性不一定下降。由此可见,耐药株的毒力变异较复杂,相同耐药表型的菌株毒力也存在较大差异。因此,需通过实验来确定耐药菌株的毒力,筛选出毒力合适、背景清楚的菌株作为耐药模型用菌株。
1 材料与方法
1.1 材料
1.1.1实验用菌株结核分枝杆菌标准株H37Rv由中国食品药品检定研究院提供,菌号93009。菌株经小鼠体内2次增毒后,接种于罗氏斜面培养基(BD公司),3周后收获菌落,经5 μm 无菌滤器(Millipore公司)过滤制备单细胞菌悬液,分装后冻存于-80 ℃低温冰箱备用。取1份分装菌液接种于罗氏培养基,3周后计数,确定单细胞悬液菌密度为1×107CFU/ml。
98株结核分枝杆菌临床分离株由中国疾病预防控制中心收集,来自北京、山东、广东等地区结核病患者的痰标本,经分离培养后收集。
1.1.2实验动物实验中使用的C57BL/6小鼠为雌性,6~8周龄,无特定病原体(specific pathogen free,SPF)级,购自北京维通利华实验动物技术有限公司,实验动物合格证号:SCXK(京)2012-0001。实验动物的使用获得中国医学科学院医学实验动物研究所实验动物使用和管理委员会的批准(批准号ILAC-PC-2013-001),于感染前1周进入生物安全3级实验室适应。
1.2 实验方法
1.2.1比例法药敏试验按《结核病诊断实验室检验规程》,用比例法进行药敏试验[8]。药物有异烟肼、利福平、链霉素、乙胺丁醇(ethambutol,EMB)、卡那霉素(kanamycin,Km)、阿米卡星(amikacin,Am)、氧氟沙星(ofloxacin,Ofx)、卷曲霉素(capreomycin,Cm)。罗氏培养基中药物终浓度为异烟肼0.2 μg/ml、利福平40 μg/ml,链霉素4 μg/ml L、乙胺丁醇2 μg/ml、卡那霉素30 μg/ml、阿米卡星30 μg/ml、氧氟沙星3 μg/ml L、卷曲霉素40 μg/ml。将1 mg/ml菌悬液用灭菌生理盐水稀释至10-3mg/ml和10-5mg/ml,吸取0.1 ml分别均匀接种于含药培养基和无药对照培养基斜面上,最终接种菌量为10-4mg/ml和10-6mg/ml 。37 ℃孵育4周后观察,计算耐药百分比:耐药百分比=含药培养基菌落数/对照培养基菌落数×100%。百分比≤1%为敏感,>1%为耐药。
1.2.2动物的感染与分组先将结核分枝杆菌标准株H37Rv、临床耐药菌株和敏感株接种于罗氏培养基,感染动物前收获斜面上生长3周的细菌菌落,加入生理盐水,用无菌玻璃研磨器研磨,与比浊管比对,将菌液密度调至1×108CFU/ml。将小鼠固定于小鼠固定器上,75%乙醇擦拭消毒尾部,对照组静脉注射250 μl结核分枝杆菌H37Rv菌液,理论感染剂量为2.5×107CFU。实验组静脉注射250 μl耐药菌菌液,理论感染剂量为2.5×107CFU。剩余菌液接种于罗氏培养基,培养3周后计数,菌液密度为(1.0±0.2)×108CFU /ml,则感染剂量为(2.5±0.5)×107CFU。对照组和实验组每株菌感染10只小鼠,感染后每天观察,以监测半数死亡时间。
1.2.3DNA提取取32株菌株的灭活菌液,与DNA提取液〔10 mmol/L Tris-HCl pH 8.0、1 mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、1% Triton X-100〕或TE溶液(10 mmol/L Tris-HCl pH 8.0、1 mmol/L EDTA)按体积比1∶1混匀(例如:100 μl灭活菌液加到100 μl DNA提取液中),盖紧管盖,100 ℃加热20 min,13 200 r/min离心10 min,取上清液作为模板,-20 ℃保存备用。
1.2.4引物设计rpoB(基因编号888164)和katG(基因编号885638)引物用Primer 5软件设计,由Invitrogen公司合成(表1)。

表1 PCR扩增和测序引物Tab.1 Oligonucleotide sequences for primers used in PCR assays and DNA sequences analysis
1.2.5聚合酶链反应扩增聚合酶链反应(polymerase chain reaction,PCR)体系为40 μl:10×PCR缓冲液5 μl、dNTP 5 μl、引物各3 μl、Taq酶0.4 μl、模板DNA 10 μl、MgCl23 μl。反应条件:94 ℃ 5 min;94 ℃ 1 min,退火1 min,72 ℃ 1 min,35次循环;72 ℃ 10 min。退火温度见表1。
1.2.6PCR产物检测取8 μl PCR扩增产物于2%琼脂糖凝胶进行电泳,在紫外透射分析仪上判读结果。若扩增产物为目的条带,将剩余PCR产物送北京擎科新业生物技术有限公司测序。
2 结果
2.1 药敏试验结果
98株结核分枝杆菌临床分离株经3次比例法药敏试验,3次药敏结果一致的有60株。然后筛选出药物敏感谱清晰(即对二线药物敏感,对利福平和异烟肼耐药或敏感)的40株,其中35株的半数死亡时间≤H37Rv的半数死亡时间(35株随机编流水号)。35株中,18株对利福平合并异烟肼耐药、5株单耐利福平,7株单耐异烟肼、5株对利福平和异烟肼均敏感(表2)。
2.2 耐药基因rpoB 测序结果
23株耐利福平菌株中,9株rpoB基因发生TCG531TTG突变,10株rpoB基因发生CAC526GAC突变,1株rpoB基因发生TCG531TTT突变,1株rpoB未发生突变,其余2株rpoB基因可见 516、511、497位突变。合并耐异烟肼的18株中,8株rpoB基因发生TCG531TTG突变,7株rpoB基因发生CAC526GAC突变,1株rpoB基因发生TCG531TTT突变,其余2株rpoB基因可见 516、511、497位突变。利福平敏感株中,除1株rpoB基因发生TCG531TTG突变,其余均未发生突变(表2)。
2.3 耐药基因katG 测序结果
25株耐异烟肼菌株中,18株katG基因发生AGC315ACC突变,1株katG基因发生AGC315AAC突变,1株2种突变都有,1株katG基因发生GAC329GTC突变,4株没有突变。异烟肼敏感株中,只有1株katG基因发生AGC315ACC突变。
2.4 小鼠毒力实验结果
将结核分枝杆菌标准株H37Rv、临床耐药株和药物敏感株经静脉感染小鼠,感染剂量为(2.5±0.5)×107CFU,每株菌感染10只小鼠,以H37Rv感染为对照组。感染后每天观察,以确定半数死亡时间。标准株H37Rv的半数死亡时间为14 d。40株药物敏感谱清晰菌株中,35株的半数死亡时间≤H37Rv的半数死亡时间;其中32株感染后30 d内小鼠全部死亡(10只),2株耐异烟肼合并耐利福平菌株致死数分别为8只、9只,1株单耐利福平菌株致死数为9只。23株感染后14 d内小鼠全部死亡,其中11株耐异烟肼合并耐利福平、3株单耐利福平、6株单耐异烟肼、 3株对异烟肼和利福平均敏感。11 d ≤ 半数死亡时间≤14 d的菌株有11株,4株为利福平敏感株、7株对利福平合并异烟肼耐药。7 d<半数死亡时间≤10 d的菌株有9株,其中2株对利福平和异烟肼均敏感、7株耐利福平(其中4株合并耐异烟肼)。半数死亡时间≤7 d的菌株有15株,其中6株对利福平敏感、9株对利福平耐药(图1)。
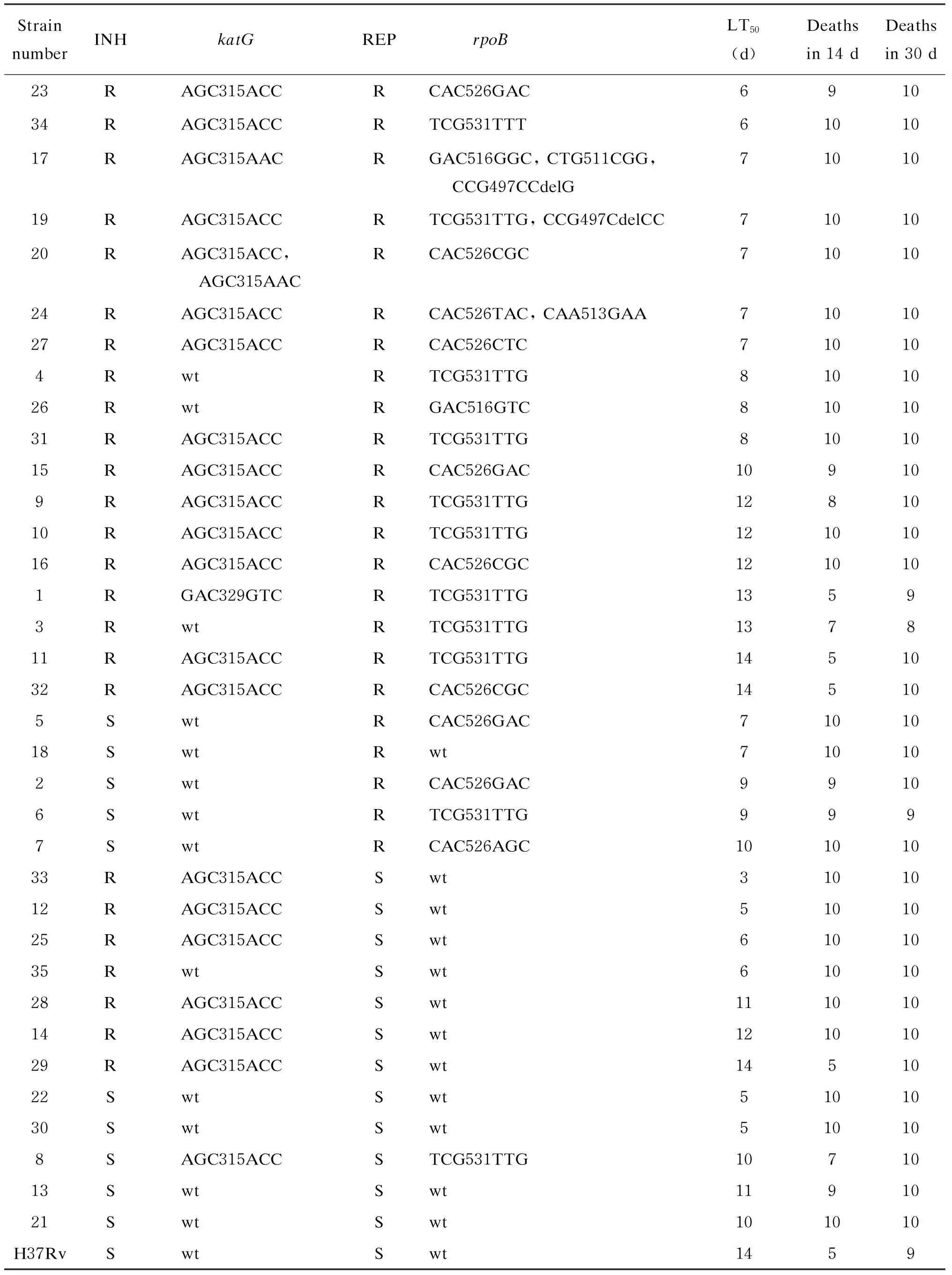
表2 耐药菌株耐药信息与小鼠体内毒力结果Tab.2 Drug-resistant strains’ information and virulence in mice in vivo
2.5 动物模型感染菌株的确定
综合药敏、基因测序及小鼠毒力实验结果,筛选出对利福平和异烟肼均耐药、半数死亡时间≤7 d的23号菌株(katG315位突变,rpoB526位突变);单耐利福平、半数死亡时间≤7 d的5号菌株(katG未突变,rpoB526位突变);单耐异烟肼、半数死亡时间≤7 d的25号菌株(katG315位突变,rpoB未突变)。而H37Rv标准株的半数死亡时间为14 d。这些临床强毒株的耐药表型清楚,有毒力,可用于耐药动物模型的建立。

A: 11 d≤LT50≤14 d. B: 7 d 在动物模型建立中,感染用菌株的毒力是关键因素之一,结核分枝杆菌毒力的评价多通过体外实验的细菌生长适应性来间接反映,与体内实际毒力存在偏差,而只有体内毒力实验才能直接反映毒力。Palanisamy等在豚鼠体内通过存活率来反映临床分离株的毒力[9],Aguilar等在小鼠体内也通过存活率来反映不同基因表型的临床分离株毒力大小[10]。我国目前尚未见多菌株体内毒力评价的报道。小鼠作为实验动物,与豚鼠相比,饲养经济,占用空间小,因此本研究用小鼠半数死亡时间为评价指标来筛选合适毒力的耐药株,作为耐药结核分枝杆菌感染动物模型所用的标准毒株。本研究中小鼠体内毒力实验通过半数死亡时间来评价,结果发现多数耐异烟肼、利福平菌株的毒力较强。 此外,结核病药物或疫苗评价常用小鼠或豚鼠动物模型,由于小鼠模型多以动物半数死亡时间或30 d死亡率为评价指标,需感染菌毒力较强,可选择毒力较强的攻击菌。而结核分枝杆菌感染豚鼠模型常用病变指数或结核分枝杆菌分离数作为评价指标,研究周期长,模型攻击用菌如果毒力过强,则难以有效区分实验组与对照组的差异。因此,本研究通过对多重耐药结核分枝杆菌进行检测,筛选出了可用于建立小鼠感染模型的临床耐药菌株。要注意的是,本研究内容仅满足建立动物模型第1阶段的菌株初筛,而动物模型建立还必须进行毒株种子批建立、感染剂量与感染间隔确定、动物品系选择等基础研究。 研究显示,结核分枝杆菌临床分离株的毒力与耐药基因突变有关。一般细菌耐药基因突变会引起毒力降低,也有研究表明一些耐药株会通过某些突变来补偿毒力的下降[5,6]。耐利福平菌株常见突变位点为531、526、522,体外实验发现上述3个突变位点引起的耐利福平使结核分枝杆菌耐药株的适应成本增加,生长速率减慢,毒力减弱。有数据表明,rpoB基因某些突变可补偿细菌耐药引起的适应性降低[6]。Gagneux等在5株含有rpoBTCG531TTG突变的临床分离株中发现4株没有出现适应性的降低[11]。本研究中,多数耐异烟肼、利福平菌株的毒力并未减弱,其中18株耐利福平合并耐异烟肼菌株的毒力有较大差异。鉴于研究菌株数量较少,尚无法证实结核分枝杆菌临床分离株的毒力与耐药基因突变有关。 本研究以H37Rv标准株为对照,评价了结核分枝杆菌临床分离耐药与敏感菌株的毒力,筛选出可用于建立小鼠结核分枝杆菌感染模型的菌株。在后续感染动物模型的建立中,有待进一步摸索合适的菌株攻击剂量及标准化感染的流程。鉴于我国目前尚无标准化规范的耐药结核分枝杆菌感染动物模型,本研究对国内同行可提供一定的理论参考。 [1] 王黎霞, 成诗明,陈明亭,赵雁林,张慧,姜世闻,何广学,吕青,杜昕,陈伟,刘小秋,阮云洲,王胜芬,夏愔愔,于兰,李峻,李雪. 2010年全国第五次结核病流行病学抽样调查报告[J]. 中国防痨杂志, 2012, 34(8):485-508. [2] Aeras. 2011 annual report: The real cost of TB [R/OL]. www.aeras.org/annualreport2011/. [3] Conde MB, Silva JRLE . New regimens for reducing the duration of the treatment of drug-susceptible pulmonary tuberculosis [J]. Drug Dev Res, 2011, 72(6): 501-508. [4] Somoskovi A, Parsons LM, Salfinger M. The molecular basis of resistance to isoniazid, rifampin, and pyrazinamide in Mycobacterium tuberculosis [J]. Respir Res, 2001, 2(3): 164-168. [5] Enne VI, Delsol AA, Roe JM, Bennett PM. Rifampicin resistance and its fitness cost in Enterococcus faecium [J]. J Antimicrob Chemother, 2004, 53(2): 203-207. [6] Andersson DI, Hughes D. Antibiotic resistance and its cost: is it possible to reverse resistance [J]? Nat Rev Microbiol, 2010, 8(4): 260-271. [7] Pym AS, Saint-Joanis B, Cole ST. Effect of katG mutations on the virulence of Mycobacterium tuberculosis and the implication for transmission in humans [J]. Infect Immun, 2002, 70(9): 4955-4960. [8] 中国防痨协会基础专业委员会. 结核病诊断实验室检验规程[M]. 北京:中国教育文化出版社,2006: 52. [9] Palanisamy GS, DuTeau N, Eisenach KD, Cave DM, Theus SA, Kreiswirth BN, Basaraba RJ, Orme IM. Clinical strains of Mycobacterium tuberculosis display a wide range of virulence in guinea pigs [J].Tuberculosis, 2009, 89(3): 203-209. [10] Aguilar D, Hanekom M, Mata D, Gey van Pittius NC, van Helden PD, Warren RM, Hernandez-Pando R. Mycobacterium tuberculosis strains with the Beijing genotype demonstrate variability in virulence associated with transmission [J]. Tuberculosis, 2010, 90(5): 319-325. [11] Gagneux S. Fitness cost of drug resistance in Mycobacterium tuberculosis [J]. Clin Microbiol Infect, 2009, 15(Suppl 1): 66-68.3 讨论
