上调MiR-145的表达对口腔癌细胞CAL27生物学特性的影响
2014-06-27白艳霞吴胜利
邵 渊,白艳霞,权 芳,吴胜利
(西安交通大学医学院第一附属医院:1.耳鼻咽喉科;2.肝胆外科,陕西西安 710061)
MicroRNA(MiRNA)为一大类基因负性调控因子,参与了包括细胞分化、细胞凋亡等多种生理和病理过程[1]。有越来越多的证据表明,在多种人类恶性肿瘤中MiR-145具有抑癌作用[2]。但是,MiR-145在口腔癌发生过程中的作用仍不明确。本研究旨在研究口腔癌细胞CAL27与正常口腔黏膜细胞hNOK中MiR-145的表达水平,并探究MiR-145表达水平的变化对口腔癌细胞CAL27增殖、凋亡等细胞生物学特性的影响。
1 材料与方法
1.1材料人口腔癌细胞CAL27,人口腔黏膜角化细胞hNOK均从西安交通大学医学院生物实验中心获得。DMEM培养基、胎牛血清购自杭州四季青公司;二甲基亚砜(DMSO)购自美国Sigma公司;转染试剂脂质体Lipofectamin2000,细胞凋亡实验检测试剂盒、细胞周期实验检测试剂盒,购自美国Invitrogen公司;Trizol试剂购自大连TaKaRa公司;逆转录试剂盒选自Toyobo公司;PCR试剂盒选自Fermentas公司;Bugle-Loop MiRNA聚合酶链反应试剂盒购自上海GenePharma公司。
1.2细胞培养人口腔癌细胞CAL27、口腔黏膜角化细胞hNOK置于RPMI 1640培养基[含100 mL/L胎牛血清(FBS)]中在37 ℃下常规培养。
1.3RNA提取和实时定量PCR利用Trizol试剂从培养细胞中提取总RNA。利用PrimeScript®反转录试剂盒生成cDNA,最终反应体积为20 μL,其中包含500 ng RNA、0.5 μL PrimeScript®RT Enzyme Mix和4 μL的5倍PrimeScript®缓冲液及1 μL反转录引物。PCR试剂盒进行实时定量PCR检测以评估MiR-145的表达。根据2-ΔΔCt方法计算每份样本中所含RNA的相对量。引物序列:MiR-145正向引物,5′-GTCCAGTTTTCCCAGGAAT-3′,反向引物,5′-TGGTGTCGTGGAGTCG-3′。
1.4瞬时转染口腔癌细胞CAL27(1×106)置于100 mL/L胎牛血清(FBS)的1640培养液中,50 mL/L CO2,37 ℃条件下培养。用Lipofectamin2000试剂将MiR-145和MiR-145对照序列分别转染至CAL27细胞,具体方法可参照Lipofectamin2000操作手册。MiR-145和MiR-145对照序列由上海GenePharma公司合成,其序列分别为MiR-145:5′-GUCCAGUUUUCCCAGGAAUCCCU-3′;MiR-145阴性对照物5′-AGGUAGUGUAAUCGCCUUGTT-3′。阴性对照序列与人类基因组非同源。
1.5细胞集落形成实验在培养瓶中用含有胎牛血清的RPMI 1640培养液调待测细胞至1×106个,培养24 h后留取上清液,与含胎牛血清的RPMI 1640培养液按1:3的比例混合,37 ℃培养箱中培养。用磷酸盐缓冲液(PBS)配置琼脂糖,105 ℃进行消毒30 min后降温至45 ℃。留取一份琼脂糖溶液至10份培养液中,混匀后加至24孔板中。0.8 mL/孔。待软琼脂变硬后,将培养板置于37 ℃和50 mL/L CO2下培养。2周后,对集落进行照相,并在光学显微镜下进行细胞集落计数。
1.6细胞周期分析转染后72 h收获细胞,并用PBS(磷酸盐缓冲液)冲洗2次,然后置于冰上以700 mL/L乙醇固定至少30 min。接着用碘化丙啶溶液[含有50 μg/mL碘化丙啶、50 μg/mL RNase A(核糖核酸酶A)]、1 mL/L Triton-X和0.1 mmol/L EDTA进行细胞染色。利用流式细胞仪,根据DNA含量,通过FACS分析细胞周期。
1.7细胞凋亡分析将细胞由MiR-145和阴性对照序列转染24 h,转染后于48 h收获细胞,并用500 μL结合缓冲液进行再悬浮。在细胞悬液中加入5 μL Annexin-V-FITC和碘化丙啶,并于室温下培养20 min。在流式细胞仪上分析染色的细胞。
1.8统计学分析所有实验均重复3次。统计分析采用SPSS 11.0统计软件包。各数据以均数±标准差或百分数表示。根据数据特点各参数之间的比较选用χ2检验或t检验。P<0.05认为差异有统计学意义。
2 结 果
2.1CAL27和hNOK中MiR-145的表达MiR-145在正常口腔黏膜细胞hNOK中的表达量显著高于口腔癌细胞CAL27(0.809±0.124vs. 0.397±0.141) (P<0.05,图1)。

图1MiR-145在hNOK和CAL27中的表达水平
Fig.1 The expression of MiR-145 in hNOK and CAL27
*P<0.05vs. hNOK
2.2MiR-145抑制CAL27细胞生长通过集落形成实验,发现MiR-145对CAL27细胞生长具有抑制作用。与MiR-145阴性对照序列转染细胞相比,MiR-145转染细胞的集落数量明显减少(179.2±28.7vs. 91.6±23.6)(P<0.05,图2)。
2.3MiR-145诱导CAL27细胞周期阻滞肿瘤细胞的生长抑制通常与伴发的细胞周期阻滞以及细胞死亡通路激活有关。因此,我们研究了细胞周期阻滞和凋亡对于所观察到的MiR-145转染细胞生长抑制的促进作用。如图3所示,与对照组相比,MiR-145转染细胞后发生G1期细胞周期阻滞,G1周期百分比从(66.57±1.4)%增至(76.78±1.8)%(P<0.05)。
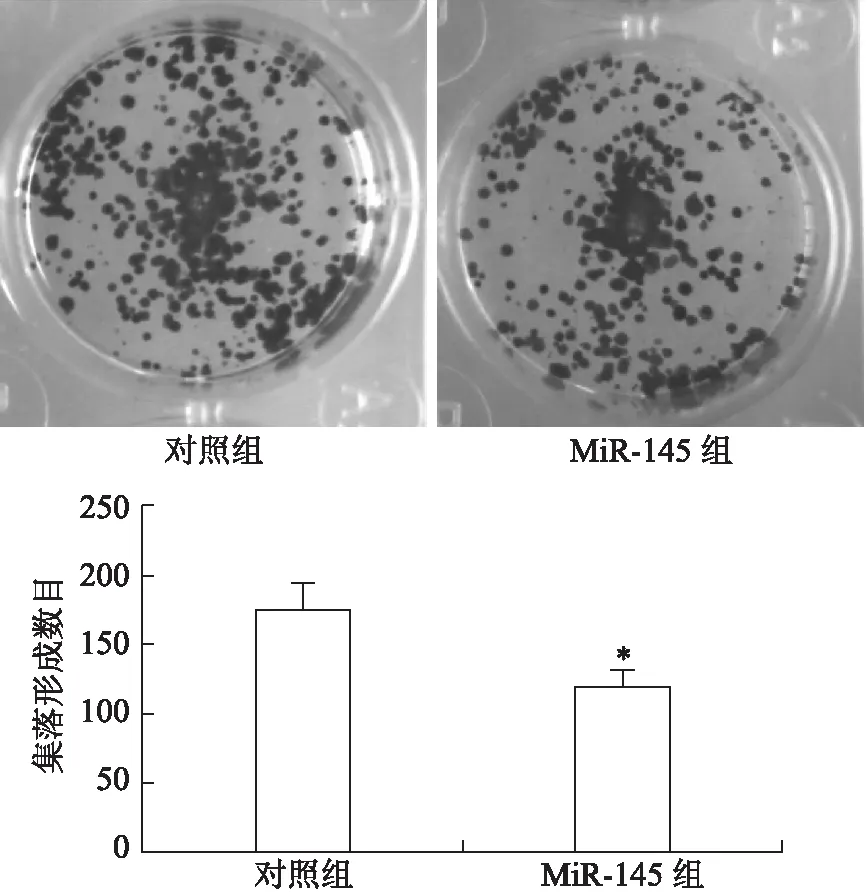
图2转染MiR-145对口腔细胞癌CAL27集落形成的影响
Fig.2 Effects of MiR-145 transfection on colony formation of oral carcinoma cell CAL27
*P<0.05,vs对照组。
2.4MiR-145诱导CAL27细胞凋亡与MiR-145对照序列转染细胞相比,MiR-145 转染细胞中的凋亡(尤其是晚期凋亡)细胞数量增加[(10.3±1.7)%vs. (5.6±1.1)%,P<0.05,图4]。
3 讨 论
MicroRNA(MiRNA)是目前肿瘤研究领域的热点之一,已发现和注册的MiRNAs已达数千种。大量的研究表明,MiRNAs作为内源性非编码的小分子RNA,参与并调控了细胞的增殖、凋亡及分化过程,作为原癌基因或抑癌基因参与肿瘤的形成与进展[3]。MiR-145是MiRNAs大家庭中的一员,定位于5号染色体,长约4.09 kb,是肿瘤发生发展中的一个潜在的保护性MiRNA,可通过与靶基因mRNA3’UTR完全性互补或不完全性互补并降解靶基因mRNA或仅抑制其翻译过程[4],可显著影响肿瘤细胞的生长、侵袭及凋亡的过程[5]。

图3转染MiR-145对口腔细胞癌CAL27细胞周期的影响
Fig.3 Effects of MiR-145 transfection on cell cycle of oral carcinoma CAL27
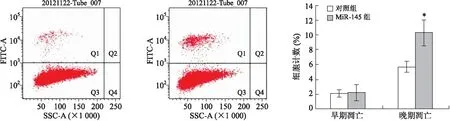
图4转染MiR-145对口腔细胞癌CAL27细胞凋亡的影响
Fig.4 Effects of MiR-145 transfection on cell apoptosis of oral carcinoma CAL27
*P<0.05,vs.对照组。
关于癌细胞中 MiRNA 的表达谱变化及其在肿瘤发生中作用的研究越来越受到重视[6],初步证明乳腺癌、结直肠癌、胃癌、前列腺癌等患者血清具有特定的MiRNA表达谱[7],而MiR-145在上述肿瘤中表达均明显下调[8],说明MiR-145作为肿瘤相关基因在其发生、发展中发挥着重要的作用。目前,MiR-145 在口腔癌发生、发展的相关研究中的报道较少。为了明确MiR-145对口腔细胞癌增殖、凋亡及细胞周期的影响,在本研究中,我们检测口腔癌细胞CAL27和正常口腔黏膜细胞hNOK中的MiR-145表达,并探究在口腔癌发生过程中MiR-145所发挥的生物学功能。我们的数据显示,与正常口腔黏膜细胞相比,口腔癌细胞CAL27中的 MiR-145表达显著下调,提示在口腔细胞癌的发病机制中MiR-145可能为潜在的抑癌因子。MiR-145的表达下调或沉默可能会消除肿瘤抑制作用,从而有助于口腔癌发生。因此,我们检测了CAL27中 MiR-145 的假定肿瘤抑制功能。将MiR-145通过脂质体瞬时转染至口腔癌细胞CAL27,通过与对照组相比,观察其对细胞增殖、凋亡等特征的影响。在本研究中,CAL27细胞中的MiR-145恢复表达抑制了细胞的集落形成,从而呈现明显的细胞生长抑制作用,同时MiR-145 恢复表达诱导了细胞周期阻滞和凋亡,这进一步表明它具有肿瘤抑制功能。这些研究结果为后期进一步确定其下游基因及开展口腔细胞癌的靶向基因治疗提供了依据。
目前,口腔细胞癌的治疗仍采取以手术为主的方法。由于颌面部血供丰富,术后出现的复发和转移影响了肿瘤的预后。MicroRNA介导的肿瘤分子靶向治疗将可能成为根治肿瘤的重要的发展方向。而MiR-145被认为是一种具有肿瘤抑制作用的MiRNA,在肺癌、乳腺癌、骨肉瘤细胞、宫颈癌和膀胱癌等均呈低表达状态。因此,通过上调MiR-145的表达,可能对肿瘤细胞生物学特性发挥重要的作用。有研究表明,上调乳腺癌细胞株MCF-7、MDA-MB-468和子宫内膜癌细胞MiR-145的表达水平,可明显下调细胞间粘合蛋白JAMA和actin结合蛋白fascin的表达水平,抑制细胞的侵袭转移能力[9]。通过上调MiR-145在乳腺癌细胞TP53的表达水平可促进其凋亡特性[10]。上调MiR-145还可提高结肠癌细胞对化疗药5-氟尿嘧啶的敏感性[11]。本研究结果表明,上调MiR-145的表达对于口腔细胞癌的治疗亦存在一定的潜在空间。
MiR-145作为肿瘤诊断的血清学标记物逐渐受到重视。目前,肿瘤的诊断及临床分期主要依赖于组织学及放射影像学方法。近期的实验研究表明,肿瘤组织的MiR-145可在血清的标本中检测。其优点是获得标本简单、无创、易得并可避免内源性RNA酶的降解。已证明在多种恶性肿瘤患者中,其血清具有特定的MiRNA表达谱。
综上所述,对MiR-145应用于口腔癌的早期诊断及治疗的研究具有广泛的前景,对于MiR-145的分子表达及生物学意义的深入认识,确定其调控表达的分子机制,对于口腔癌乃至其他恶性肿瘤的诊治具有深远的意义。
参考文献:
[1] BARTEL DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2):281-297.
[2] DU L, PERTSEMLIDIS A. MicroRNAs and lung cancer: tumors and 22-mers[J]. Cancer Metastasis Rev, 2010, 29(1):109-122.
[3] MELO SA, ESTELLER M. Dysregulation of microRNAs in cancer: playing with fire[J]. FEBS Lett, 2010, 585(13):2087-2099.
[4] GARZON R, CALIN GA, CROCE CM. MicroRNAs in cancer[J]. Annu Rev Med, 2009, 60(1):167-179.
[5] CHO WC, CHOW AS, AU JS. MiR-145 inhibits cell proliferation of human lung adenocarcinoma by targeting EGFR and NUDT1[J]. RNA Biology, 2011, (8):1-7.
[6] PARPART S, WANG XW. MicroRNA regulation and its consequences in cancer[J]. Curr Pathobiol Rep, 2013, 1(1):71-79.
[7] SACHDEVA M, MO YY. MicroRNA-145 suppresses cell invasion and metastasis by directly targeting mucin 1[J]. Cancer Res, 2010, 70(1):378-387.
[8] TAKAGI T, LIO A, NAKAGAWA Y, et al. Decreased expression of microRNA-143 and -145 in human gastric cancers[J]. Oncology, 2009, 77(1):12-21.
[9] GOTTE M, MOHR C, KOO CY, et al. MiR-145-dependent targeting of junctional adhesion molecule A and modulation of fascin expression are associated with reduced breast cancer cell motility and invasiveness[J]. Oncogene, 2010, 29(50):6569-6580.
[10] SPIZZO R, NICOLOSO MS, LUPINI L, et al. MiR-145 participates with TP53 in death-promoting regulatory loop and targets estrogen receptor-alpha in human breast cancer cell[J]. Cell Death Differ, 2010, 17(2):246-254.
[11] ZHANG J, GUO H, ZHANG H, et al. Putative tumor suppressor miR-145 inhibits colon cancer cell growth by targeting oncogene friend leukemia virus integration 1 gene[J]. Cancer, 2011, 117(1):85-95.
